2. 河南科技大学牡丹学院 洛阳 471023
2. College of Tree Peony, Henan University of Science and Technology, Luoyang 471023, China
野燕麦(Avena fatua L.)是禾本科燕麦属一年生或二年生草本植物, 属田间恶性杂草, 在欧洲、北美洲、非洲、澳洲以及亚洲温寒地带地区均有分布。其分蘖能力强、繁殖率高、适应广泛, 是田间农作物的主要威胁[1]。目前, 我国16个省区约160万hm2农田遭受野燕麦侵害, 其中冬麦区危害率达15.6%, 春麦区危害率达25.3%, 每年导致粮食减产约17.5亿kg[2]。
野燕麦植株外形与小麦(Triticum aestivum L.)相似, 但生长较小麦更为迅速。野燕麦具有较发达的根系, 可以与小麦直接竞争土壤水分和养分; 庞大的土壤种子库可以维持其强大的繁殖能力[3-6], 并且可以依靠种子休眠渡过不利的外界环境以及躲避鸟类的捕食[7]。野燕麦对某些环境胁迫因子具有较强的耐受性, 在重金属污染、酚酸类物质胁迫条件下也可以很好的生长[1, 8]。正是由于野燕麦的这些生长、繁殖与抗逆特性, 使其在与小麦的竞争中往往处于优势地位。目前, 如何对野燕麦进行有效防除面临很多困难, 小麦播种前选种、人工拔除、大田轮作以及使用化学除草剂是可以选择的几种常规方法。但小麦播种前选种与人工拔除不仅成本高昂, 而且防除效果并不显著, 大田轮作又会受到地理位置与农民耕作习惯等诸多因素限制, 因此大田喷施化学除草剂就成为防治野燕麦的主要措施[9]。而使用化学除草剂也有诸多弊端[10-11], 具体包括: 1) 施用早期效果明显, 但后期效果又会下降, 混合施用多种除草剂会增加防控成本; 2) 只能杀灭地上植株, 而不能彻底清除其地下繁殖体; 3) 存在降低小麦食用安全性与污染周边环境的潜在风险; 4) 长期使用会使野燕麦逐渐产生耐药性等。因此, 在深入了解野燕麦的基础生物学、种群生态学以及生理生态特性基础上, 摸索一种防治野燕麦的综合性生态治理方法十分必要。
前人的研究多集中于野燕麦作为一种农田杂草的危害性以及使用化学除草剂的防除效果[11-12], 但是对野燕麦作为有害杂草的生理生态机理研究非常有限。尽管有研究者分析了野燕麦地上植株对小麦种子萌发的抑制作用[13], 却忽略了野燕麦地下部分对小麦的影响, 这不利于全面了解野燕麦的异株克生作用。本试验在调查野燕麦基本生物学特性、开花结实动态、种子扩散方式等基础上, 对野燕麦逆境下的种子萌发特性、幼苗生长状态、地下根系对小麦的他感效应等进行了研究, 以期为探索合理有效的野燕麦防治措施提供理论依据。
1 材料与方法 1.1 试验材料试验所用野燕麦种群分布于河南科技大学小麦试验田中, 属自然生长; 野燕麦幼苗为实验室内种子培养; 供试小麦为普通小麦, 品种为‘豫教5号’。
1.2 试验方法 1.2.1 野燕麦基本生物学特征与开花结实特性在冬小麦返青期, 野燕麦分蘖期(2014年3月初), 于小麦试验田中随机选择20株野燕麦, 用卷尺测量株高, 调查分蘖数; 在小麦试验田中随机选取5个1 m×1 m的样方, 调查野燕麦植株数量, 测定密度; 随机选择20株野燕麦, 标记挂牌观察其不同发育阶段的开花与结实动态; 随机选取10株处于种子完熟期的野燕麦, 在105 ℃高温下杀青1 h后, 烘箱内温度稳定在75 ℃条件下干燥24 h, 测定根、茎、叶、果穗、种子干重, 计算生物量及千粒重。
1.2.2 野燕麦及其共生植物的种群分布格局野燕麦植株开花后期, 在小麦大田随机选定一点, 设置一条100 m样线, 从选取点开始每隔10 m设置一个1 m×1 m调查样方, 共10个样方。记录样方中野燕麦植株数和主要的伴生杂草数。根据Poisson分布预期假设原理计算各物种的种群分布格局[14]。
1.2.3 野燕麦的种子扩散特性小麦大田内的野燕麦种子达到蜡熟期时, 随机选择5个间隔距离在50 m以上的1 m×1 m样方, 用荧光剂标记样方内野燕麦植株上的所有种子。然后以这5个样方为中心, 在4个不同方向上设置5个不同距离(0~10 m、11~20 m、21~30 m、31~40 m和41~50 m)。每个距离内每隔2 m再连续设置5个1 m×1 m样方, 夜间对样方内带有荧光的野燕麦种子进行计数, 测定野燕麦种子扩散距离与扩散密度。
1.2.4 野燕麦种子萌发特性温度对野燕麦种子萌发的影响:分为室温萌发、冷冻后室温萌发、恒温萌发3个处理, 每个处理3次重复。选择30粒大小一致的成熟野燕麦种子, 均匀摆放到120 mm玻璃培养皿中, 在水分充足条件下进行萌发。室温萌发处理是未做任何温度处理在室温(10~20 ℃)条件下自然萌发。冷冻后室温萌发处理是将野燕麦种子在普通冰箱的冷冻室中(-18 ℃)冷冻72 h后取出后在室温条件下萌发。恒温萌发处理是将野燕麦种子放置在22 ℃的恒温培养箱中萌发。每个培养皿每隔24 h添加一次蒸馏水, 记录芽长、根长、根数和发芽数等数据。
盐胁迫对野燕麦种子萌发的影响:选择30粒大小一致的成熟野燕麦种子, 均匀摆放到120 mm玻璃培养皿中, 分别添加不同浓度NaCl溶液(0 g∙L-1、3 g∙L-1、6 g∙L-1、9 g∙L-1、12 g∙L-1、15 g∙L-1和18 g∙L-1)10 mL, 其中0 g∙L-1为清水对照。每个处理3次重复, 室温条件下萌发周期10 d, 每日记录种子萌发数量。
1.2.5 盐胁迫和干旱胁迫对野燕麦幼苗脯氨酸含量和过氧化氢酶活性的影响用NaCl溶液模拟盐胁迫, 配置浓度分别为0 g∙L-1、10 g∙L-1、20 g∙L-1与30 g∙L-1。用PEG6000溶液模拟干旱胁迫, 其浓度分别为0 g∙L-1, 100.0 g∙L-1、200.0 g∙L-1和300.0 g∙L-1(溶液渗透势分别相当于0 MPa、-0.5 MPa、-1.0 MPa和-1.5 MPa)。选择30粒大小一致的成熟野燕麦种子, 经低温处理解除休眠后, 放置于120 mm玻璃培养皿中进行清水萌发。4周后野燕麦长出1~2片叶子, 此时将32个培养皿随机平均分为2组, 每组16个, 分别用不同浓度NaCl与PEG 6000进行模拟盐胁迫和干旱胁迫处理。处理液添加顺序按浓度梯度依次进行, 每次每个培养皿添加处理液10 mL。添加第1个浓度的NaCl或PEG 6000溶液处理48 h后, 在每个培养皿内随机剪取0.2 g野燕麦叶片混合研磨, 测定其脯氨酸含量和CAT活性[15]。然后将培养皿中处理液倒掉, 用蒸馏水清洗根部后, 再添加下一浓度处理液, 48 h后进行相同操作, 以此类推, 直至每一浓度处理液处理后野燕麦幼苗叶片的脯氨酸含量和CAT活性全部测定完成。试验在室温下进行, 自然采光, 通风良好。
1.2.6 野燕麦根系浸出物对小麦幼苗的他感作用将在小麦田里随机采集的野燕麦根系洗干净后粉碎, 制备成浓度梯度分别为0 g∙mL-1、0.025 g∙mL-1、0.050 g∙mL-1、0.100 g∙mL-1与0.200 g∙mL-1的处理液, 其中0 g∙mL-1为清水对照。小麦种子在实验室常温条件下置于120 mm玻璃培养皿中萌发, 7 d后选择生长势一致的300株小麦幼苗移栽到200 mm的PVC培养钵中培养, 基质为小麦大田中0~20 cm表层土。共15个培养钵, 随机分为5组, 每组处理3次重复。每天用不同浓度处理液(50 mL)浇灌, 连续处理14 d。在第15 d测定小麦幼苗株高、主根长和整株地上生物量, 采用TTC法测定小麦幼苗根系活力[16]。
1.3 数据统计分析用Microsoft Excel 2010软件完成全部数据处理与图表制作, 用SPSS 18.0统计软件中的ANOVA模块分析各处理间的差异显著性。
2 结果与分析 2.1 野燕麦的基本生物学特征与开花结实动态如表 1所示, 成熟期的野燕麦植株高大, 平均株高可达76.25 cm, 分蘖数较小麦多。茎生物量、叶生物量、穗生物量的分配有较大差别, 从表 1中可以看出, 野燕麦植株在繁殖器官的生物量分配最大, 营养器官的生物量分配较低。从穗粒数、千粒重及单位面积内植株密度可以看出, 野燕麦的种子穗粒数较小麦高(小麦穗粒数约为35)。土壤中平均每立方米野燕麦种子数量可达76.8×106粒。
| 表1 野燕麦的基本生物学特征 Table 1 Biological characteristics of wild oat |
植物的开花与结实动态与其能否成功繁殖密切相关。从表 2可知, 野燕麦在4月20日开始开花, 7 d之后达到盛花期; 5月4日开始结实; 5月9日, 灌浆已基本结束, 籽粒开始变硬, 但仍有小部分植株可以开花, 此时为野燕麦种子乳熟期; 5月13日, 野燕麦进入蜡熟期, 此时1/3左右的种子已开始自然脱落; 5月21日野燕麦种子基本进入完熟期, 大多数种子开始脱落, 植株也开始枯萎。
| 表2 野燕麦的开花与结实动态 Table 2 Flowering and seed forming dynamic of wild oat |
种群分布格局是植物种群生物学特性对环境条件长期适应和选择的结果。野燕麦与其共生杂草的种群分布格局如表 3所示。野燕麦种群的主要伴生植物包括猪殃殃[Galium aparine var. tenerum (Gren. et Godr.) Rchb.]、狗尾草[Setaria viridis (L.) Beauv]和看麦娘(Alopecurus aequalis Sobol.), 且这4种主要植物的V/m值(方差variance与均值mean的比值)均大于1, 因此可以判断小麦田中的野燕麦及其伴生杂草的种群分布格局均为集群分布[14]。其中看麦娘集群分布特征更为明显。
| 表3 野燕麦及其共生植物的种群分布格局 Table 3 Population distribution pattern of wild oat and its symbiotic plants |
植物的种子扩散机制对植物种群的更新及群落内植物的演替具有重要影响。根据对野燕麦种子扩散特性的研究(图 1)可知, 扩散距离越近野燕麦种子扩散的密度就越大, 而扩散距离越远燕麦种子扩散的密度也就越小。野燕麦种子在10 m范围扩散密度最大, 可达460粒·m-2。随着扩散距离的增加, 野燕麦扩散密度逐渐减小, 50 m处种子密度接近于零。
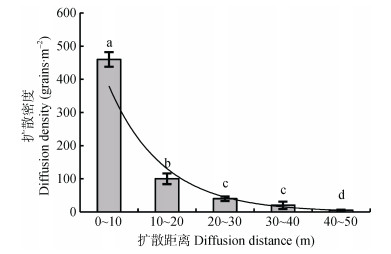
|
图 1 野燕麦种子扩散距离与扩散密度的关系 Figure 1 Relationship between diffusion distance and diffusion density of wild oat seeds 图中不同小写字母表示扩散距离间差异显著(P < 0.05)。 Different lowercase letters mean significant differences at 0.05 level among diffusion distances. |
温度是影响植物种子萌发的重要环境因子。不同温度处理条件下野燕麦种子的萌发特性如图 2所示。室温萌发与冷冻后室温萌发条件下野燕麦种子芽长、根长、根数增加最为明显, 且在7 d时均显著大于恒温萌发处理(P < 0.01, 图 2A, 2B, 2C)。恒温条件下野燕麦种子的发芽率最低, 仅60%左右; 而室温和与冷冻后室温萌发条件下野燕麦种子发芽率达90%以上, 二者没有显著差异(P > 0.05, 图 2D)。上述结果表明, 变温可以促进野燕麦种子的萌发, 对于打破野燕麦种子休眠十分有利。
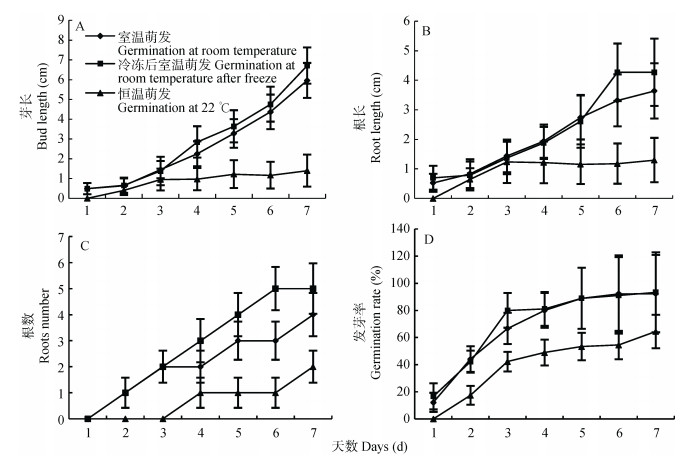
|
图 2 不同温度处理条件下野燕麦种子的萌发特性 Figure 2 Germination characteristics of wild oat seeds under different temperature treatments |
盐胁迫是植物种子萌发期主要的非生物逆境之一。盐胁迫对野燕麦种子萌发的影响如图 3所示。NaCl对野燕麦种子萌发具有较强的抑制作用, 仅有少量种子可以萌发。随着处理时间的变化, 除15~18 g∙L-1NaCl浓度处理下的野燕麦种子基本没有萌发外(平均累计发芽数小于2, 发芽率 < 8.3%), 其他各浓度(3~12 g∙L-1)盐胁迫下种子萌发变化趋势一致, 发芽数均逐渐增加, 平均累计发芽数为5~7(发芽率为16.7%~23.3%)。结果表明, 萌发过程中野燕麦种子对NaCl胁迫具有一定的抗性, 其发芽数虽然显著降低(P < 0.01), 但随着时间推移部分种子依然可以萌发。
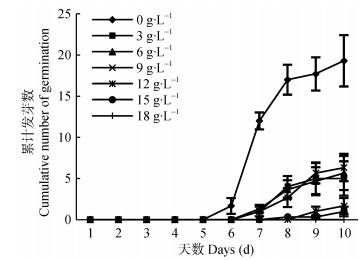
|
图 3 不同浓度NaCl对野燕麦种子萌发的影响 Figure 3 Effects of different concentrations NaCl on seed germination of wild oat |
盐分和干旱胁迫是制约植物幼苗生长的重要因素。野燕麦幼苗叶片脯氨酸含量受盐胁迫和干旱胁迫的影响如图 4所示。野燕麦幼苗叶片脯氨酸含量随着NaCl浓度增加呈上升趋势(图 4A), 且显著大于清水对照(P < 0.01)。但不同NaCl浓度处理之间差异不显著(P > 0.05)。野燕麦幼苗叶片脯氨酸含量随着PEG浓度增大而增加(图 4B), 各浓度处理均显著大于清水对照(P < 0.01)。在PEG浓度为200 g∙L-1时野燕麦叶片脯氨酸含量最高, 随后呈现微弱降低趋势。相比较低浓度PEG处理, 较长时间高浓度PEG处理(300 g∙L-1)会导致野燕麦幼苗叶片脯氨酸含量少量降低(P < 0.05)。
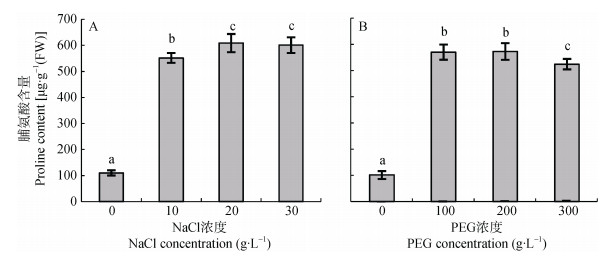
|
图 4 NaCl与PEG胁迫处理对野燕麦幼苗叶片脯氨酸含量的影响 Figure 4 Effects of NaCl and PEG treatments on leaf proline contents in wild oat 不同小写字母表示不同NaCl浓度或PEG浓度间差异显著(P < 0.05)。 Different lowercase letters mean significant differences at 0.05 level among NaCl concentrations or PEG concentrations. |
盐胁迫和干旱胁迫对野燕麦幼苗叶片过氧化氢酶活性的影响如图 5所示。不同浓度NaCl处理条件下野燕麦幼苗叶片中过氧化氢酶活性呈波动式变化(图 5A), 随着NaCl浓度升高, 过氧化氢酶活性呈现降低—升高—降低规律。浓度为20 g∙L-1的NaCl溶液处理野燕麦幼苗叶片过氧化氢酶活性显著大于10 g∙L-1和30 g∙L-1NaCl处理(P < 0.01), 但三者与清水对照相比均显著降低(P < 0.01)。表明野燕麦幼苗对NaCl胁迫具有阶段性适应过程。与盐胁迫处理结果相似, 不同浓度PEG处理条件下野燕麦幼苗叶片过氧化氢酶活性同样具有波动性(图 5B), 表明野燕麦对干旱胁迫同样具有阶段性适应过程。
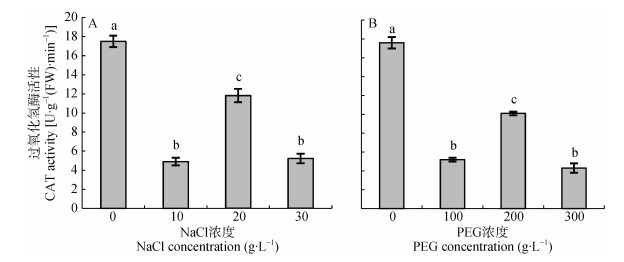
|
图 5 NaCl与PEG胁迫对野燕麦幼苗叶片过氧化氢酶活性的影响 Figure 5 Effects of NaCl and PEG treatments on leaf CAT activity in wild oat 不同小写字母表示不同NaCl浓度或PEG浓度间差异显著(P < 0.05)。 Different lowercase letters mean significant differences at 0.05 level among NaCl concentrations or PEG concentrations. |
异株克生现象在自然界中普遍存在, 某些植物可以通过根系分泌的有机化合物对其他植物施加影响。野燕麦根系水浸提液对小麦幼苗的形态特征与根系活力影响结果如图 6所示。随着野燕麦根系水浸提液浓度的增大, 小麦幼苗株高、根长、生物量与根系活力所受到的抑制程度显著增加, 尤其是在0.100 g·mL-1与0.200 g·mL-1浓度下, 与清水对照相比差异达到极显著水平(图 6A)。野燕麦根系水浸提液对小麦干重的影响相对较小, 但对小麦根长和根系活力的抑制作用最为明显, 在最大浓度时(0.200 g·mL-1)小麦根长与根系活力比对照分别降低约3.20倍和4.98倍(图 6B, 6D)。上述结果表明, 野燕麦根系水浸提液对小麦幼苗具有非常强烈的异株克生作用。
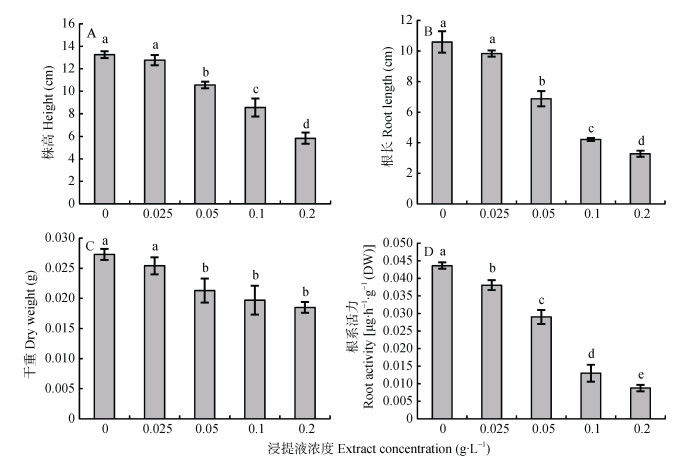
|
图 6 野燕麦根系水浸液对小麦幼苗的异株克生效应 Figure 6 Allelopathy effects of wild oat root aqueous extracts on wheat seedlings 不同小写字母表示不同浸提液浓度间差异显著(P < 0.05)。 Different lowercase letters mean significant differences at 0.05 level among extract concentrations. |
作为一种禾本科田间恶性杂草, 野燕麦的种群竞争力及其化感效应是造成农作物产量显著下降的重要原因[17]。我们的试验结果表明, 野燕麦较强的繁殖能力是维持其竞争优势的重要体现, 其土壤种子库稳定且种子储备量高, 这与Maxwell等和Wu等[18-19]的研究结果类似。种群集群又使野燕麦在一定空间尺度上扩散密度很高, 这种扩散机制对小麦产量具有一定的消极影响[20-22]。除此之外, 种子成熟期野燕麦的生物量主要集中在茎和果穗上, 分配比例在50%左右, 表明野燕麦为了保证其繁殖而将更多的能量分配到繁殖器官, 有助于其依靠种子度过不良环境, 保持种群的稳定。野燕麦成熟种子的一个重要特性是存在极端休眠, 从生理生态角度进行深入研究, 找到打破野燕麦种子休眠的最佳方式, 使其集中萌发后立即进行防除, 有助于降低野燕麦的田间种子密度[23]。而我们的研究结果表明, 野燕麦在恒温、室温、冷冻后室温条件下均有发芽现象, 说明适宜于野燕麦种子萌发的温度范围较广。Shahvand等[23]的试验证明, 野燕麦种子在2~5 ℃条件下发芽率最高, 这与我们的结果比较吻合, 而且说明低温对野燕麦种子萌发的影响较大, 基本打破了野燕麦的种子休眠。
植物抗逆性是多数植物响应环境胁迫的普遍方式[24]。作为植物体细胞内抗氧化系统的重要组成部分, 过氧化氢酶(CAT)活性变化对于判断植物受到外界胁迫后机体功能是否受损具有重要指示作用[25]。本研究中, 野燕麦在遭受盐胁迫后, 叶片内CAT活性呈下降、升高、再下降的趋势, 且处理间的差异显著, 具有明显的波动性, 说明野燕麦能够在一定范围内适应盐胁迫, 对不同浓度的NaCl具有阶段性适应过程。而植物对盐胁迫的适应性已被多数试验证明[26-28]。植物受到盐胁迫或干旱时, 体内还会积累大量的游离脯氨酸以维持细胞的正常功能, 其含量会随着胁迫程度的增大而升高, 帮助植物在干旱逆境下适应缺水条件[29-30]。我们的研究表明, 随着盐浓度逐渐增加, 脯氨酸含量呈上升趋势, 盐胁迫诱导脯氨酸含量大幅增加, 这是野燕麦适应盐胁迫的重要机制。而随着盐浓度的升高脯氨酸并未显著降低, 这说明其耐盐能力较强。而在干旱胁迫初期野燕麦叶片脯氨酸含量稍有增加, 但随后就开始下降, 在后期明显降低。可能是因为随着干旱程度的加重, 野燕麦能够获取的水分也越来越少, 野燕麦叶片的生理功能受损, 从而导致脯氨酸含量显著降低, 这同王丽丽等[31]的研究结果一致。
农田杂草的异株克生作用会对共生农作物的生长和产量产生不利影响[32]。野燕麦根系能够分泌有毒物质, 从而抑制其他物种的生长发育, 为其适应农田环境、建立稳定种群提供相对优势[33]。本试验结果显示, 野燕麦的根系水浸提液对小麦幼苗的苗高、根长、生物量和根系活力均有显著的抑制作用, 且这种抑制作用随着野燕麦根系水浸提物浓度的增加而增大。其他类似试验也发现, 野燕麦的根系水浸提液对小麦苗高、根长和鲜重都有影响作用[34], 这与本试验的研究结果类似。而我们的试验设计了浓度梯度差, 可以反映出这种抑制作用的计量效应。此外, 我们的研究结果还证明野燕麦根系水浸提液会对小麦幼苗根系活力产生抑制作用, 而根系活力水平直接影响植物生理功能。野燕麦根系对小麦产生异株克生作用的物质, 目前已有研究初步确定为东莨菪内酯、香豆素、对羟基苯甲酸和香草酸等根系分泌成分[35]。但究竟是哪一种成分起主导作用, 还需要在今后的试验中加以明确。
除了作为一种农田恶性杂草外, 野燕麦同时也是区域性的外来入侵植物[36-37]。而外来入侵植物的竞争优势, 首先体现在具有强大的繁殖能力与独特的种群扩散机制[38]。我们的试验表明, 野燕麦的株丛密度为12.9株·m-2; 生物量的分配更多地倾向于繁殖器官; 种群分布格局呈集群分布的同时, 野燕麦的土壤种子库高达76.8×106粒·m-3, 这些繁殖特性保证了野燕麦种群竞争力与成功入侵。其次, 外来入侵植物具有很强的环境适应性[38]。野燕麦种子的萌发对温度的适应范围较广, 尤其是在冷冻后再在常温条件下萌发, 其种子萌发率可以达到最大化。这与野燕麦种子具有休眠特性有关, 目前还没有特别有效的方法去预测野燕麦种子的萌发规律[39]。野燕麦对盐胁迫与干旱胁迫具有较强的耐受性, 其幼苗能够在不同浓度盐胁迫与PEG胁迫下, 依靠脯氨酸含量的积累和过氧化氢酶活性的升高来适应外界不同程度的恶劣环境。最后, 与其他许多外来入侵植物相似, 野燕麦地上部分和地下根系均可以分泌化感物质, 对共生植物产生异株克生作用[13, 33]。我们的试验结果表明, 野燕麦对小麦幼苗苗高、根长、根系活力和生物量都有明显的抑制作用, 且这种抑制作用随着野燕麦根系水浸提液的浓度增大而增强。野燕麦对小麦异株克生作用, 既限制了小麦的正常生长, 又为争夺水肥资源与占据有限空间提供了保障。由此可知, 以上野燕麦的竞争优势不仅为其成功侵入农田提供了保障, 同时也使得野燕麦的防除工作变得更为复杂。
综上所述, 从繁殖生态与生理生态学角度对野燕麦的繁殖、抗逆特性及其对小麦的异株克生效应进行探究, 所得试验结果可证明: 1) 野燕麦的繁殖能力较强, 具有较大的土壤种子库且种子具有休眠特性; 2) 野燕麦对干旱胁迫和盐胁迫具有阶段适应性特征, 叶片脯氨酸含量和CAT活性呈现降低—升高—降低的波动式变化; 3) 野燕麦根系分泌物对小麦具有异株克生作用, 主要体现为显著抑制了小麦的生长与根系活力。以上特性是野燕麦成为农田恶性杂草与区域入侵植物的重要原因。而目前市场上的化学药剂对野燕麦的防除作用并不彻底且难以保证与其共生农作物的安全。因此在对野燕麦进行防除时, 应综合考虑各类生物与环境要素, 以便达到最大限度、更为有效的防治目的。
| [1] |
施宠, 王纯利, 黄长福, 等.
镉胁迫对野燕麦幼苗生长及其生理特性的影响[J]. 草地学报, 2015, 23(3): 526–532.
Shi C, Wang C L, Huang C F, et al. Effects of Cd stress on the growth and physiological characteristics of Avena fatua seedlings[J]. Acta Agrestia Sinica, 2015, 23(3): 526–532. DOI:10.11733/j.issn.1007-0435.2015.03.014 |
| [2] |
魏守辉, 张朝贤, 朱文达, 等.
野燕麦对不同小麦品种产量性状的影响及其经济阈值[J]. 麦类作物学报, 2008, 28(5): 893–899.
Wei S H, Zhang C X, Zhu W D, et al. Influence of Avena fatua on the yield characters of different wheat cultivars and its economic threshold[J]. Journal of Triticeae Crops, 2008, 28(5): 893–899. |
| [3] | Ponce R G. Competition for N and P between wheat and wild oats (Avena sterilis L.) according to the proximity of their time of emergence[J]. Plant and Soil, 1987, 102(1): 133–136. DOI:10.1007/BF02370914 |
| [4] | Balyan R S, Malik R K, Panwar R S, et al. Competitive ability of winter wheat cultivars with wild oat (Avena ludoviciana)[J]. Weed Science, 1991, 39(2): 154–158. |
| [5] | Mickelson J A, Stougaard R N. Assessment of soil sampling methods to estimate wild oat (Avena fatua) seed bank populations[J]. Weed Science, 2011, 51(2): 226–230. |
| [6] | Gallandt E R, Fuerst E P, Kennedy A C. Effect of tillage, fungicide seed treatment, and soil fumigation on seed bank dynamics of wild oat (Avena fatua)[J]. Weed Science, 2004, 52(4): 597–604. DOI:10.1614/WS-03-078R |
| [7] | Sharma M P, Born W H V. The biology of Canadian weeds:27. Avena fatua L.[J]. Canadian Journal of Plant Science, 1987, 58(1): 141–157. |
| [8] |
邵庆勤, 杨安中, 何克勤.
酚酸类物质对野燕麦萌发及幼苗生长的影响[J]. 中国农学通报, 2009, 25(7): 158–161.
Shao Q Q, Yang A Z, He K Q. The effects of phenolic acids on germination of the wild oat and growth of seedling[J]. Chinese Agricultural Science Bulletin, 2009, 25(7): 158–161. |
| [9] | Jones R, Medd R. Economic analysis of integrated manage-ment of wild oats involving fallow, herbicide and crop rota-tional options[J]. Australian Journal of Experimental Agri-culture, 1997, 37(6): 683–691. DOI:10.1071/EA97036 |
| [10] | Beckie H J, Hall L M, Meers S, et al. Management practices influencing herbicide resistance in wild oat1[J]. Weed Tech-nology, 2004, 18(3): 853–859. DOI:10.1614/WT-03-124R |
| [11] | Owen M J, Powles S B. The frequency of herbicide-resistant wild oat (Avena spp.) populations remains stable in western Australian cropping fields[J]. Crop & Pasture Science, 2017, 67(5): 520–527. |
| [12] |
朱文达, 喻大昭, 何燕红, 等.
野燕麦防除对冬小麦田间光照、养分和水分的影响[J]. 华中农业大学学报, 2010, 29(2): 160–163.
Zhu W D, Yu D Z, He Y H, et al. The influence of Avena fatua L. control on the light penetration rate, nutrition and moisture in winter wheat fields[J]. Journal of Huazhong Agricultural University, 2010, 29(2): 160–163. |
| [13] |
田迎迎. 野燕麦地上部分化感潜力物质的分离与鉴定及对小麦的化感作用[D]. 北京: 中国农业科学院, 2012
Tian Y Y. Isolation and identification of potential allelochemicals from aerial parts of Avena fatua L. and their allelopathic effect on wheat[D]. Beijing:Chinese Academy of Agricultural Sciences, 2012 |
| [14] |
吴志毅, 王明玖, 李志强, 等.
2种方法在荒漠草原植物种群分布格局中的适用性比较[J]. 草业科学, 2008, 25(4): 145–147.
Wu Z Y, Wang M J, Li Z Q, et al. Suitability comparison of two methods for population distribution patterns measure in desert steppe[J]. Pratacultural Science, 2008, 25(4): 145–147. |
| [15] |
赵世杰, 史国安, 董新纯.
植物生理学实验指导[M]. 北京: 中国农业科学技术出版社, 2002: 132-139.
Zhao S J, Shi G A, Dong X C. Techniques of Plant Physiological Experiment[M]. Beijing: China Agriculture Science and Technology Press, 2002: 132-139. |
| [16] |
张志良, 瞿伟菁, 李小方. 植物生理学实验指导(第四版)[M]. 第4版. 北京: 高等教育出版社, 2009: 30-32
Zhang Z L, Qu W J, Li X F. Experimental Guidance for Plant Physiology[M]. 4th ed. Beijing:Higher Education Press, 2009:30-32 |
| [17] | Armin M, Asghripour M. Effect of plant density on wild oat competition with competitive and non-competitive wheat cultivars[J]. Agricultural Sciences in China, 2011, 10(10): 1554–1561. DOI:10.1016/S1671-2927(11)60151-X |
| [18] | Maxwell B D, Smith R G, Brelsford M. Wild oat (Avena fatua) seed bank dynamics in transition to organic wheat production systems[J]. Weed Science, 2015, 55: 212–217. |
| [19] | Wu H W, Koetz E. Long-term seed bank management of wild oats in southern New South Wales[J]. Plant Protection Quar-terly, 2014, 29(4): 143–146. |
| [20] | Grant R. Simulation of competition between barley and wild oats under different managements and climates[J]. Ecological Modelling, 1994, 71(4): 269–287. DOI:10.1016/0304-3800(94)90138-4 |
| [21] | Carlson H L, Hill J E. Wild oat (Avena fatua) competition with spring wheat:Plant density effects[J]. Weed Science, 1985, 33(2): 176–181. |
| [22] | Carlson H L, Hill J E. Wild oat (Avena fatua) competition with spring wheat:Effects of nitrogen fertilization[J]. Weed Science, 1986, 34(1): 29–33. |
| [23] | Shahvand B, Miri H R, Bagheri A R. Effect of different treatments on dormancy breaking of wild oat (Avena fatua)[J]. International Journal of Biosciences, 2015, 6(6): 61–67. DOI:10.12692/ijb/6.6.61-67 |
| [24] |
陈秀晨, 熊冬金.
植物抗逆性研究进展[J]. 湖北农业科学, 2010, 49(9): 2253–2256.
Chen X C, Xiong D J. Research progress in plant stress re-sistance[J]. Hubei Agricultural Sciences, 2010, 49(9): 2253–2256. |
| [25] | Lu D B, Luo Y P, Tong Q Q. The changes of CAT activity during drought stress with relation to drought resistance of tea plant[J]. Acta Agriculturae Universitatis Chekianensis, 1992, 18(S1): 50–55. |
| [26] |
刘宝玉, 张文辉, 刘新成, 等.
沙枣和柠条种子萌发期耐盐性研究[J]. 植物研究, 2007, 27(6): 721–728.
Liu B Y, Zhang W H, Liu X C, et al. Salt tolerance of Elaeagnus angustifolia L. and Caragana korshinskii Kom. during germination[J]. Bulletin of Botanical Research, 2007, 27(6): 721–728. |
| [27] |
李文兵, 王燕凌, 李芳, 等.
水分胁迫下多枝柽柳体内活性氧与保护酶的关系[J]. 新疆农业大学学报, 2007, 30(1): 30–34.
Li W B, Wang Y L, Li F, et al. Relationship between active oxygen and protective enzymes in Tamarix ramosissima under water stress[J]. Journal of Xinjiang Agricultural University, 2007, 30(1): 30–34. |
| [28] |
武俊英, 刘景辉, 翟利剑, 等.
不同品种燕麦种子萌发和幼苗生长的耐盐性[J]. 生态学杂志, 2009, 28(10): 1960–1965.
Wu J Y, Liu J H, Zhai L J, et al. Salt-tolerance of seed ger-mination and seedling growth of different oat varieties[J]. Chinese Journal of Ecology, 2009, 28(10): 1960–1965. |
| [29] |
祝朋芳, 潘志超, 张佳惠.
二月兰种子生活力与耐盐能力研究[J]. 种子, 2016, 35(9): 46–50.
Zhu P F, Pan Z C, Zhang J H. Studies on viability and salt tolerance in Orychophragmus violaceus seeds[J]. Seed, 2016, 35(9): 46–50. |
| [30] |
孙琪, 蔡年辉, 陈诗, 等.
PEG模拟干旱胁迫对思茅松幼苗生长的影响[J]. 种子, 2016, 35(9): 20–23.
Sun Q, Cai N H, Chen S, et al. Effects on the growth of seedlings of Pinus kesiya var. Langbianensis under drought stress simulated by PEG[J]. Seed, 2016, 35(9): 20–23. |
| [31] |
王丽丽, 孙海龙, 李强, 等.
水分胁迫对黄荆叶片生理生化特性的影响[J]. 广西农业科学, 2008, 39(2): 152–154.
Wang L L, Sun H L, Li Q, et al. Effects of water stress on physiological and biochemical characters of Vitex Negundo L.[J]. Guangxi Agricultural Sciences, 2008, 39(2): 152–154. |
| [32] |
许安民, 南维鸽, 李世清, 等.
施肥、密度和除草对半湿润地区冬小麦生物产量和籽粒产量的影响[J]. 麦类作物学报, 2007, 27(6): 1096–1100.
Xu A M, Nan W G, Li S Q, et al. Effects of fertilizer application, cropping density and weed control on biomass and yield of winter wheat in semi-humid farmland[J]. Journal of Triticeae Crops, 2007, 27(6): 1096–1100. DOI:10.7606/j.issn.1009-1041.2007.06.259 |
| [33] | Schumacher W J, Thill D C, Lee G A. Allelopathic potential of wild oat (Avena fatua) on spring wheat (Triticum aestivum) growth[J]. Journal of Chemical Ecology, 1983, 9(8): 1235–1245. DOI:10.1007/BF00982225 |
| [34] |
张军林, 慕小倩, 李晓玲, 等.
伴生杂草对小麦化感作用的研究初报[J]. 生态农业科学, 2006, 22(7): 458–461.
Zhang J L, Mu X Q, Li X L, et al. Preliminary study on the allelopathy of associated weeds with wheat[J]. Chinese Agri-cultural Science Bulletin, 2006, 22(7): 458–461. |
| [35] | Pérez F J, Ormeño-Nuñez J. Root exudates of wild oats:Al-lelopathic effect on spring wheat[J]. Phytochemistry, 1991, 30(7): 2199–2202. DOI:10.1016/0031-9422(91)83614-Q |
| [36] |
周小刚, 陈庆华, 张辉, 等.
四川农林外来入侵杂草种类的调查[J]. 西南农业学报, 2008, 21(3): 852–858.
Zhou X G, Chen Q H, Zhang H, et al. Invasive alien weeds species in farmland and forest in Sichuan Province[J]. Southwest China Journal of Agricultural Sciences, 2008, 21(3): 852–858. |
| [37] |
郭水良, 陈国奇, 毛俐慧, 等.
DNA C-值与被子植物入侵性关系的数据统计分析——以中国境内有分布的539种被子植物为例[J]. 生态学报, 2008, 28(8): 3698–3705.
Guo S L, Chen G Q, Mao L H, et al. Relationship between DNA C-value and invasiveness in 539 angiosperm species in China[J]. Acta Ecologica Sinica, 2008, 28(8): 3698–3705. |
| [38] |
史刚荣, 马成仓.
外来植物成功入侵的生物学特征[J]. 应用生态学报, 2006, 17(4): 727–732.
Shi G R, Ma C C. Biological characteristics of alien plants successful invasion[J]. Chinese Journal of Applied Ecology, 2006, 17(4): 727–732. |
| [39] | Martinson K, Durgan B, Forcella F, et al. An emergence model for wild oat (Avena fatua)[J]. Weed Science, 2014, 55(6): 584–591. |
 2017, Vol. 25
2017, Vol. 25



