磷素是植物正常生长发育不可缺少的必需元素。土壤中95%以上的磷元素为植物难以直接吸收利用的不溶性磷, 我国约74%的农田耕地土壤缺磷[1], 施用有机和化学磷肥是土壤磷的主要来源[2]。然而土壤矿物质对磷元素具有很强的吸附和固定作用, 往往容易形成难溶性无效磷酸盐[1-2], 导致施入的磷肥当季利用率只有5%~25%[1]。磷肥主要来自磷矿粉, 但磷矿粉是不可再生资源, 将在50~100年内耗完[3], 因此, 如何增加土壤中可溶性磷元素含量, 提高磷肥利用效率, 是农业亟需解决的问题。
土壤中存在大量的解磷微生物, 包括细菌、真菌和放线菌。这些解磷微生物通过其生命活动, 使土壤中不溶性磷变为可溶性磷, 供植物生长发育需要, 并提高植物对施入土壤的磷肥利用效率。我国旱地土壤中可培养解磷微生物占整个土壤可培养微生物群的27.1%~82.1%, 其中解磷细菌的含量最高[4], 因此, 从解磷细菌中筛选高效解磷菌株的潜力巨大。Chen等[5]从台湾中部的1个土样中分离到36株能够溶解磷酸钙的细菌, 它们分属于芽孢杆菌属 (Bacillus)、红球菌属 (Rhodococcus)、节细菌属 (Arthrobacter)、沙雷氏菌属 (Serratia)、金黄杆菌属 (Chryseobacterium)、代尔夫特菌属 (Delftia)、戈登氏菌属 (Gordonia) 和叶杆菌属 (Phyllobacterium), 这些细菌从磷酸钙中释放的可溶性磷浓度为31.5~519.7 mg·L-1。近年来, 我国研究人员对解磷细菌开展了大量研究工作, 筛选到许多解磷活性较好的细菌, 主要包括伯克氏菌属 (Burkholderia)[6]、假单胞菌属 (Pseudomonas)、肠杆菌属 (Enterobacter)[7-9]、不动杆菌属 (Acinetobacter)、沙雷氏菌属 (Serratia)[8]、芽孢杆菌属[9-11]和泛生菌属 (Pantoea)[12]等, 这些细菌对磷酸钙的溶解活性较好, 接菌培养后可溶性磷含量可达190~663 mg·L-1。
目前我国解磷细菌的研究多数集中在无机磷上 (主要是磷酸钙), 对有机磷的解磷活性研究较少, 且筛选到的解磷细菌解有机磷的活性弱于无机磷, 接种活性菌株后, 卵磷脂培养基可溶性磷含量低于26 mg·L-1[10, 12], 植酸钙培养基可溶性磷含量在100 mg·L-1以下[11]。土壤中有机磷含量占总磷的20%~50%[1-2], 它们对作物生长特别重要[1], 因此, 在筛选解无机磷细菌的同时, 也要加强解有机磷细菌的研究。本文以磷酸钙和植酸钙为磷源, 对分离自江西省森林土壤的细菌进行解磷活性和作用机制研究, 旨在筛选到对不溶性无机磷和有机磷均有较好降解活性的菌株, 并初步了解其解磷作用机制, 为高效解磷微生物肥料的研制提供新材料和理论依据。
1 材料与方法 1.1 供试菌株供试菌株为分离自江西省九江市森林土样的30余株细菌。
1.2 培养基固体解磷培养基:采用中华人民共和国农业行业标准NY/T 1847—2010的配方[13]。葡萄糖10 g, (NH4)2SO4 0.5 g, NaCl 0.3 g, MgSO4·7H2O 0.3 g, KCl 0.3 g, FeSO4·4H2O 0.036 g, MnSO4·4H2O 0.03 g, 有机磷植酸钙2.0 g[或无机磷Ca3(PO4)2 10 g], 去离子水1 000 mL, 琼脂15 g, pH 7.0, 121 ℃灭菌30 min。
液体解磷培养基:去除固体解磷培养基中的琼脂, 其他成分不变。
细菌培养基:葡萄糖4 g, 酵母膏粉4 g, 麦芽膏粉5 g, 琼脂20 g (液体培养基不加), 去离子水1 000 mL, pH 7.4, 121 ℃灭菌30 min。
1.3 固体解磷培养基平板初筛将获得纯培养的菌株采用点接方法, 接种于固体解磷培养基平板上, 28 ℃条件下培养3~6 d, 观察是否有溶磷圈产生, 根据溶磷圈的有无及其直径/菌落直径之比, 判断菌株是否有解磷活性及活性强弱。
1.4 液体培养解磷作用及磷酸酶活性先将菌株用细菌培养基培养48 h, 再将培养液在无菌条件下离心, 菌体用无菌水重悬, 将菌悬液接种于液体解磷培养基中 (对照组接入等体积的无菌水), 使菌体最终浓度为5×107 CFU·mL-1, 于28 ℃、180 r·min-1的条件下培养, 每24 h取样1次, 并检测样品的可溶性磷元素浓度、pH、有机酸种类和磷酸酶活性。
根据我国农业部颁发的农业行业标准NY/T 1847—2010[13], 以对照组的反应溶液作为参比调零, 采用分光光度法检测培养液中可溶性磷的浓度。采用pH计检测培养液的pH, 并取培养液在硅胶板GF254上点样, 同时用酒石酸、丙酸、乳酸、琥珀酸、苹果酸和草酸等有机酸标准溶液点样, 样品干燥后用溶剂系统甲醇/氯仿 (3:4、5:4、3:2, v/v) 展层, 置于紫外线254 nm下观察, 根据紫外吸收和迁移率 (Rf) 初步判断有机酸的种类。磷酸酶活性检测参考赵兰坡等[14]的方法, 操作如下:取1 mL培养液、0.2 mL甲苯、4.5 mL苯磷酸二钠水溶液 (0.676%)、4.5 mL相应缓冲液 (酸性磷酸酶用pH 5.0的醋酸缓冲液, 中性磷酸酶用pH 7.0的柠檬酸缓冲液, 碱性磷酸酶用pH 10.0的硼酸缓冲液), 混合均匀并密封, 于37 ℃恒温箱中反应12 h。对照组以等体积的蒸馏水代替苯磷酸二钠溶液, 反应条件相同。取反应液1 mL, 依次加入5 mL硼酸缓冲液 (pH 9.0)、2.5%的铁氰化钾3 mL和0.5%的4-氨基安替比林3 mL, 然后加蒸馏水定容至50 mL, 摇匀, 30 min后以对照组作为参比调零, 于570 nm处测吸光度, 根据苯酚的标准曲线计算待测样品中酚含量。以1 mL培养液12 h催化苯磷酸二钠产生0.1 mg苯酚为1个磷酸酶酶活性单位。
1.5 菌株的鉴定参考沈萍等[15]的方法, 对菌株进行革兰氏染色、芽孢染色、荚膜染色、糖发酵试验、硫化氢产生试验、甲基红试验、伏-普反应 (V-P反应)、淀粉和油脂水解试验。
采用螯合树脂 (Chelex 100) 法提取细菌总DNA, 用细菌通用引物27f (5′-AGAGTTTGATCCTGGCTCAG-3′) 和1492r (5′-TACGGCTACCTTGTTACGACTT-3′) 进行PCR扩增[16], 扩增产物送上海生工测序, 并与数据库EzTaxon database (http://www.ezbiocloud.net/eztaxon) 的16S rRNA基因序列进行比较, 调出相似性高的菌株序列, 利用软件CLUSTAL_X1.83进行多重序列比对, 采用MEGA软件, 以邻接法构建16S rRNA基因序列系统进化树。
1.6 统计学处理采用SPSS 19.0统计软件对数据进行统计处理。确定3次重复的平均值 (mean value) 和标准偏差 (standard deviation, SD), 绘图数据取3次试验的平均值, 培养液可溶性磷浓度、pH和磷酸酶活性变化, 采用单因素方差分析, P≤0.05为差异显著, P≤0.01为差异极显著。
2 结果与分析 2.1 固体平板解磷活性试验结果显示, 30余株细菌在植酸钙和磷酸钙固体平板上均生长良好, 这说明这些细菌均能溶解不溶性磷, 供其生长需要。然而, 只有菌株JXJ-11和JXJ-15能够在植酸钙和磷酸钙固体平板上形成明显的溶磷圈 (图 1), 溶磷圈直径/菌落直径分别为2.75±0.17和1.48±0.03、2.42±0.14和1.80±0.08, 这说明它们具有较强的溶解不溶性磷的能力, 且对植酸钙的溶解作用更强, 因此被选为后续研究菌株。
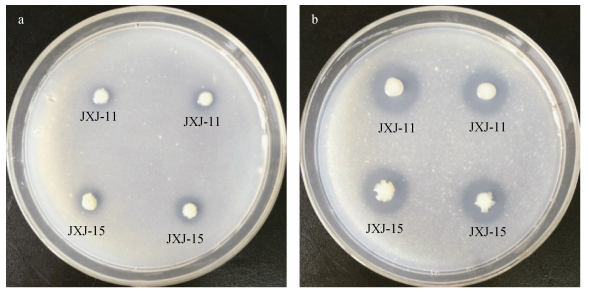
|
图 1 菌株JXJ-11和JXJ-15在固体磷培养基上形成的溶磷圈 (a:磷酸钙培养基; b:植酸钙培养基) Figure 1 Halo zones produced by strains JXJ-11 and JXJ-15 on solid phosphate media (a: calcium phosphate media; b: phytin media) |
试验结果 (图 2) 显示, 在含磷酸钙的液体培养基中接入细菌JXJ-11和JXJ-15并培养, 可溶性磷浓度分别于2 d和1 d后达到最高, 为 (47.28±0.51) mg·L-1和 (67.37±1.21) mg·L-1, 此后迅速下降。而在含植酸钙的液体培养基中接入细菌后, 可溶性磷浓度迅速增加, 菌株JXJ-11试验组3 d后达到 (219.69±3.38) mg·L-1, 占植酸钙中所含总磷的42.54%, 此后变化不大; 菌株JXJ-15试验组3 d后达到最大值 (216.96±11.25) mg·L-1, 占植酸钙中所含总磷的42.02%, 此后略有降低。
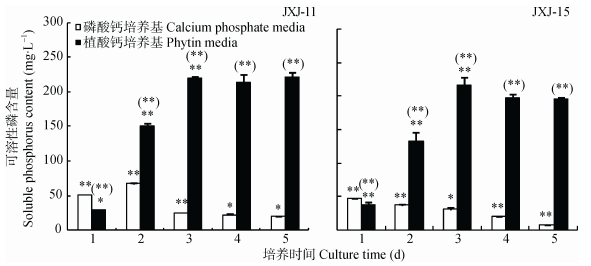
|
图 2 菌株JXJ-11和JXJ-15不同培养时间液体培养基可溶性磷含量的变化 Figure 2 Dynamic changes of soluble phosphorus contents in fluid medium with strains JXJ-11 and JXJ-15 at different culture times *和**分别表示与前一天相比, 在P < 0.05和P < 0.01水平上差异显著; (*) 和 (**) 分别表示在相同培养时间下, 植酸钙培养基与磷酸钙培养基中可溶性磷浓度在P < 0.05和P < lt; 0.01水平上差异显著。* and ** indicate significant differences between the day and the day before at P < 0.05 and P < 0.01 levels, respectively; (*) and (**) indicate significant differences in soluble phosphorus contents between the phytin media and the calcium phosphate media at the same culture time at P < 0.05 and P < 0.01 levels, respectively. |
试验结果 (图 3) 显示, 接入细菌1 d后, 植酸钙培养基pH由7.07左右急剧下降至3.1~3.2, 此后在试验时间内变化不大; 而未接菌的植酸钙对照组培养基始终维持在pH 7.0左右。接入细菌1 d后, 磷酸钙培养基pH由7.3左右下降至4.3~4.4左右, 但第2 d后回升到5.4~5.5左右, 此后回升速度较慢, 5 d后菌株JXJ-11和JXJ-15的培养液pH分别回升到5.81±0.08和6.15±0.11, 而对照组始终维持在pH 7.3左右。TLC检测结果显示, 菌株JXJ-11和JXJ-15的植酸钙和磷酸钙培养液中, 均含有Rf与丙酸和琥珀酸基本相同的物质, 因此推测这两株菌产生的有机酸中可能含有丙酸和琥珀酸。
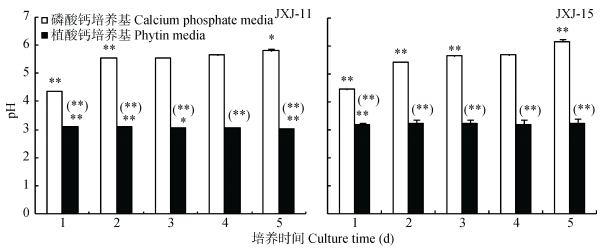
|
图 3 菌株JXJ-11和JXJ-15不同培养时间液体培养基pH的动态变化 Figure 3 Dynamic changes of pH of fluid medium with strains JXJ-11 and JXJ-15 at different culture times *和**分别表示与前一天相比, 在P < 0.05和P < 0.01水平上差异显著; (*) 和 (**) 分别表示在相同培养时间下, 植酸钙培养基与磷酸钙培养基中可溶性磷浓度在P < 0.05和P < 0.01水平上差异显著。* and ** indicate significant differences between the day and the day before at P < 0.05 and P < 0.01 levels, respectively; (*) and (**) indicate significant differences in soluble phosphorus contents between the phytin media and the calcium phosphate media at the same culture time at P < 0.05 and P < 0.01 levels, respectively. |
图 4显示, 接入菌株JXJ-11, 植酸钙培养基酸性磷酸酶活性较稳定, 从第2 d开始, 酶活性一直维持在1.10~1.67 U·mL-1; 中性磷酸酶活性前3 d均较低, 第4 d迅速增加到 (12.04±0.57) U·mL-1, 然后又迅速降低; 碱性磷酸酶活性始终较低, 即使在活性最强的第4 d也只有 (0.75±0.05) U·mL-1(图 4a)。接入菌株JXJ-11, 磷酸钙培养基的3种磷酸酶活性均较强, 其中酸性磷酸酶活性4 d后达到最大值 (4.78±0.14) U·mL-1, 中性磷酸酶和碱性磷酸酶活性均在3 d后达到最大值, 分别为 (6.34±0.36) U·mL-1和 (8.20±0.28) U·mL-1(图 4b)。
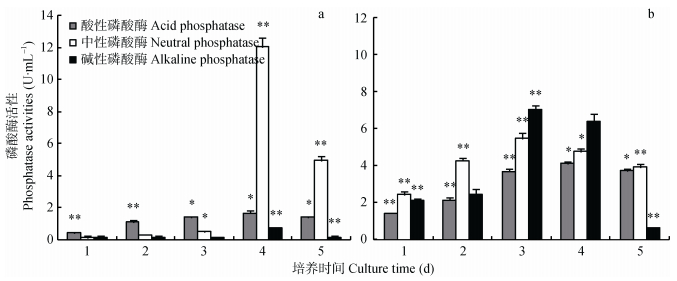
|
图 4 细菌JXJ-11不同培养时间下植酸钙 (a) 和磷酸钙 (b) 培养基的磷酸酶活性 Figure 4 Phosphatases activities of phytin (a) and calcium phosphate (b) fluid medium with bacteria JXJ-11 cultured for different times *和**分别表示与前一天相比, 在P < 0.05和P < 0.01水平上差异显著。* and ** indicate significant differences between the day and the day before at P < 0.05 and P < 0.01 levels, respectively. |
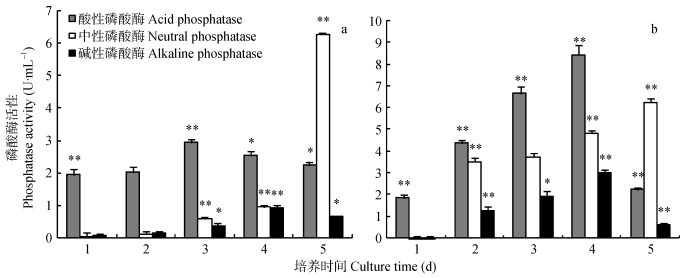
菌株JXJ-15的磷酸酶活性与JXJ-11类似 (图 5), 在植酸钙培养基中, 菌株JXJ-15的酸性磷酸酶活性较稳定, 1 d后酶活维持在1.95~2.92 U·mL-1; 中性磷酸酶活性前4 d均低于1 U·mL-1, 第5 d迅速增加到 (6.26±0.05) U·mL-1; 碱性磷酸酶活性始终较低, 即使在酶活最强的第4 d也只有 (0.91±0.09) U·mL-1(图 5a)。在磷酸钙培养基中, 菌株JXJ-15的3种磷酸酶活性均增加, 其中酸性磷酸酶活性4 d后达到最大值 (8.44±0.48) U·mL-1; 中性磷酸酶活性2 d后即达到 (3.52±0.17) U·mL-1, 但最大酶活与在植酸钙培养基中类似; 碱性磷酸酶活性4 d后达到最大值 (3.04±0.12) U·mL-1(图 5b)。
|
图 5 细菌JXJ-15不同培养时间下植酸钙 (a) 和磷酸钙 (b) 培养基的磷酸酶活性 Figure 5 Phosphatases activities of phytin (a) and calcium phosphate (b) fluid medium with bacteria JXJ-15 cultured for different times *和**分别表示与前一天相比, 在P < 0.05和P < 0.01水平上差异显著。* and ** indicate significant differences between the day and the day before at P < 0.05 and P < 0.01 levels, respectively. |
JXJ-11和JXJ-15均为杆状细菌, 无芽孢, 革兰氏染色阴性。其中JXJ-11能分解乳糖和葡萄糖, 并产酸产气, 分解含硫有机物, 产生硫化氢, V-P试验阳性, 甲基红试验阴性, 淀粉和油脂水解均为阴性; JXJ-15能分解乳糖和葡萄糖, 产酸但不产气, 分解含硫有机物, 产生硫化氢, V-P试验阴性, 甲基红试验阳性, 淀粉和油脂水解均为阴性。
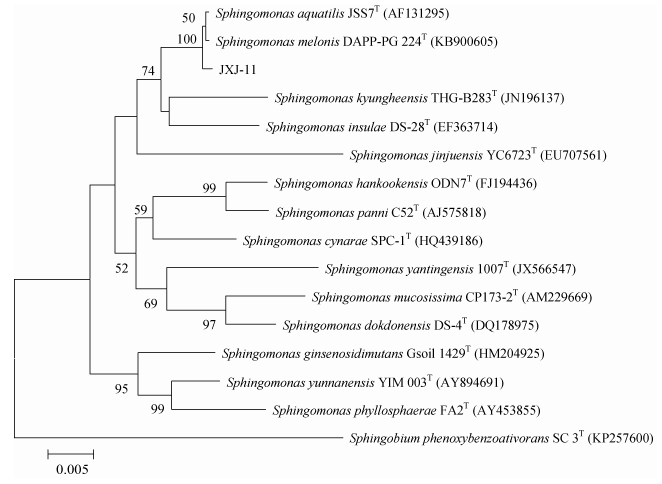
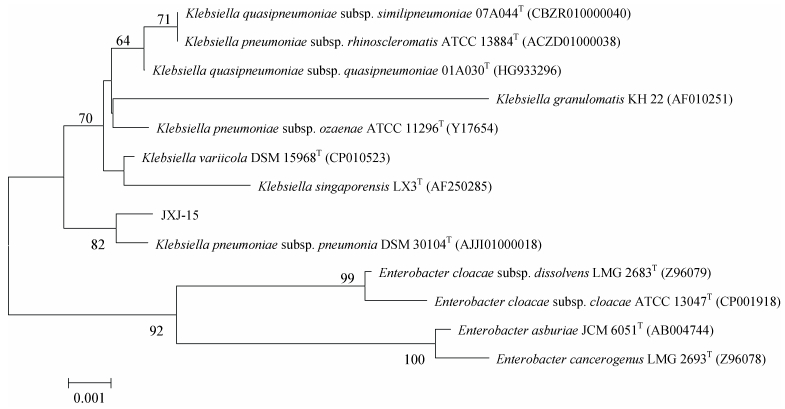
16S rRNA基因序列分析表明, 菌株JXJ-11 (1 560 bp) 属于鞘氨醇单胞菌属 (Sphingomonas) 的成员, 与Sphingomonas melonis DAPP-PG 224T和S. aquatilis JSS7T的16S rRNA基因序列相似性均为99.79%, 在邻接法系统发育进化树上这3株菌聚在一支 (图 6), 与其他有效发表种相似性≤98.25%;菌株JXJ-15 (1 625 bp) 属于克雷白氏杆菌属 (Klebsiella) 的成员, 与Klebsiella pneumoniae subsp. pneumonia DSM 30104T的16S rRNA基因序列相似性为99.73%, 在邻接法系统发育进化树上这2株菌聚在一支 (图 7)。
|
图 6 菌株JXJ-11及其相关种属的系统进化树 Figure 6 Phylogenetic tree based on 16 S rRNA gene sequences analysis of strain JXJ-11 and related taxa > 50%的步长值 (以重复1 000次的百分率表示) 在节点处标注。标尺示0.5%的序列分歧度。Bootstrap values (expressed as percentages of 1 000 replications) > 50% were shown at the nodes. Bar: 0.5% sequence divergence. |
|
图 7 菌株JXJ-15及其相关种属的系统进化树 Figure 7 Phylogenetic tree based on 16 S rRNA gene sequences analysis of strain JXJ-15 and related taxa > 50%的步长值 (以重复1 000次的百分率表示) 在节点处标注。标尺示0.1%的序列分歧度。Bootstrap values expressed as percentages of 1 000 replications > 50% were shown at the nodes. Bar: 0.1% sequence divergence. |
平板解磷圈法和液体培养法是研究微生物解磷能力最常用的两种方法, 本文利用这两种方法筛选到解磷细菌JXJ-11和JXJ-15, 它们对难溶性无机磷和有机磷均具有较好降解作用, 16S rRNA基因序列分析表明, 解磷细菌JXJ-11和JXJ-15分别是鞘氨醇单胞菌属和克雷白氏杆菌属的成员, 在解决耕地土壤有效磷缺乏而磷素却严重积累的问题上具有潜在应用价值。
分泌有机酸, 使pH降低, 溶解不溶性磷, 增加可溶性磷含量, 是微生物解磷的重要机制之一。解磷微生物分泌的有机酸主要包括草酸、乙酸、乳酸、酒石酸、琥珀酸、柠檬酸、丁二酸、丙酸、葡萄糖酸和苹果酸等[5, 17-18]。本研究发现, 菌株JXJ-11和JXJ-15可能产生丙酸和琥珀酸等有机酸, 导致培养液的pH降低, 增加可溶性磷含量, 但不同的不溶性磷源对有机酸的分泌量有影响, 植酸钙似乎比磷酸钙更能促进其产酸量。菌株JXJ-11和JXJ-15利用磷酸钙作为唯一磷源时, pH越低培养液中可溶性磷的浓度越高, 这说明可溶性磷浓度与细菌产酸量有一定的相关性, 这与文献报道的结果[18-19]类似。
分泌磷酸酶是微生物降解不溶性磷的另一个重要机制[2]。细菌JXJ-11和JXJ-15在解磷液体培养基中能够分泌酸性、中性和碱性磷酸酶, 磷源的种类对3种磷酸酶的活性有重要影响, 在植酸钙培养基中, 它们产生的磷酸酶只有酸性磷酸酶活性稳定, 中性磷酸酶活性4 d后迅速上升, 但高酶活性时间维持很短, 碱性磷酸酶活性始终很低, 这可能是在植酸钙培养基中, 培养液长时间维持在pH 3.1左右, 导致中性和碱性磷酸酶变性; 而在磷酸钙培养基中, 由于培养过程中培养基的pH下降幅度较小 (pH 4.4左右), 且在1 d后开始回升, 最终回升到pH 6.0左右, 因此, 3种磷酸酶 (特别是中性和碱性磷酸酶) 变性的情况大大减缓, 这应该是细菌JXJ-11和JXJ-15在磷酸钙液体培养基中, 分泌的酸性、中性和碱性磷酸酶活性均较好的主要原因。
管国强等[6]研究表明, 磷酸酶对磷酸钙的降解作用很小。因此, 在磷酸钙培养基中, 虽然菌株JXJ-11和JXJ-15分泌的3种磷酸酶活性均较强, 但细菌对磷酸钙的降解可能主要还是依赖于其分泌的有机酸; 而它们对植酸钙的降解可通过分泌有机酸和磷酸酶两条途径进行, 这应该是细菌JXJ-11和JXJ-15对植酸钙的降解能力远强于对磷酸钙降解能力的主要原因。
鞘氨醇单胞菌在1990年首次被报道[20], 这类微生物对高分子有机污染物具有很强的降解能力, 目前其研究主要集中在降解各种有机污染物方面[21]。鞘氨醇单胞菌能够耐受极端贫营养条件[21-22], 具有自生固氮活性[23], 是植物根际微生物之一[24-25], 具有解磷和分泌吲哚乙酸等多种功能, 能够缓解农作物连作障碍[24], 因此在微生物肥料研制方面具有一定的价值。本研究发现, 鞘氨醇单胞菌JXJ-11对植酸钙具有很强的溶解能力, 在本试验条件下, 3 d后, 植酸钙中42%磷元素被释放出来, 变为可溶性磷元素; 同时, 该菌对磷酸钙也具有一定的溶解作用, 因此, 菌株JXJ-11在研制增加土壤可溶性磷含量的微生物制剂方面具有潜在价值。但由于少数鞘氨醇单胞菌是条件致病菌和植物病原菌, 如少动鞘氨醇单胞菌 (S. paucimobilis) 能够感染手术后和免疫力低下人群[26], Sphingomonas melonis能够导致西班牙甜瓜 (Cucumis melo var. inodorus) 果实上出现褐斑[27], 因此需要对该菌的相关特性进一步研究, 确定其是否能用作微生物肥料研制的菌株。
克雷白氏杆菌属的成员多为条件病原菌, 特别是肺炎克雷白氏菌致病性较强, 是我国微生物肥料的禁用菌种[28], 因此, 虽然菌株JXJ-15解磷活性较强, 但该菌是克雷白氏菌, 且与肺炎克雷白氏菌肺炎亚种相似性高达99.73%, 因此, 鉴于安全考虑, 不能用于微生物肥料研制的菌株, 但其解磷相关基因仍然值得研究, 可为构建高效解磷的工程菌株提供目的基因。
| [1] |
赵小蓉, 林启美.
微生物解磷的研究进展[J]. 土壤肥料, 2001(3): 7–11.
Zhao X R, Lin Q M. A review of phosphate-dissolving microorganisms[J]. Soils and Fertilizers, 2001(3): 7–11. |
| [2] |
盛荣, 肖和艾, 谭周进, 等.
土壤解磷微生物及其磷素有效性转化机理研究进展[J]. 土壤通报, 2010, 41(6): 1505–1510.
Sheng R, Xiao H A, Tan Z J, et al. Advance in phosphorusdissolving microorganisms and the mechanisms on phosphorus transformation and availability[J]. Chinese Journal of Soil Science, 2010, 41(6): 1505–1510. |
| [3] | Cordell D, Drangert J O, White S. The story of phosphorus:Global food security and food for thought[J]. Global Environmental Change, 2009, 19(2): 292–305. DOI:10.1016/j.gloenvcha.2008.10.009 |
| [4] |
尹瑞玲.
我国旱地土壤的溶磷微生物[J]. 土壤, 1988, 20(5): 243–246.
Yin R L. Solubilizing-phosphate microorganisms in the dryland soil in China[J]. Soils, 1988, 20(5): 243–246. |
| [5] | Chen Y P, Rekha P D, Arun A B, et al. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities[J]. Applied Soil Ecology, 2006, 34(1): 33–41. DOI:10.1016/j.apsoil.2005.12.002 |
| [6] |
管国强, 李倩, 季蓉蓉, 等.
1株溶磷细菌P0417的溶磷机制[J]. 江苏农业科学, 2015, 43(10): 432–435.
Guan G Q, Li Q, Ji R R, et al. The solubilizing-phosphate mechanism of phosphate solubilizing bacteria P0417[J]. Jiangsu Agricultural Science, 2015, 43(10): 432–435. |
| [7] |
杨美英, 王春红, 武志海, 等.
不同条件下两株溶磷菌溶磷量及葡萄糖脱氢酶基因表达与酶活分析[J]. 微生物学报, 2016, 56(4): 651–663.
Yang M Y, Wang C H, Wu Z H, et al. Phosphorus dissolving capability, glucose dehydrogenase gene expression and activity of two phosphate solubilizing bacteria[J]. Acta Microbiologica Sinica, 2016, 56(4): 651–663. |
| [8] |
王岳坤, 于飞, 唐朝荣.
海南生态区植物根际解磷细菌的筛选及分子鉴定[J]. 微生物学报, 2009, 49(1): 64–71.
Wang Y K, Yu F, Tang C R. Screening and molecular identification of phosphate-solubilizing bacteria in rhizosphere soils in Hainan ecosystem[J]. Acta Microbiologica Sinica, 2009, 49(1): 64–71. |
| [9] |
梅新兰, 闪安琪, 蒋益, 等.
适应玉米的溶磷细菌筛选及其对玉米生长的影响[J]. 土壤学报, 2016, 53(2): 502–509.
Mei X L, Shan A Q, Jiang Y, et al. Screening of phosphatesolubilizing bacteria adaptable to corn and effects of the bacteria on the growth of corn[J]. Acta Pedologica Sinica, 2016, 53(2): 502–509. |
| [10] |
徐睿, 刘君昂, 周国英, 等.
降香黄檀-檀香根际土壤高效解磷细菌的分离筛选与鉴定[J]. 热带作物学报, 2015, 36(2): 281–288.
Xu R, Liu J A, Zhou G Y, et al. Isolation, screening and identification of high-efficiency phosphate-solubilizing bacteria in rhizosphere of Dalbergia odorifera and Sandalwood[J]. Chinese Journal of Tropical Crops, 2015, 36(2): 281–288. |
| [11] |
卫星, 徐鲁荣, 张丹, 等.
一株耐硝酸盐的巨大芽孢杆菌溶磷特性研究[J]. 环境科学学报, 2015, 35(7): 2052–2058.
Wei X, Xu L R, Zhang D, et al. Phosphate solubilizing characteristics of a nitrate-tolerating bacterium, Bacillus megaterium[J]. Acta Scientiae Circumstantiae, 2015, 35(7): 2052–2058. |
| [12] |
陈倩, 刘善江, 白杨, 等.
山西矿区复垦土壤中解磷细菌的筛选及鉴定[J]. 植物营养与肥料学报, 2014, 20(6): 1505–1516.
Chen Q, Liu S J, Bai Y, et al. Screening and identification of phosphate-solubilizing bacteria from reclaimed soil in Shanxi mining area[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(6): 1505–1516. |
| [13] |
中华人民共和国农业部. NY/T 1847-2010微生物肥料生产菌株质量评价通用技术要求[S]. 北京: 中国农业出版社, 2010: 4-5
Ministry of Agriculture of the People's Republic of China. NY/T 1847-2010 General technical requirements for production strain quality of microbial fertilizer[S]. Beijing:China Agriculture Press, 2010:4-5 |
| [14] |
赵兰坡, 姜岩.
土壤磷酸酶活性测定方法的探讨[J]. 土壤通报, 1986(3): 138–141.
Zhao L P, Jiang Y. Investigation of the assay methods of soil phosphatase activity[J]. Chinese Journal of soil Science, 1986(3): 138–141. |
| [15] |
沈萍, 陈向东.
微生物学实验[M]. 4版. 北京: 高等教育出版社, 2007.
Shen P, Chen X D. Microbiology Experiment[M]. 4th ed. Beijing: Higher Education Press,, 2007. |
| [16] |
徐丽华, 李文均, 刘志恒, 等.
放线菌系统学——原理、方法及实践[M]. 北京: 科学出版社, 2007.
Xu L H, Li W J, Liu Z H, et al. Actinomycete Systematic-Principle, Methods and Practice[M]. Beijing: Science Press, 2007. |
| [17] | Hameeda B, Reddy Y H K, Rupela O P, et al. Effect of carbon substrates on rock phosphate solubilization by bacteria from composts and macrofauna[J]. Current Microbiology, 2006, 53(4): 298–302. DOI:10.1007/s00284-006-0004-y |
| [18] |
张英, 芦光新, 谢永丽, 等.
溶磷菌分泌有机酸与溶磷能力相关性研究[J]. 草地学报, 2015, 23(5): 1033–1038.
Zhang Y, Lu G X, Xie Y L, et al. The relationship between organic acid secreted from phosphorus-solubilizing bacteria and the phosphate-solubilizing ability[J]. Acta Agrestia Sinica, 2015, 23(5): 1033–1038. |
| [19] | Hameeda B, Reddy Y H K, Rupela O P, et al. Effect of carbon substrates on rock phosphate solubilization by bacteria from composts and macrofauna[J]. Current Microbiology, 2006, 53(4): 298–302. DOI:10.1007/s00284-006-0004-y |
| [20] | Yabuuchi E, Yano I, Oyaizu H, et al. Proposals of Sphingomonas paucimobilis gen. nov. and comb. nov., Sphingomonas parapaucimobilis sp. nov., Sphingomonas yanoikuyae sp. nov., Sphingomonas adhaesiva sp. nov., Sphingomonas capsulata comb. nov., and two genospecies of the genus Sphingomonas[J]. Microbiology and Immunology, 1990, 34(2): 99–119. DOI:10.1111/mim.1990.34.issue-2 |
| [21] |
胡杰, 何晓红, 李大平, 等.
鞘氨醇单胞菌研究进展[J]. 应用与环境生物学报, 2007, 13(3): 431–437.
Hu J, He X H, Li D P, et al. Progress in research of Sphingomonas[J]. Chinese Journal of Applied and Environmental Biology, 2007, 13(3): 431–437. |
| [22] | Lee J S, Shin Y K, Yoon J H, et al. Sphingomonas aquatilis sp. nov., Sphingomonas koreensissp. nov., and Sphingomonas taejonensis sp. nov., yellow-pigmented bacteria isolated from natural mineral water[J]. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(4): 1491–1498. DOI:10.1099/00207713-51-4-1491 |
| [23] |
孙建光, 徐晶, 胡海燕, 等.
中国十三省市土壤中非共生固氮微生物菌种资源研究[J]. 植物营养与肥料学报, 2009, 15(6): 1450–1465.
Sun J G, Xu J, Hu H Y, et al. Collection and investigation on asymbiotic nitrogen-fixing microbial resources from 13 provinces over China[J]. Plant Nutrition and Fertilizer Science, 2009, 15(6): 1450–1465. |
| [24] |
王志刚, 胡云龙, 徐伟慧, 等.
鞘氨醇单胞菌菌株CL01的分离鉴定及其对连作西瓜的促生效应[J]. 农业生物技术学报, 2015, 23(10): 1360–1367.
Wang Z G, Hu Y L, Xu W H, et al. Isolation and identification of Sphingomonas sp. CL01 and its promoting effects on watermelon (Citrullus lanatus) in continuous cropping soil[J]. Journal of Agricultural Biotechnology, 2015, 23(10): 1360–1367. |
| [25] | Son H M, Yang J E, Park Y, et al. Sphingomonas kyungheensis sp. nov., a bacterium with ginsenoside-converting activity isolated from soil of a ginseng field[J]. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(10): 3848–3853. |
| [26] |
陈明亮, 王刚毅, 许学斌, 等.
少动鞘氨醇单胞菌引起小儿败血症合并脑膜炎1例[J]. 微生物与感染, 2010, 5(3): 160–162.
Chen M L, Wang G Y, Xu X B, et al. A case of septicemia complicated with meningitis in a child caused by Sphingomonas paucimobilis[J]. Journal of Microbes and Infections, 2010, 5(3): 160–162. |
| [27] | Buonaurio R, Stravato V M, Kosako Y, et al. Sphingomonas melonis sp. nov., a novel pathogen that causes brown spots on yellow Spanish melon fruits[J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52(6): 2081–2087. |
| [28] |
华人民共和国农业部. NY 1109-2006微生物肥料生物安全通用技术准则[S]. 北京: 中国农业出版社, 2006: 4-5
Ministry of Agriculture of the People's Republic of China. NY 1109-2006 General biosafety standard for microbial fertilizers[S]. Beijing:China Agriculture Press, 2006:4-5 |
 2017, Vol. 25
2017, Vol. 25



