番茄 (Lycopersicon esculentum Mill.) 是全世界普遍栽培的蔬菜种类之一。在中国北方日光温室, 番茄连作现象普遍, 导致连作障碍日益突出, 造成土壤质量下降, 土壤微生物种群结构失衡, 番茄产量和品质下降[1, 2], 严重制约了设施番茄生产。研究表明, 土壤养分消耗不均衡, 土壤物理性质恶化, 植物分泌毒素的积累, 土壤化学性质的异常变化, 土壤微生物区系异常及微生态失衡是连作障碍发生的主要原因[3-4]。土壤微生物数量、活性和群落结构及其变化, 直接影响植物对水分、养分吸收及对恶劣环境的抵抗能力[5]。Nayyar等[6]研究表明, 黄瓜 (Cucumis sativus L.) 连作根际土壤微生物区系发生明显改变, 土壤微生物群落的多样性指数及丰富度也随着种植年限的增加而降低。孙艳艳等[7]及许华等[8]研究表明, 加工番茄连作栽培使土壤细菌/真菌比例显著降低, 土壤中微生物区系从细菌主导型转向真菌主导型。
土壤生物群落结构的变化可作为土壤变化的早期预警生态指标[9]。线虫群落包括植物寄生线虫、食细菌线虫、食真菌线虫、捕食性和杂食性线虫等不同营养类群, 是土壤动物中数量最多、功能最丰富的一类[10], 影响着土壤有机质分解和养分循环以及作物生长, 是土壤健康状况的敏感性指示生物[11]。土壤线虫以食微生物线虫为主要营养功能类群。研究表明, 食微线虫通过捕食土壤微生物释放固持于微生物生物量中的养分, 进而影响土壤生态过程和植物生长[12]; 食细菌线虫具有促进植物生长的作用[13]。目前关于连作土壤中线虫的研究主要集中在连作年限对土壤线虫数量[14]和群落结构的影响[15-16]。研究发现, 连作使原本以食细菌线虫和食真菌线虫为优势属的土壤线虫群落变为以植物寄生线虫为优势属的土壤线虫群落, 严重破坏其寄主植物[17-18]。土壤中食微线虫主要通过线虫的取食作用改变土壤微生物的数量和活性[19]。微生物数量对土壤线虫群落结构的调节亦十分明显[20]。
土壤线虫、土壤微生物及植物均与连作引起的植物根结线虫病害有关, 但是关于三者之间相互关系的研究很少, 更少见番茄连作病土对三者关系的影响研究报道。连作病土对连作番茄的危害现象普遍存在, 但对连作番茄的危害程度及对土壤微生物与土壤线虫的影响程度缺乏系统研究。本研究重点考察连作番茄根结线虫染病植株根区病土对番茄根结线虫侵染及番茄生长的影响, 并对接种病土后番茄根区土壤中线虫与微生物及根系内微生物进行了系统研究, 旨在探索连作番茄根区病土对“番茄植株-番茄根区土壤微生物-根内微生物-土壤线虫”微生态系统的影响及对番茄根结线虫病的诱导效果, 为深入了解番茄连作障碍发生的微生态机制及探究番茄连作障碍修复提供科学依据。
1 材料与方法 1.1 材料供试番茄品种为‘白果强丰’, 武汉市武昌区神牛种苗商行生产, 适用于保护地及露地栽培。
供试病土于2014年9月采自陕西省杨陵区孟家寨农户连作4年以上的日光温室染病番茄根区。在番茄盛果期, 挑选根结线虫侵害严重的番茄, 拔出病株后用取样铲将表层5 cm左右的浮土除去, 采集根系分布区5~20 cm土壤装入塑料自封袋内充分混匀, 作为温室盆栽试验的病土接种材料。经贝尔曼浅盘法测定, 病土中的线虫密度为80万条·kg-1。
盆栽土壤为采集相同类型的非连作健康土壤0~20 cm耕层土壤, 风干, 破碎过10 mm筛混匀。
1.2 试验方法 1.2.1 盆栽试验2014年10月—2015年5月在西北农林科技大学南校区科研温室中进行。设2个处理: (1) 健康土壤 (CK):每盆装健康耕层土为6 kg。(2) 健康土壤+病土:每盆装健康耕层土4 kg, 接种带线虫的番茄根区病土2 kg, 充分混匀。每处理重复3盆, 每盆播种30粒番茄种子, 待出苗后保留10株番茄幼苗。试验于2014年10月10日播种, 2015年5月20日收获。试验期间追施复合肥 (N-P2O5-K2O为15-15-15)3次, 每次均为1 g·盆-1, 溶于水中浇入。
1.2.2 番茄根结调查及生物学性状测定按每盆6株采集番茄苗测定番茄苗期生物学性状、根结数量及叶片生化指标; 同时采集番茄根系上抖落的土壤样品用于土壤中线虫数量测定。每盆保留4株发育良好的番茄至开花结果, 用于测定相关生物学性状及根结线虫的侵染程度。
苗期:在生长至40 d时 (2015年2月1日) 进行, 浇适量水后待土壤湿润疏松时从每盆土中连根完整挖出6株番茄, 抖落根上附着的土壤并小心用水冲洗根系数次至无土, 用吸水纸吸尽根系表面水分, 统计每株须根条数及根结数; 用百分之一天平分别测定茎叶和根系鲜质量。
成熟期: 2015年5月20日进行, 浇适量水待土壤湿润疏松, 先将地上部用剪刀在根茎分界处剪断, 根、茎分别编号, 茎、叶和果实装袋。将整盆土倾倒于干净塑料薄膜上并使之分散, 将根系从土壤中小心挖出, 尽可能保持根系完整无损及根系上附着土壤不脱落, 将带土根系置于无菌自封袋内, 抖落并收集根上附着的土壤, 用于根区土壤微生物及线虫分析; 小心洗净根系, 用苗期同样方法处理根系并测定根系鲜质量。地上部分分别测定茎叶鲜质量、总果实数及果实鲜质量。
1.2.3 根结线虫病情指数测定从1.2.2获得的根系中每处理选择5个具有代表性的根系, 计数每个根系中一级侧根总条数及有根结的一级侧根条数, 并将有根结侧根条数与侧根总条数之比定义为侵染率 (K), 用式 (1) 计算; 再按K值确定每个根系的病情级数: 0级, K=0%; 1级, K1%~25%; 2级, K26%~50%; 3级, K51%~75%; 4级, K76%~100%。用式 (2) 计算各处理番茄的根系病情指数。
| $K\left( \% \right) = \frac{有根结一级侧根数}{一级侧根总数} \times 100$ | (1) |
| $病情指数\left( \% \right) = \frac{{\sum {\left( {根结病情级数 \times 该级别株数} \right)} }}{{\quad \quad \quad \quad 最高级数 \times 总调查株数\quad \quad \quad \quad \quad }} \times 100$ | (2) |
采集由1.2.2所获苗期番茄植株自上而下第3~5侧枝上面积最大的叶片, CK、处理各30片。多酚氧化酶 (PPO)、苯丙氨酸解氨酶 (PAL) 和丙二醛 (MDA) 测定参照高俊凤[21]的方法; POD测定采用愈创木酚比色法[22]。
1.2.5 微生物区系分析根区土壤样品采集:在1.2.2采集成熟期根系时, 将根系上附着的土壤抖落收集到自封袋中, 该土壤即为根区土壤。该土壤来自根系密集分布区, 其中的微生物、线虫种类及数量与根系生物学及生理生化特性关系密切, 能真实反映番茄收获时根系周围土壤的微生物及线虫现状。
根系与根结采集:将1.2.2中测完生物量的根系中具有代表性且有吸收功能的根系剪下, 将有根结与无根结的根系分开, 剪下根结, 分别用1 g·L-1升汞消毒30 s, 无菌水清洗根结与无根结根系5次, 将表面消毒过的根结与根系分别用无菌研钵研磨, 加无菌水适度稀释, 进行根结及根系内微生物分析[23]。
土壤及根系微生物分离计数:采用稀释平皿涂抹法进行[24]。细菌用牛肉膏蛋白胨琼脂, 真菌用PDA, 放线菌用高氏1号琼脂。将优势细菌、真菌及放线菌纯化后斜面保藏, 用于进一步鉴定。
1.2.6 优势菌鉴定优势菌指平皿内数量较多、在皿内菌落总数中所占比例较高的微生物。挑取优势菌种的典型菌落, 纯化后采用rDNA-ITS序列分析技术, 参照Pryce等[25]的方法鉴定优势真菌; 采用16S rRNA序列分析技术, 参照徐丽华等[26-27]的方法进行优势细菌和优势放线菌鉴定。
1.2.7 土壤线虫分离、计数及鉴定供试病土中线虫总数测定:称取接种用连作番茄根结线虫病株根区病土100 g, 用贝尔曼浅盘法分离并收集土壤线虫, 用线虫计数板测数。
根区土壤线虫测数及鉴定:称取1.2.2获得的番茄根区土100 g, 用贝曼浅盘法分离土壤线虫, 48 h后收集线虫并用4 mL 4%福尔马林溶液固定, 用Seinhorst[28]及Sohlenius等[29]的方法进行线虫种类鉴定并计数。
1.2.8 数据处理将每100条须根上的根结数量称为根结密度, 按式 (3) 计算; 将健康土壤+病土处理的线虫数量与健康土壤的差异称为病土效应 (ΔCK, %), 按式 (4) 计算; 样品中某种优势细菌占该样品细菌总数的比例P(%) 按式 (5) 计算; 某种优势真菌所占比例计算与细菌相同。采用Duncan’s法进行差异显著性分析。
| $根结密度\left[ {个 \cdot {{\left( 百条 \right)}^{ - 1}}} \right] = \frac{根结数}{根数} \times 100$ | (3) |
| $\Delta {\rm{CK}}\left( \% \right) = \frac{{\left( {健康土壤 + 病土} \right) - 健康土壤}}{{\quad \quad \quad \quad \quad 健康土壤\quad \quad \quad \quad \quad \quad \quad \quad \quad }} \times 100$ | (4) |
| ${\rm{p}}\left( \% \right) = \frac{优势细菌数量}{细菌总数} \times 100$ | (5) |
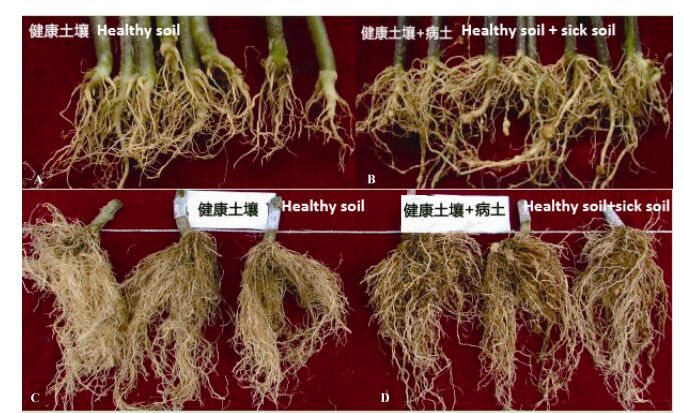
从表 1看出, 在苗期, 病土处理番茄须根上出现根结, 根结密度为21个·(百条)-1; 须根条数较健康土壤增加44.4%, 土壤线虫数量较健康土壤增加390.4%, 差异显著 (P < 0.05)。在收获期, 病土处理番茄根结侵染率达到62.7%, 病情指数为80%。图 1显示CK苗期番茄根系没有根结, 接入病土处理苗期番茄根系出现较多根结; 收获期接入病土处理番茄根系生长差, 并出现较多根结。
| 表1 不同土壤处理番茄苗期根区土线虫数量与根结密度及收获期根结病情指数 Table 1 Numbers of tomato root knots and soil nematodes at seedling stage and disease index at maturity stage of tomato under different soil treatments |
|
图 1 不同土壤处理下番茄苗期 (A, B) 和收获期 (C, D) 的根系形态 Figure 1 Root systems of tomato seedlings (A, B) and mature (C, D) plants under different soil treatments |
从表 2看出, 接入病土对苗期番茄茎叶、根系鲜重无显著影响, 但对收获期番茄茎叶及根系生长有显著抑制作用。收获期病土处理番茄茎叶、根系和果实鲜重及果实数量分别比对照减少50.2%、33.1%、68.2%和59.7%, 差异均达显著水平 (P < 0.05)。
| 表2 不同土壤处理番茄苗期和收获期的生物量 Table 2 Tomato biomasses at seedling and maturity stages under different soil treatments |
从表 3看出, 健康土壤+病土处理番茄在3月20日、3月30日的开花数及3月30日的结果数分别较对照减少80.7%、23.9%及62.3%, 差异均达显著水平 (P < 0.05)。
| 表3 不同土壤处理番茄单株开花与结果数及其不同时间 (月-日) 的动态变化 Table 3 Flowering and fruiting amounts per tomato plant and its dynamic changes at different dates (month-day) under different soil treatments |
从表 4看出, 病土处理苗期番茄叶片PPO活性较对照降低15.8%, POD活性增加24.0%(P < 0.05), 但PAL及MDA与对照相比, 均无显著差异 (P > 0.05)。
| 表4 不同土壤处理苗期番茄叶片防御性酶活性及MDA含量 Table 4 Defensive enzymes activities and MDA content of tomato leaf at seedling stage under different soil treatments |
由表 5看出, 番茄根区土壤中的食真菌线虫有3种, 主要为Aphelenchoides dactylocercus, 其次为Filenchus discrepans。食细菌线虫11种, 出现频率高的有6种, 其中Acrobeloides maximus数量最多。植物寄生线虫及杂食性线虫分别有4种及1种。在接入病土的番茄根区土壤中, 线虫总量为29680条×(100 g)-1, 与接入量26700条×(100 g)-1基本一致。其中食细菌及食真菌线虫分别占线虫总数的49.3%及23.2%, 植物寄生及杂食性线虫分别占27.4%及0.7%;在健康土壤上生长的番茄根区土壤中, 食细菌及食真菌线虫分别占线虫总数的44.8%及44.0%, 植物寄生线虫占11.2%, 接入病土使食细菌及植物寄生线虫占线虫总数的比例分别较健康土壤增加10.0%及144.6%, 食真菌线虫比例较健康土壤减少48.6%。表明接入病土可影响番茄根区土壤中线虫组成比例, 植物寄生线虫增幅较大。
| 表5 不同土壤处理收获期番茄根区土壤中线虫种类及数量 Table 5 Species and quantities of nematodes in 100 g dry soil sample from root zones of mature tomato plants under different soil treatments |
从番茄根系内及根区土壤中共分离获得5株优势菌, 其中优势细菌2株, 优势真菌3株。采用16S rRNA和rDNA-ITS序列分析技术分别对优势细菌和优势真菌进行分类鉴定, 结果如表 6所示。
| 表6 番茄根系内及根区土壤中的优势微生物 Table 6 Dominant microorganisms in rhizosphere soil and tomato root |
从表 7可知, 在健康土壤及健康土壤+病土处理番茄根区土壤中, 细菌总数分别为60.06×108(CFU)×g-1及106.4×108(CFU)×g-1, 优势细菌均为嗜麦芽窄食单胞菌 (Stenotrophomonas maltophilia); 真菌总数分别为13.07×105(CFU)×g-1及25.42×105(CFU)×g-1, 根区土壤的优势真菌共3种, 其中, 产黄青霉 (Penicillium chrysogenum) 和厚垣镰孢菌 (Fusarium chlamydosporum) 的数量在健康土壤与健康土壤+病土间无显著性差异 (P > 0.05), 但健康土壤中的雅致放射毛霉 (Actinomucor elegans) 数量约为病土的3.2倍, 差异显著 (P < 0.05);放线菌总数分别为9.77×105(CFU)×g-1及22.86×105 (CFU)×g-1, 健康土壤+病土较健康土壤增加134.0%。
| 表7 不同土壤处理番茄根区土壤中与根系内的微生物数量及优势细菌和真菌 Table 7 Dominant bacteria and fungi in tomoto rhizosphere soil under different soil treatments |
从表 7可知, 在健康土壤及健康土壤+病土处理番茄根系内, 细菌总数量分别为2.73×105(CFU)×g-1及1.44×108(CFU)×g-1, 其中的优势细菌均为甘蓝假单胞菌Pseudomonas brassicacearum, 其数量分别占健康土壤及健康土壤+病土处理番茄根系内细菌总数的100%及87.7%, 但在健康土壤与健康土壤+病土上生长的番茄根系内, 植物病原菌P. brassicacearum数量差异巨大:在病土上生长的番茄根系内, P. brassicacearum数量为健康土壤的463倍。
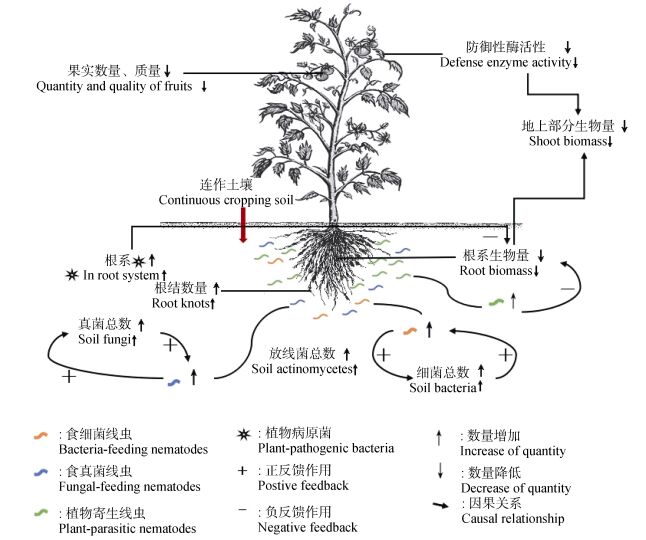
3 讨论本研究表明, 向健康土壤中加入1/3质量比的连作番茄根结线虫染病植株根区土壤, 对番茄根区土壤微生态系统产生了复杂的影响, 进而抑制番茄生长。“番茄根区土壤微生物-根内微生物-土壤线虫-番茄植株”微生态系统对病土加入后的复杂响应表现为:加入病土后, 番茄根系内细菌总数及植物病原细菌数量分别增加至健康土壤番茄的527倍及463倍; 病土番茄根区土壤中细菌、真菌、放线菌总数分别增加至健康番茄根区土壤的1.8倍、2.3倍及2.6倍, 进而导致食细菌线虫、食真菌线虫及植物寄生性线虫数量分别增加至健康根区土壤的3.3倍、1.6倍及7.3倍, 其中的植物寄生线虫95.6%为根结线虫; 根结线虫侵染导致番茄根系上的根结数量显著增加, 收获期根结线虫侵染率及病情指数提高。此外, 番茄对病土加入的响应还表现在番茄茎叶与根系鲜质量、开花数及果实数量均显著下降, 番茄叶片防御性酶活性降低, 抗病抗逆能力下降 (图 2)。
|
图 2 病土对番茄生长及土壤线虫与微生物的影响 Figure 2 Effect of nematodes-infected soil of continuously cropped tomato on tomato growth and nematodes as well as microbes in rhizosphere soil |
从收获期番茄根区土壤中3种食真菌线虫、11种食细菌线虫、5种植物寄生线虫及数量很少的杂食性线虫的种类及数量看, 接入病土使收获期番茄根区土壤线虫总量较健康土壤显著增加, 连作年限增加也有类似效应[14]; 植物寄生线虫种类增多, 数量大幅增加, 其中根结线虫占植物寄生线虫总数的95.6%, 加入连作病土使原本以食细菌和食真菌线虫为优势的土壤线虫群落变为以根结线虫为主的植物寄生线虫群落, 这与已有研究结果类似[17]。植物寄生线虫成为优势种群后会严重破坏其寄主植物[18], 根结线虫侵染番茄根系使其根结病情加剧。
本研究发现, 加入病土使番茄根区土中微生物数量大幅增加, 细菌/真菌比例下降, 许华等[8]及孙艳艳等[7]所得结果与本文类似。但Nayyar等[6]及孙艳艳等[7]的研究表明, 连作后土壤微生物总量降低。已有研究发现, 食细菌线虫对细菌的捕食会造成细菌生物量及活性增加[13]。本研究中病土处理食细菌线虫总数与细菌总数同步显著增加, 线虫的增加可能与线虫食物充足有关, 而细菌数量的增加是否是对线虫捕食细菌的正反馈尚不清楚。甘蓝假单胞菌为植物病原菌[30], 可引发番茄细菌性髓部坏死[35]。接入病土使番茄根系内甘蓝假单胞菌数量大幅度增加, 成为优势细菌, 导致番茄根系更易被有害菌侵染。嗜麦芽窄食单胞菌可寄生线虫体表抑制线虫生长、降低线虫致病性[31], 产黄青霉有利于番茄植株抵御爪哇根结线虫侵害[32], 但病土对这两种菌及厚垣镰孢菌数量无显著影响, 却能降低番茄根区土壤中优势真菌雅致放射毛霉的数量。
本研究发现, 接种病土对番茄的生化特性也有一定影响:接入病土后, 番茄叶片PPO活性显著降低, POD活性显著增高, MDA含量增高, 表明连作病土可降低番茄防御性酶活性及其抗压抗衰老能力。康亚龙等[36]也有类似报道。PPO广泛存在于植物中, 可促进酚类物质氧化, 形成咖啡酸及绿原酸等抗病物质, 还可将根皮苷配基氧化形成毒性更强的化合物, 杀死病原菌[37]。PPO的活性降低可能使番茄更易被根结线虫及病原菌侵染。POD的作用具有保护和伤害双重效应; 可在逆境或衰老初期表达而清除H2O2, 表现为活性氧保护酶系统成员; 可在逆境或衰老后期表达, 参与活性氧的产生和叶绿素的降解, 并能引发膜脂过氧化作用, 表现出破坏作用, 甚至可作为衰老指标[38]。MDA是组织或器官膜脂质发生过氧化反应而产生的, MDA含量与植物衰老及逆境伤害有密切关系[36]。病土对番茄生化特性的负效应导致对番茄生长的显著抑制作用, 表现为收获期的茎叶及根系鲜重较健康土壤显著降低, 番茄开花时间延迟, 数量减少, 结果数及果实重量均显著降低。
4 结论向健康土壤中接入连作番茄根结线虫病株根区病土对番茄根区土壤微生态系统产生了复杂的影响, 通过对根区土壤微生物、根系内细菌种类数量、土壤线虫的种类与数量及番茄生化代谢的影响抑制番茄生长, 加重根结线虫病害。病土中携带的根结线虫完全改变了健康土壤原有的线虫群落结构, 使其成为植物寄生线虫的主体; 病土接入使植物病原细菌甘蓝假单胞菌成为番茄根系内的优势菌。有害线虫及微生物的大量繁殖降低了番茄的防御性酶活性及抗逆性, 加重了根结线虫病害, 严重抑制番茄生长及开花结果。连作病土对番茄生长的负作用是通过对“番茄根区土壤微生物-根内微生物-土壤线虫-番茄植株”微生态系统的整体影响及系统内各要素相互作用实现的。病土引起的化感抑制作用亦应在后续研究中加以重视。
致谢 本文中土壤及番茄根结线虫鉴定、土壤线虫测数等与线虫相关的工作均由比利时根特大学理学院线虫研究室在读博士薛清完成, 在此谨致谢意。
| [1] | Giordani G, Pesci C. Soft and durum wheat:Cultivar com-parison under continuous cropping and in rotation with sug-arbeet[J]. Informatore Agrario, 1989, 40: 71–76. |
| [2] | Yahiro T, Tanaka S. Effects of rotation crops on lightening the injury caused by continuous cropping in upland rice pro-duction[J]. Report of the Kyushu Branch of the Crop Science Society of Japan, 1989, 56: 1–4. |
| [3] |
董章杭, 林文雄.
作物化感作用研究现状及前景展望[J]. 中国生态农业学报, 2001, 9(1): 80–83.
Dong Z H, Lin W X. Current status and prospects of allelop-athy research in agriculture[J]. Chinese Journal of Eco-Agriculture, 2001, 9(1): 80–83. |
| [4] |
肖蓉, 邓舒, 张春芬, 等.
连作草莓根际土壤特征及修复技术研究进展[J]. 中国农学通报, 2014, 30(19): 81–85.
Xiao R, Deng S, Zhang C F, et al. Review of characteristics and remediation techniques of rhizosphere soil of continuous cropped strawberry[J]. Chinese Agricultural Science Bulletin, 2014, 30(19): 81–85. DOI:10.11924/j.issn.1000-6850.2013-3215 |
| [5] |
孔维栋, 朱永官, 傅伯杰, 等.
农业土壤微生物基因与群落多样性研究进展[J]. 生态学报, 2004, 24(12): 2894–2900.
Kong W D, Zhu Y G, Fu B J, et al. A review on microbial gene and community diversity in agricultural soil[J]. Acta Ecologica Sinica, 2004, 24(12): 2894–2900. DOI:10.3321/j.issn:1000-0933.2004.12.034 |
| [6] | Nayyar A, Hamel C, Lafond G, et al. Soil microbial quality associated with yield reduction in continuous-pea[J]. Applied Soil Ecology, 2009, 43(1): 115–121. DOI:10.1016/j.apsoil.2009.06.008 |
| [7] |
孙艳艳, 蒋桂英, 刘建国, 等.
加工番茄连作对农田土壤酶活性及微生物区系的影响[J]. 生态学报, 2010, 30(13): 3599–3607.
Sun Y Y, Jiang G Y, Liu J G, et al. Effects of continuous cropping tomato for processing on soil enzyme activities and microbial flora[J]. Acta Ecologica Sinica, 2010, 30(13): 3599–3607. |
| [8] |
许华, 阮维斌, 高玉葆, 等.
根结线虫接种对黄瓜植株根际土壤pH和微生物的影响[J]. 中国生态农业学报, 2010, 18(5): 1041–1045.
Xu H, Ruan W B, Gao Y B, et al. Effect of root-knot nematode inoculation on rhizospheric soil pH and microbial community of cucumber (Cucumis sativus L.) plant[J]. Chinese Journal of Eco-Agriculture,, 2010, 18(5): 1041–1045. |
| [9] |
杨树泉, 沈向, 毛志泉, 等.
环渤海湾苹果产区老果园与连作果园土壤线虫群落特征[J]. 生态学报, 2010, 30(16): 4445–4451.
Yang S Q, Shen X, Mao Z Q, et al. Characterization of nem-atode communities in the soil of long-standing versus re-planted apple orchards surrounding Bohai Gulf[J]. Acta Ecologica Sinica, 2010, 30(16): 4445–4451. |
| [10] |
邵元虎, 傅声雷.
试论土壤线虫多样性在生态系统中的作用[J]. 生物多样性, 2007, 15(2): 116–123.
Shao Y H, Fu S L. The diversity and functions of soil nema-todes[J]. Biodiversity Science, 2007, 15(2): 116–123. |
| [11] | Freckman D W. Bacterivorous nematodes and organic-matter decomposition[J]. Agriculture, Ecosystems & Environment, 1988, 24(1/3): 195–217. |
| [12] | Bonkowski M, Cheng W X, Griffiths B S, et al. Microbi-al-faunal interactions in the rhizosphere and effects on plant growth[J]. European Journal of Soil Biology, 2000, 36(3/4): 135–147. |
| [13] |
吴纪华, 宋慈玉, 陈家宽.
食微线虫对植物生长及土壤养分循环的影响[J]. 生物多样性, 2007, 15(2): 124–133.
Wu J H, Song C Y, Chen J K. Effect of microbivorous nematodes on plant growth and soil nutrient cycling:A review[J]. Biodiversity Science, 2007, 15(2): 124–133. |
| [14] |
时立波, 王振华, 吴海燕, 等.
连作年限对番茄根围土壤根结线虫二龄幼虫与自由生活线虫数量的影响[J]. 植物病理学报, 2010, 40(1): 81–89.
Shi L B, Wang Z H, Wu H Y, et al. Influence of continuous tomato-cropping on second-stage juveniles of root-knot nematode and free-living nematodes from rhizosphere soil in plastic greenhouse[J]. Acta Phytopathologica Sinica, 2010, 40(1): 81–89. |
| [15] |
钟爽, 何应对, 韩丽娜, 等.
连作年限对香蕉园土壤线虫群落结构及多样性的影响[J]. 中国生态农业学报, 2012, 20(5): 604–611.
Zhong S, He Y D, Han L N, et al. Effect of continuous crop-ping of banana on soil nematode community structure and diversity[J]. Chinese Journal of Eco-Agriculture, 2012, 20(5): 604–611. |
| [16] |
王进闯, 王敬国.
大豆连作土壤线虫群落结构的影响[J]. 植物营养与肥料学报, 2015, 21(4): 1022–1031.
Wang J C, Wang J G. Effects of continuous soybean mono-culture on soil nematode community[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(4): 1022–1031. DOI:10.11674/zwyf.2015.0422 |
| [17] | van Eekeren N, Bommelé L, Bloem J, et al. Soil biological quality after 36 years of ley-arable cropping permanent grassland and permanent arable cropping[J]. Applied Soil Ecology, 2008, 40(3): 432–446. DOI:10.1016/j.apsoil.2008.06.010 |
| [18] | Govaerts B, Fuentes M, Mezzalama M, et al. Infiltration, soil moisture, root rot and nematode populations after 12 years of different tillage, residue and crop rotation managements[J]. Soil and Tillage Research, 2007, 94(1): 209–219. DOI:10.1016/j.still.2006.07.013 |
| [19] |
陈小云, 李辉信, 胡锋, 等.
食细菌线虫对土壤微生物量和微生物群落结构的影响[J]. 生态学报, 2004, 24(12): 2825–2831.
Chen X Y, Li H X, Hu F, et al. Effect of bacterivorous nematode on soil microbial biomass and microbiocoenosis[J]. Acta Ecologica Sinica, 2004, 24(12): 2825–2831. DOI:10.3321/j.issn:1000-0933.2004.12.023 |
| [20] | Sánchez-Moreno S, Minoshima H, Ferris H, et al. Linking soil properties and nematode community composition:Effects of soil management on soil food webs[J]. Nematology, 2006, 8(5): 703–715. DOI:10.1163/156854106778877857 |
| [21] |
高俊凤.
植物生理学实验技术[M]. 西安: 世界图书出版公司, 2000: 208-217.
Gao J F. Experimental Techniques of Plant Physiology[M]. Xi'an: World Publishing Corporation, 2000: 208-217. |
| [22] |
李合生.
现代植物生理学[M]. 北京: 高等教育出版社, 2002: 90-130.
Li H S. Modern Plant Physiology[M]. Beijing: Higher Education Press, 2002: 90-130. |
| [23] |
刘杏忠, 张克勤, 李天飞.
植物寄生线虫生物防治[M]. 北京: 中国科学技术出版社, 2004.
Liu X Z, Zhang K Q, Li T F. Biological Control of Plant Par-asitic Nematodes[M]. Beijing: China Science and Technology Press, 2004. |
| [24] |
程丽娟, 薛泉宏.
微生物学实验技术[M]. 第2版. 北京: 科学出版社, 2012: 53-56.
Cheng L J, Xue Q H. Laboratory Manual of Microbiology[M]. 2nd ed. Beijing: Science Press, 2012: 53-56. |
| [25] | Pryce T M, Palladino S, Kay I D, et al. Rapid identification of fungi by sequencing the ITS1 and ITS2 regions using an au-tomated capillary electrophoresis system[J]. Medical Mycology, 2003, 41(5): 369–381. DOI:10.1080/13693780310001600435 |
| [26] |
徐丽华, 李文均, 刘志恒, 等.
放线菌系统学:原理、方法及实践[M]. 北京: 科学出版社, 2007.
Xu L H, Li W J, Liu Z H, et al. Actinomycete Systematic:Principle, Methods and Practice[M]. Beijing: Science Press, 2007. |
| [27] | El Karkouri A, El Hassani F Z, El Mzibri M, et al. Isolation and identification of an actinomycete strain with a biocontrol effect on the phytopathogenic Erwinia chrysanthemi 3937VIII responsible for soft rot disease[J]. Annals of Microbiology, 2010, 60(2): 263–268. DOI:10.1007/s13213-010-0036-1 |
| [28] | Seinhorst J W. On the killing, fixation and transferring to glycerin of nematodes[J]. Nematologica, 1962, 8(1): 29–32. DOI:10.1163/187529262X00981 |
| [29] | Sohlenius B, Sandor A. Vertical distribution of nematodes in arable soil under grass (Festuca pratensis) and barley (Hordeum distichum)[J]. Biology and Fertility of Soils, 1987, 3(1/2): 19–25. |
| [30] | Sikorski J, Jahr H, Wackernagel W. The structure of a local population of phytopathogenic Pseudomonas brassicacearum from agricultural soil indicates development under purifying selection pressure[J]. Environmental Microbiology, 2001, 3(3): 176–186. DOI:10.1046/j.1462-2920.2001.00174.x |
| [31] |
李昱龙, 韩正敏.
嗜麦芽窄食单胞菌在环保和农业生产上的应用[J]. 生物技术通报, 2015, 31(8): 35–43.
Li Y L, Han Z M. The applicatioin of Stenotrophomonas maltophilia in environmental remediation and agriculture[J]. Biotechnology Bulletin, 2015, 31(8): 35–43. |
| [32] | Gotlieb D, Oka Y, Ben-Daniel B H, et al. Dry mycelium of Penicillium chrysogenum protects cucumber and tomato plants against the root-knot nematode Meloidogyne javani-ca[J]. Phytoparasitica, 2003, 31(3): 217–225. DOI:10.1007/BF02980831 |
| [33] | Ruanpanun P, Tangchitsomkid N, Hyde K D, et al. Actino-mycetes and fungi isolated from plant-parasitic nematode infested soils:Screening of the effective biocontrol potential, indole-3-acetic acid and siderophore production[J]. World Journal of Microbiology and Biotechnology, 2010, 26(9): 1569–1578. DOI:10.1007/s11274-010-0332-8 |
| [34] | Reiss J. Biotoxic activity in the mucorales[J]. Mycopathologia, 1993, 121(2): 123–127. DOI:10.1007/BF01103580 |
| [35] | Belimov A A, Dodd I C, Safronova V I, et al. Pseudomonas brassicacearum strain Am3 containing 1-aminocyclopropane-1-carboxylate deaminase can show both pathogenic and growth-promoting properties in its interaction with tomato[J]. Journal of Experimental Botany, 2007, 58(6): 1485–1495. DOI:10.1093/jxb/erm010 |
| [36] |
康亚龙, 刘彦荣, 刘建国, 等.
连作对加工番茄植株生理活性和物质生产的影响[J]. 中国生态农业学报, 2015, 23(3): 319–328.
Kang Y L, Liu Y R, Liu J G, et al. Physiological activity and material production in processing tomato under continuous cropping[J]. Chinese Journal of Eco-Agriculture, 2015, 23(3): 319–328. |
| [37] |
秦国政, 田世平, 刘海波, 等.
拮抗菌与病原菌处理对采后桃果实多酚氧化酶、过氧化物酶及苯丙氨酸解氨酶的诱导[J]. 中国农业科学, 2003, 36(1): 89–93.
Qin G Z, Tian S P, Liu H B, et al. Polyphenol oxidase, pe-roxidase and phenylalanine ammonium lyase in postharvest peach fruits induced by inoculation with Pichia membrane-faciens or Rhizopus stolonifer[J]. Scientia Agricultura Sinica, 2003, 36(1): 89–93. |
| [38] |
赵丽英, 邓西平, 山仑.
活性氧清除系统对干旱胁迫的响应机制[J]. 西北植物学报, 2005, 25(2): 413–418.
Zhao L Y, Deng X P, Shan L. The response mechanism of active oxygen species removing system to drought stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2005, 25(2): 413–418. |
 2017, Vol. 25
2017, Vol. 25



