2. 河南科技学院生命科技学院/现代生物育种河南省协同创新中心 新乡 453003;
3. 宁夏农林科学院作物研究所 银川 750105;
4. 宁夏农林科学院农业资源与环境研究所 银川 750002
2. College of Life Science and Technology, Henan Institute of Science and Technology/Henan Collaborative Innovation Centre of Modern Biological Breeding, Xinxiang 453003, China;
3. Institute of Crop Science, Ningxia Academy of Agriculture and Forestry Sciences, Yinchuan 750105, China;
4. Institute of Agricultural Resources and Environmental Science, Ningxia Academy of Agriculture and Forestry Sciences, Yinchuan 750002, China
1999年开始开发建设的宁夏扶贫扬黄灌溉工程的主体灌区红寺堡灌区, 其间分布的淡灰钙土面积达6.9万hm2, 占主体灌区土壤总面积的74%。由于淡灰钙土土壤养分含量较低, 加上开发过程中的土壤推垫等土地平整措施, 使农田土壤大多表现为“生土”特征, 基础肥力很低, 土壤养分贫乏严重制约了水、光、热资源的生产潜力。一方面由于土壤肥力低下, 导致农作物单产较低, 另一方面受引黄老灌区农民施肥习惯的影响, 化肥施用不合理, 氮、磷等养分资源浪费严重。因此, 新开垦土壤的科学合理开发利用成为一个关键问题。
豆科/非豆科作物间作在中国分布面积较大, 包括西北地区的蚕豆(Vicia faba)/玉米(Zea mays)和小麦(Triticum aestivum)/豆(Glycine max)、西南地区的蚕豆/小麦和蚕豆/油菜(Brassica campestris)、黄淮海平原的花生(Arachis hypogaea)/玉米、长江中下游平原的花生/水稻(Oryza sativa)、东北地区的大豆/玉米等。蚕豆/玉米间作在宁夏、甘肃一带种植面积较大。蚕豆/玉米间作具有明显的产量间作优势, 这主要由于作物地下部根系生态位时空互补和根际互作过程能促进作物养分高效吸收利用[1-5]。蚕豆/玉米间作能提高间作蚕豆的生物固氮量[6], 并减少土壤无机氮的累积, 从而降低农业生态环境污染的风险[7]。在缺水条件下, 与小麦间作后, 蚕豆结瘤特性得到促进, 根系下扎更深[8]。有研究表明间作蚕豆根系分泌物中类黄酮物质的组分和含量发生了变化从而引起根瘤的变化[9]。在低磷胁迫条件下, 玉米/蚕豆间作[10]、玉米/大豆间作[11]均能促进豆科植物的结瘤和作物综合利用资源的能力。进一步研究揭示, 玉米/蚕豆间作体系中玉米的根系分泌物促进了蚕豆的结瘤固氮[12]。蚕豆较强的环境适应能力和资源利用潜力还有待于进一步挖掘。
种植豆科植物必须接种与之相匹配的根瘤菌[13], 这样不但可以提高间作体系中豆科植物的固氮优势, 而且可进一步提高豆科/禾本科间作系统的间作产量优势, 并改善与之间作的作物营养状况[10, 14-17]。但在新开垦土壤上根瘤菌数量少, 多数因环境条件不适宜而无效根瘤菌居多。且前人的研究试验多集中于盆栽研究[14-16], 或长期耕种的土壤上进行[17], 而非新开垦土壤。接种方式则以拌种[17-18]和出苗后灌根居多[14, 16], 且少有对接种方式进行比较。接种根瘤后对玉米/蚕豆间作体系的产量优势及作物根际微生态环境造成了很复杂的影响[18], 需要进一步深入研究。豆科植物与根瘤菌共生有较强的专一性, 即每种植物只与其相匹配的根瘤菌共生, 且玉米与蚕豆间作后田间微环境的改变会对蚕豆-根瘤菌的共生产生什么影响目前尚不十分明确。因此本研究通过新开垦土壤的盆栽与大田试验相结合的方法, 分析玉米/蚕豆-根瘤菌共生体系的生产潜力、根瘤特性及生物固氮方面的优势, 选择与蚕豆/玉米间作体系匹配的根瘤菌和高效根瘤菌接种技术, 充分发挥玉米/蚕豆间作体系的间作优势和豆科植物-根瘤菌共生固氮优势, 培肥土壤, 增加生物氮肥投入, 降低农业生产的环境风险, 提高土壤的可持续利用能力, 为新开垦土壤的合理开发利用提供一种可持续发展模式。
1 材料与方法 1.1 试验地概况试验在宁夏中部干旱带的红寺堡进行, 试验区光能资源丰富, 全年日照时数2 900~3 550 h, 年平均气温8.9 ℃, 年太阳总辐射5 646.9 kJ·m-2, ≥10 ℃年积温平均为2 963.9 ℃, 平均无霜期168 d, 年降雨量185.4 mm, 年均潜在蒸发量2 015 mm, 是降水量的11倍, 干燥度为6.9%。土壤为砂质土壤, 土层厚30~100 cm, 土壤粗颗粒含量为20%~30%。土壤基础肥力状况见表 1。该试验地作物生长期间月平均气温和月平均降雨量以及灌溉量见文献[10]。
| 表1 播种前试验区耕层土壤(0~20 cm)基础肥力状况 Table 1 Background properties of soil (0-20 cm depth) in the study area before sowing |
盆栽试验在中国农业大学资源与环境学院温室进行, 栽培盆规格为20 cm×18 cm(直径×高), 试验所用土壤采自宁夏红寺堡兴盛村大田试验点。以玉米/蚕豆间作为对象, 供试蚕豆品种为‘临蚕5号’, 玉米品种为‘郑单958’。设不接菌的蚕豆单作和玉米/蚕豆间作为对照, 主处理为4个根瘤菌株接种, 菌种分别是NM353、CCBAU、G254和QH258(均由中国农业大学生物学院菌种保藏中心陈文新院士课题组提供)。副处理为接种方法, 共设4种根瘤菌接种方法: 1)液体菌剂+清水拌种; 2)液体菌剂+保水剂+清水拌种; 3)种子丸衣化方法接种根瘤菌; 4)两叶期对种苗根部浇灌菌液。共计18个处理, 4次重复。2009年3月15日蚕豆和玉米同时播种。每盆均留两棵苗, 单作即每盆留两棵蚕豆, 间作每盆留1株玉米和1株蚕豆, 两棵植株间距离为10 cm。2009年5月8日蚕豆和玉米同时收获, 蚕豆和玉米共同生长55 d。
1.2.2 大田试验及田间管理大田试验在宁夏红寺堡区兴盛村进行。试验主处理为5个根瘤菌接种水平, 分别是用保水剂拌种的方式接种菌株NM353、CCBAU、G254、QH258和对照处理(不接菌, 但加等量的水), 副处理为蚕豆单作, 玉米单作和玉米/蚕豆间作3个种植水平, 蚕豆单作5个处理, 玉米/蚕豆间作5个处理, 和1个玉米不接菌单作处理, 共计11个处理, 3次重复, 随机区组排列。供试蚕豆品种为‘临蚕2号’, 玉米品种为‘沈单16’。蚕豆采用点播方式, 行距和株距均为0.2 m, 单作蚕豆每小区种18行; 玉米点播, 行间距0.4 m, 株距0.3 m, 单作玉米每小区种9行; 玉米/蚕豆间作每两行玉米间作两行蚕豆, 相邻的玉米行和蚕豆行距离为0.3 m, 每小区种6行玉米6行蚕豆, 间作体系中各作物的株距和行距与相应单作保持一致。因此, 单作玉米种植密度为250 125株·hm-2, 单作蚕豆种植密度为83 375株·hm-2, 间作玉米种植密度为83 375株·hm-2, 间作蚕豆种植密度为55 583株·hm-2。各小区长6 m, 宽3.6 m。本试验主区间筑埂, 埂宽0.5 m, 小区之间打畦, 畦宽0.2 m, 在第1和第2重复间设水渠, 渠宽1.2 m, 在第2和第3重复间设走道, 走道宽1 m。所种作物均为南北向种植。
蚕豆于2009年3月19日播种, 2009年8月1日收获; 玉米于2009年4月15日播种, 2009年10月6日收获。作物生长期间充分灌水和人工除草, 并在作物生长的适当时期中耕。在蚕豆初花期伴随着灌水用辛硫磷控制地下害虫, 在蚕豆盛花期叶面喷洒氧化乐果用以控制蚕豆蚜虫, 所用杀虫剂均按说明书使用。
1.3 根瘤菌菌剂的配制及接种方法 1.3.1 根瘤菌菌剂的配制首先配制无菌的固体和液体培养基, 在无菌操作台中, 将菌种从保藏试管中挑出, 先在固体培养基上用平板划线法进行活化, 然后用灭菌牙签轻轻挑取平板上生长出的单菌落, 将其放入已灭菌的液体培养基中, 25 ℃、200 r·min-1进行摇培。根瘤细菌的生长情况, 通过OD600监测, OD600为0.6~0.8, 表明细菌处于旺盛生长的对数生长期[19]。每4 h观测一次OD600值, 直到OD600值达到0.6, 备用。
1.3.2 根瘤菌接种方法本试验用作接种的菌悬液均稀释至OD600处于0.63~0.64, 采用灭过菌的YMA液体培养基进行稀释。每盆用菌量为:除了三叶期灌根用10 mL菌液外, 其他3种接种方法都用20 mL菌液, 具体每盆的接菌量见下面接种方法。根瘤菌怕日光, 惧高温。在保存、运输、搬运、拌种和播种后, 都要尽量避开阳光直射(如拌种时要在阴暗地方, 搬去田间时, 用黑布覆盖, 播种后立即盖土等)。播种后土壤湿度应保持田间持水量的60%~80%;土壤通气较好; 土壤温度20~28 ℃利于根瘤的生长发育。各接种方法具体如下:
清水拌种:将20 mL菌悬液加入种子中并充分搅拌, 以使每粒种子都均匀粘到菌液。置于阴凉避光处待播种。
保水剂拌种:保水剂购于北京金元易公司。按照播种蚕豆量:菌剂(L):清水(L):保水剂(kg)= 60:6:10:1, 保证每10 g蚕豆种子上2 mL菌剂(7×107cfu), 将称好的保水剂与菌液混匀后, 倒入种子中并充分搅拌, 使每粒种子表面都均匀沾上菌剂[19]。置于阴凉处, 稍晾后立即播种。大田试验也采用此方法。
丸衣化方法:参照牧草种子丸衣化的方法[20], 先将20 mL菌液加入到配好的5 mL羧甲基纤维素钠溶液内, 搅拌均匀后放入种子, 反复搅拌使每粒种子表面都均匀沾上菌液和羧甲基纤维素钠的粘着剂, 再加入6 g滑石粉, 反复搅拌使每粒种子都裹上一层丸衣材料, 置于阴凉处阴干待用。
三叶期灌根:即在蚕豆第3片真叶展开时在蚕豆根部浇灌10 mL培养好的菌液。
1.4 样品采集与测定方法 1.4.1 盆栽试验于蚕豆和玉米共同生长55 d后开始收获植株样品。收获前两天控水, 以便收获时从土壤中易于将根系取出。从栽培盆中将整个植株轻轻抖出, 置于牛皮纸上分地上部和地下部。地上部样品处理:在105 ℃烘箱烘至恒重, 称干重, 粉碎后充分混合均匀, 用以测定植株氮养分。地下部样品处理:轻轻抖落根上的土, 落在纸上的根瘤及带根瘤的根一并放入8号封口袋内, 样品取回后放在100目筛中流水冲洗, 摘可见根瘤、计数、称鲜重, 风干、称干重。
1.4.2 大田试验玉米出苗后, 每隔20~25 d取一次样, 即蚕豆在初花期、盛花期、盛花鼓粒期和成熟期取4次样, 玉米在苗期、拔节期、抽雄期、灌浆期和成熟期取5次样, 两作物共生期约95 d, 为玉米生长前期; 从蚕豆收获到玉米收获约60 d, 为玉米生长后期。两作物共生期同时取样4次, 蚕豆收获后60 d, 玉米成熟期取样一次, 共取样5次。
蚕豆样品:于蚕豆苗期在各小区取样带标记30株生长均匀一致的植株, 待测量和取样用。每个小区用铁锨挖约0.50 m深取出整株蚕豆5株, 以保证取出所有根瘤, 置于牛皮纸上分地上部和地下部。地上部和地下部样品处理方法同盆栽试验(1.4.1), 在蚕豆鼓粒期和成熟期将籽粒和茎秆分开烘干称重, 粉碎。玉米样品:于玉米苗期在各小区取样带标记30株生长均匀一致的植株, 待测量和取样用。除苗期取玉米5株, 其他生长期在取样区采集3株样品, 用以测定植株干物质和氮素浓度(在玉米灌浆期和成熟期将籽粒和茎秆分开烘干称重, 粉碎)。
作物成熟时按带收获, 测定生物学产量和籽粒产量及考种性状。离边行0.50 m取蚕豆20株和玉米10株进行考种。然后蚕豆玉米各取其中3株, 将籽粒和秸秆分开, 烘干后, 进行粉碎, 充分混合均匀, 用以常规测定植株养分。测产时, 将蚕豆和玉米考种剩下的、离小区边0.50 m以上的所有植株收获, 与考种样一起用作实际测产。并于收获期, 从单作蚕豆、间作蚕豆和单作玉米各混合均匀的粉碎样品中取2 g, 用微量粉样机(MM200, Retsch, Haan, Germany)充分细粉碎, 再用稳定性同位素分析仪(914-0060, Los Gatos Research, America)测定铵态氮15N自然丰度(δ15N), 以获得蚕豆的生物固氮量和固氮比例。
1.5 数据处理 1.5.1 数据计算土地当量比(land equivalent ratio, LER)常被用于衡量间作优势[21]。LER被定义为获得与间作相同产量所需的单作土地面积。其计算公式如下:
| $ {\rm{LER}} = \frac{{{Y_{{\rm{if}}}}}}{{{Y_{{\rm{sf}}}}}} + \frac{{{Y_{{\rm{im}}}}}}{{{Y_{{\rm{sm}}}}}} $ | (1) |
式中: Yif和Yim分别代表间作中蚕豆和玉米的籽粒产量, Ysf和Ysm分别代表单作中蚕豆和玉米的籽粒产量。LER > 1, 表明间作比单作利用更多的资源满足作物生长; LER < 1, 表明单作比间作更有效利用资源。
15N同位素自然丰度法应用条件验证:在盆栽试验中, 本研究选用与不接种根瘤菌的蚕豆间作的玉米为参照; 大田试验中, 选用保水剂处理的单作玉米作参照。盆栽试验取收获时的蚕豆、玉米样品; 大田试验所测样品为4个生育时期的蚕豆植株样品。
δ15N法测定生物固氮的基本原理:大气中15N自然丰度值为0.366 3%, 相当于δ15N值为0, 而土壤N的δ15N值为-6‰~16‰。15N同位素自然丰度法的应用要求植物生长的土壤中δ15N值一般在6‰~10‰[22]。2009年蚕豆收获后表层土壤(0~20 cm)的平均δ15N值为7.14‰。因此, 本研究土壤δ15N均高于大气中的值, 这是15N同位素自然丰度法适用的前提条件。因此, 本研究可采用自然丰度法计算蚕豆生物固氮。
蚕豆固氮量计算:蚕豆生物固氮采用15N同位素自然丰度法计算, 其固氮比例(percentage of nitrogen derived from air, %Ndfa)计算方法如下[22]:
| $ {\rm{\% Ndfa}} = \frac{{{\rm{ \mathsf{ δ} }}{}^{{\rm{15}}}{{\rm{N}}_{{\rm{maize}}}} - {\rm{ \mathsf{ δ} }}{}^{{\rm{15}}}{{\rm{N}}_{{\rm{faba}}\;{\rm{bean}}}}}}{{{\rm{ \mathsf{ δ} }}{}^{{\rm{15}}}{{\rm{N}}_{{\rm{maize}}}} - B}} \times 100 $ | (2) |
式中: δ15Nmaize为与不接种根瘤菌蚕豆间作的玉米的δ15N, δ15Nfaba bean为所有种植方式蚕豆的δ15N, δ15N为扩大了的自然丰度值, 可由稳定同位素仪直接读数; B为与田间试验相同的蚕豆品种‘临蚕5号’在不供应氮素但保证其他养分需求, 即完全依靠生物固氮时的δ15N值, 为-1.851, 测定参照Shearer等[23]的方法。
| $ {\rm{ \mathsf{ δ} }}{}^{{\rm{15}}}{\rm{N}} = \frac{{{R_{{\rm{sample}}}} - {R_{{\rm{standard}}}}}}{{{R_{{\rm{standard}}}}}} \times 1\;000 $ | (3) |
式中: Rsample是所检测蚕豆样品在稳定同位素仪上的读数, Rstandard是不接种根瘤菌的单作玉米的读数。生长期, δ15N是蚕豆(或玉米)秸秆的δ15N; 成熟收获时由于将籽粒和秸秆分开取样, δ15N是由蚕豆(或玉米)籽粒和秸秆δ15N值加权平均计算所得。
固氮量(nitrogen derived from air, Ndfa)由固氮比例和总氮累积量计算:
| $ {\rm{Ndfa}}\; = {\rm{\% Ndfa}}\; \times \,N $ | (4) |
式中: N为蚕豆生长期秸秆的氮素积累量或成熟收获期籽粒和秸秆氮素积累量的加权平均值。
1.5.2 统计分析试验采用随机区组试验设计。将数据用Microsoft Excel 2007整理后, 利用SAS程序在0.1、0.05和0.01水平进行方差分析, 并用最小显著性差异(LSD)进行多重比较[24]。
2 结果与分析 2.1 根瘤菌菌剂的特性及配制方法供试的4个根瘤菌NM353、CCBAU、G254和QH258是多年在甘肃蚕豆上进行配对试验得出的4种蚕豆专属高效结瘤的根瘤菌菌种[16, 18], 但其生长习性各不相同。在室内对4个根瘤菌菌种的生长曲线进行研究, 找到各菌株最旺盛生长的时间, 提前制备好生长势强的菌剂以备大田拌种使用。
通过对4种高效根瘤菌种的揺菌培养观察可以看出, 在摇床上培养28 h后, NM353和CCBAU的OD600达到0.6~0.8的最佳生长状态。而G254和QH258在培养16 h即可以达到最旺盛生长期。另外, 平板菌落计数法测得OD600值最佳时NM353和CCBAU培养20 h分别为3.5×107cfu·mL-1和2.4×107 cfu·mL-1, 可见NM353优于CCBAU(图 1)。
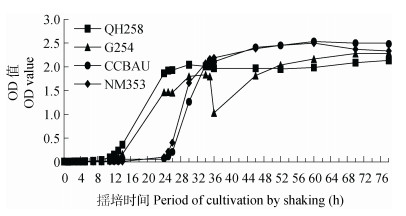
|
图 1 供试4种根瘤菌的OD值监测生长曲线 Figure 1 OD value growth curves of the four tested rhizobia |
盆栽试验中, 接种4种根瘤菌后, 每盆植株地上部总生物量的大小顺序为CCBAU > NM353 > G254 > QH258 > 间作不接菌 > 单作不接菌(表 2); 接种方式为保水剂 > 丸衣化 > 清水拌种 > 三叶期灌根。但其中以三叶期灌根的接种方式、接种NM353根瘤菌的蚕豆植株生物量最大, 比单作不接种蚕豆的生物量高出20.8%, 比间作不接种的蚕豆高34.4%。但用保水剂拌种的方式接种NM353却与其他3个菌种间无显著差异。用保水剂拌种的接种方式, 接种NM353根瘤菌的蚕豆植株生物量比用此种方式接种CCBAU的少8.8%, 而间作玉米的生物量则是接种NM353的比接种CCBAU的高20.1%。
| 表2 不同接种方法接种4个根瘤菌种后间作蚕豆、玉米地上部生物量和地上部氮吸收(盆栽) Table 2 Above-ground biomass and N acquisition of intercropped faba bean and maize affected by 4 different rhizobia and 4 different inoculation methods (pot experiment) |
大田试验中(表 3), 间作蚕豆比单作蚕豆产量增加155.50%, 差异均达显著水平。接种根瘤菌显著增加了单、间作蚕豆籽粒产量, 接种CCBAU、G254、NM353、QH258和对照处理水后, 间作蚕豆分别比单作蚕豆产量高87.5%、118.6%、104.7%、87.3%和87.6%。由于共生期对玉米/蚕豆间作体系接种根瘤菌, 在玉米/蚕豆种间促进作用和蚕豆-根瘤菌共生固氮二者的协同作用下, 本试验中间作蚕豆产量增加显著, 而间作中玉米的产量基本与单作保持一致。从地上部生物量结果(图 2)也可以看出, 接种根瘤菌NM353的处理, 间作蚕豆和玉米的生物量为最高, 分别是18 t(DW)·hm-2(P < 0.05)和20 t(DW)·hm-2。
| 表3 根瘤菌接种处理对蚕豆/玉米间作作物籽粒产量及其间作优势的影响(大田) Table 3 Grain yields of faba bean and maize and land equivalent ratios (LER) of faba bean/maize intercropping system with 4 rhizobia inoculation (field experiment) |
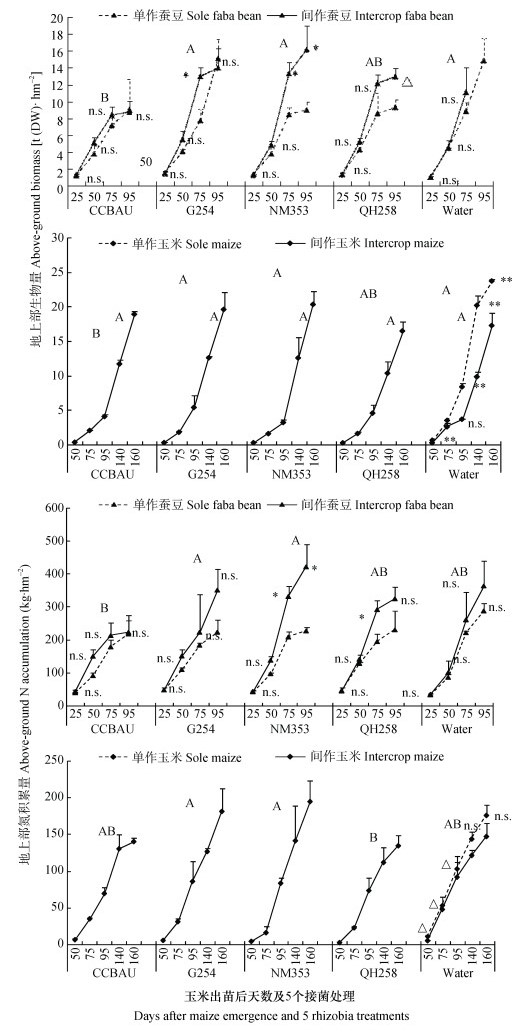
|
图 2 接种不同菌种对间作蚕豆、玉米地上部生物量和地上部氮积累量的影响(大田) Figure 2 Above-ground biomass and N acquisition of intercropped faba bean and maize affected by 4 different rhizobia (field experiment) 不同大写字母表示同一作物5个接菌处理间差异显著(P < 0.05); △, *, **和n.s.分别表示相同接菌方式下同一取样日期单、间作间差异在10%、5%和1%水平上显著, 在10%水平上差异不显著。 Different capital letters in the same column demonstrate significant differences among 5 treatments (4 rhizobia treatments and control with water) at 0.05 level; △, *, ** and n.s. refer to marginal significance at 10%, significance at 5%, 1% levels and not significant at 10% level, respectively, between sole and intercrop with the same rhizobium treatment at one growth stage. |
从土地当量比(表 3)分析, 所有接菌处理的间作体系均具有明显的产量优势, 土地当量比均大于1。接种NM353和CCBAU两种根瘤菌后, 间作蚕豆增产效果均有明显提升, 其中以NM353的效果更好。用保水剂拌种的接种方式, 接种NM353根瘤菌的玉米/蚕豆间作共生体系的土地当量比为1.65, 该间作体系中的间作玉米和间作蚕豆的产量分别比接种CCBAU的处理高5.8%和6.7%。
因此, 考虑对玉米/蚕豆间作体系进行接种根瘤菌, 从生物量和作物长势来看, 该体系以用保水剂拌种的接种方式接种NM353根瘤菌为最佳处理。
2.3 根瘤菌接种方法和根瘤菌菌种对间作蚕豆和玉米地上部氮累积的影响盆栽试验不同接种处理蚕豆植株氮素积累量均比不接种的对照植株显著增加(表 2)。从整盆植株来看, 间作接种处理的蚕豆地上部氮积累量高于间作不接种对照, 说明接种根瘤菌能充分发挥两种作物在有限的资源空间中对资源的吸收和利用的补偿作用。4种根瘤菌中以接种NM353的间作蚕豆地上部氮积累量最高。无论是单株蚕豆还是整盆植株的氮积累量, 均以三叶期灌根接种方式接种根瘤菌NM353最高, 并且均与接种QH258的根瘤菌菌种间差异显著。总体上, 4种接种方法间没有明显差异, 但都高于不接种的间作和单作蚕豆。
从大田试验结果(图 2)来看, 接种NM353的蚕豆地上部氮积累量比接种CCBAU的高48.5%, 处理间差异显著; 接种后该间作体系中玉米的地上部N积累量以NM353的处理最高, 但是与接种G254的处理没有显著性差异。
2.4 根瘤菌接种方法和根瘤菌菌种对间作蚕豆结瘤特性的影响盆栽试验接种根瘤菌处理的蚕豆根系单株根瘤数都显著高于单作和间作不接菌处理, 说明接种根瘤菌促进了蚕豆结瘤, 特别是在与玉米间作的条件下该优势表现更加明显(表 4)。4种根瘤菌接种效果没有显著差异, 说明盆栽条件下4种根瘤菌均与蚕豆匹配较好。4种接种方法中, 清水拌种和保水剂拌种的结瘤数显著高于丸衣化和三叶期灌根的接种处理, 清水拌种和保水剂拌种分别比间作不接种蚕豆的结瘤数增加125.5%和142.3%。蚕豆单株根瘤干重也表现出同样趋势, 并发现接种NM353和CCBAU的根瘤干重高于另外两个菌种; 从接种方法来看, 保水剂拌种 > 清水拌种 > 丸衣化 > 三叶期灌根。用保水剂拌种、清水拌种、三叶期灌根和丸衣化4种接菌方式接种NM353蚕豆根瘤单瘤重分别比单作不接种的增加18.8%、64.5%、105.6%和58.5%(表 4)。
| 表4 根瘤菌接种方法和根瘤菌菌种对间作蚕豆结瘤特性和生物固氮的影响(盆栽) Table 4 Nodule traits and biological N2 fixation of intercropped faba bean affected by different rhizobia with different inoculation methods (pot experiment) |
在田间条件下, 接种NM353后, 在盛花期和盛花鼓粒期, 间作蚕豆比单作蚕豆单株根瘤干重分别高7.0%和6.4%(表 5)。在初花期、盛花期、盛花鼓粒期均以接种NM353根瘤菌后, 间作蚕豆单株根瘤干重为最高。在成熟期, 接种各个菌种的单、间作蚕豆的根瘤干重均趋于一致。单株根瘤数目和单瘤重均显示出菌种NM353的优势, 与单株根瘤干重结果变化趋势一致(表 4)。因此, 在田间对玉米/蚕豆间作体系接种根瘤菌NM353蚕豆结瘤特性最佳。
| 表5 接种根瘤菌对间作蚕豆结瘤特性的影响(大田) Table 5 Dynamic characteristics of intercropped faba bean nodule traits affected by different rhizobia inoculation (field experiment) |
盆栽试验接种根瘤菌的间作蚕豆的固氮比例(%Ndfa)和固氮量(Ndfa)比不接菌单作蚕豆平均高89.5%和93.7%, 比不接菌的间作蚕豆也分别高出39.8%和70.3%(表 4)。用保水剂拌种的方法, 接种根瘤菌NM353的蚕豆固氮比例显著高于接种CCBAU和G254, 比后两者均高26.3%。
用保水剂拌种方式接种NM353的蚕豆固氮量为最高, 分别比接种CCBAU、G254和QH258高22.5%、47.8%和19.2%(表 4)。此外, 在固氮量方面, 用丸衣化接种的方式接种根瘤菌G254的固氮量显著高于其他3个接菌方法, 但仍比保水剂拌种的方式接种NM353的蚕豆的固氮量低10.9%。从接菌方式上来看, 盆栽试验中, 清水拌种接菌方式的蚕豆固氮比例和固氮量依次比用三叶期灌根、保水剂拌种和丸衣化的接菌方式分别高10.6%和6.4%、18.4%和14.2%、24.8%和27.7%, 比不接菌单作蚕豆和不接菌间作蚕豆分别高113.5%和115.3%、57.5%和89.3%。因此, 在盆栽条件下, 用清水拌种方式接菌既节约成本, 减化操作环节, 又能保证接菌效果。
大田试验条件下, 在蚕豆盛花鼓粒期, 蚕豆的固氮比例和固氮量为整个生育期中最高, 说明随着生育期的推进, 蚕豆的固氮能力逐渐增强, 而在成熟期有所下降(图 3)。但总体上蚕豆固氮比例在整个生育期内变化不大。接种根瘤菌NM353后蚕豆固氮比例均高于其他接菌方式, 与各生育时期的对照处理相比都表现出显著差异, 在盛花鼓粒期其固氮比例高出对照28.2%, 差异达显著水平。在初花期和成熟期接种NM353的蚕豆固氮比例比接种CCBAU的分别高36.1%和31.0%, 尤其在盛花期和盛花鼓粒期, 其固氮比例分别比接种CCBAU高19.1%和11.1%, 差异达显著水平。接种NM353的蚕豆在整个生育期固氮量均显著高于接种CCBAU的蚕豆。
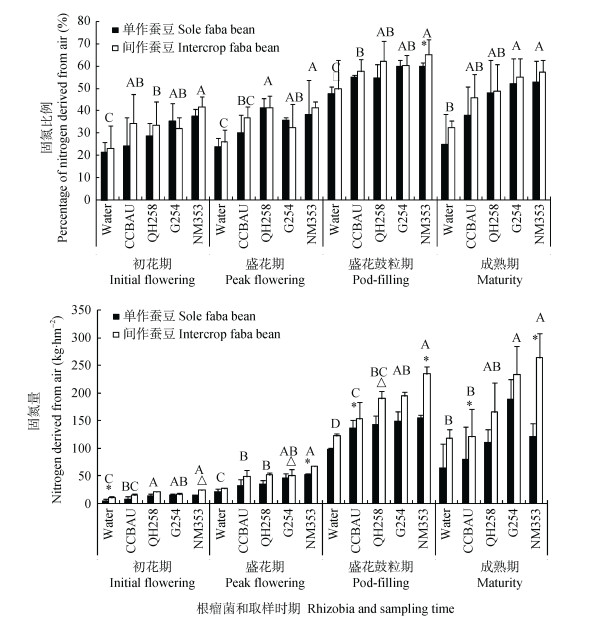
|
图 3 不同生育时期接种不同根瘤菌处理蚕豆的固氮比例(%Ndfa)和固氮量(Ndfa) (大田) Figure 3 Percentage of nitrogen derived from air (%Ndfa) and nitrogen derived from air (Ndfa) of faba bean with different rhizobia treatments at different growth stages (field experiment) 不同大写字母表示同一个生育时期5个接菌处理间差异显著(P < 0.05); △和*分别表示同一个生育时期同一接菌处理下单、间作间在10%和5%水平下差异显著。 Different capital letters demonstrate the significance of 5 treatments (4 rhizobia treatments and 1 control with water) at one growth stage at 0.05 level; △and * indicate the significant differences at 0.1 and 0.05 levels, respectively, of sole and intercrop with the same rhizobium treatment at one growth stage. |
与玉米共生阶段, 接种NM353的蚕豆的固氮量在初花期、盛花期、鼓粒期和成熟期分别比接种CCBAU的高64.8%、45.2%、34.3%和91.6%(表 5)。此外, 接种NM353的处理中间作蚕豆在盛花鼓粒期的固氮比例(%Ndfa)比单作的高9.2%, 差异达显著水平。就固氮量而言, 接种NM353的单间作蚕豆在初花期差异达到边缘性显著水平(P=0.051 4), 间作比单作高38.9%, 而在盛花期、盛花鼓粒期和成熟期则表现为显著水平, 间作分别比单作高25.7%、51.1%和115.3%。总体上, 单间作蚕豆在固氮量方面的差异较为明显, 固氮比例则差异不显著。
3 讨论与结论 3.1 玉米/蚕豆-根瘤菌固氮体系具有显著生产力优势豆科植物-根瘤菌共生体系是生物固氮体系中最强的共生体系, 而豆科/非豆科间作结合了粮食生产、生物固氮的优点, 是一种稳产、高产、高效、可持续的种植体系, 遍布世界各地[25-29]。前人通过盆栽试验研究表明, 在玉米/大豆间作体系中接种根瘤菌SH212, 玉米和大豆的生物产量均比间作不接种分别高15.9%和5.8%[14]; 在小麦/蚕豆间作体系中接种根瘤菌NM353, 小麦和蚕豆的生物产量均比间作不接种分别高14%和5%[15], 在长期耕种的土壤上进行的玉米/蚕豆间作体系接种根瘤菌GS374后, 接种蚕豆的生物学产量和籽粒产量分别比不接种处理提高10.4%和13.7%, 与接种蚕豆间作的玉米生物学产量和籽粒产量比不接种蚕豆间作的玉米分别提高25.6%和34.3%[17]。本文通过新开垦土壤的盆栽和大田试验相结合的方法, 发现在玉米、蚕豆共生期间, 对间作体系中蚕豆接种高效根瘤菌, 间作蚕豆比单作蚕豆籽粒产量增加98.7%, 间作玉米比单作玉米总体增产5.8%。且以接种NM353的处理, 间作蚕豆和玉米的地上部植株生物量为最高。用保水剂拌种的方式接种NM353根瘤菌的玉米/蚕豆-根瘤菌间作共生体系的籽粒产量土地当量比达1.65。从生物量和作物长势来看用保水剂拌种的接种方式接种NM353根瘤菌为最佳处理, 盆栽试验和大田试验均验证了这一点。由此说明在新开垦土壤这种特定的生态条件下, 玉米/蚕豆间作体系和根瘤菌间协调好豆科植物遗传型、根瘤菌遗传型和环境条件三者间的互作, 可以构建禾本科/豆科-根瘤菌高效共生体系。与单作不接种蚕豆和间作不接种的处理相比较, 玉米/蚕豆间作体系接种的4种根瘤菌中, 以保水剂拌种方式接种NM353的间作蚕豆地上部氮素积累量最高。因此, 本文成功克服了豆科植物与根瘤固氮菌共生的种种限制性因素, 如pH、土壤盐分、土壤养分、极端温度、土壤湿度和植物生长状况不佳[30-31]等, 在新开垦土壤上构建了玉米/蚕豆-根瘤菌高效共生固氮体系。也进一步说明了对玉米/蚕豆间作体系接种根瘤菌是有效的, 可以充分挖掘豆科植物-根瘤菌共生固氮体系的高效固氮能力[6, 20]和豆科/禾本科间作的种间互促作用, 进而提高体系的生产力优势。
3.2 玉米/蚕豆间作体系中高效根瘤菌及接菌方法的筛选以根瘤菌-紫花苜蓿(Medicago sativa)-无芒雀麦(Bromus inermis)互作体系为模式, 贾瑞宗[32]提到筛选高效根瘤菌的方法, 主要从3个方面考虑: 1)比较菌株的结瘤能力、固氮能力和与土著根瘤菌的竞争能力。2)探讨根瘤菌菌株和苜蓿品种间的匹配效果, 即观察宿主植物的形态学参数和地上部植株养分等。3)把室内盆栽试验结果与大田定点试验相结合。研究结果显示, 豆科接种根瘤菌并与禾本科间作提高生物固氮, 缓解“铵阻遏”, 促进豆、禾双增产的生物学效应。发现接种根瘤菌和间作两种措施都能明显提高作物生物量, 而且间作同时接种则增产效果更为明显。本文通过盆栽和大田试验相结合的方法得出, 根瘤菌NM353相对于其他根瘤菌更能适应该新开垦土壤环境条件下的玉米/蚕豆间作体系, 玉米、蚕豆和根瘤菌NM353三者之间能更好地发挥间作促进作用和豆科-根瘤菌共生体系的共生固氮优势。用保水剂拌种的方式接种NM353根瘤菌的蚕豆植株生物量比用此种方式接种CCBAU的少8.8%, 而间作玉米的生物量则是接种NM353的比接种CCBAU的高20.1%。用保水剂拌种方式接种NM353根瘤菌的玉米/蚕豆间作体系地上部植株生物量为最高, 土地当量比达1.65。4种接种方法中, 清水拌种和保水剂拌种的结瘤数显著高于丸衣化和三叶期灌根的接种处理, 清水拌种和保水剂拌种分别比间作不接种蚕豆的结瘤数增加102.2%和126.6%。不同接种方式蚕豆单株根瘤干重也表现出同样趋势, 且从初花期到盛花鼓粒期均以接种NM353根瘤菌后, 间作蚕豆单株根瘤干重为最高。用保水剂拌种的方式接种NM353的蚕豆的固氮比例和固氮量都显著高于用此种方式接种的CCBAU、G254和QH258。因此本研究成功将这种间作优势和豆科-根瘤菌生物固氮作用联合起来应用于农作物, 在新开垦土壤上成功筛选出高效根瘤菌及其接种技术, 在新开垦土壤上构建了高效固氮体系玉米/蚕豆-根瘤菌种植模式。
Hauggaard-Nielsen等[33]曾呼吁人们重视并充分挖掘同一个种植体系中对豆科植物接种根瘤菌并搭配适宜的豆科和非豆科植物间作来增进所种植体系的复合潜力。孙艳梅[34]将根瘤菌(CCBAU0119)接种到紫花苜蓿/老芒麦(Elymus sibiricus)间作体系, 取得了良好的增产效果, 并且发现间作条件下接种根瘤菌, 在种植的前两年可显著提高苜蓿产量, 而第3年根瘤菌却没有明显表现出来作用。因此, 建议在实践生产中可以考虑在豆科作物生长过程中进行多次接种, 以保证所构建体系的生物固氮优势, 以此来培肥土壤, 降低农业生产的环境风险, 提高土壤的可持续利用能力。
本文通过盆栽和大田试验相结合的方法, 在新开垦土壤上对玉米/蚕豆间作体系进行根瘤菌接种和接种方法筛选试验, 证明对该间作体系接种根瘤菌是有效的。构建的蚕豆/玉米间作体系, 用保水剂拌种方式对蚕豆接种根瘤菌NM353后, 在间作促进作用和共生固氮协同作用下, 间作蚕豆籽粒产量比单作不接种处理平均增加237.11%, 而间作玉米籽粒产量也比单作平均增加21.8%。且间作接菌处理下间作蚕豆和玉米的地上部植株生物量为最高, 共生体系的土地当量比达1.65。4种根瘤菌中, 以接种NM353的间作蚕豆地上部含氮量最高。接种根瘤菌NM353蚕豆结瘤数和根瘤干重都高于接种其他根瘤菌。用保水剂拌种的方式接种NM353蚕豆的固氮比例和固氮量都显著高于其他处理。总之, 以采用保水剂拌种方式接种NM353为最佳选择, 可以在新开垦土壤上构建禾本科/豆科-根瘤菌高效固氮模式。
| [1] | LI L, YANG S C, LI X L, et al. Interspecific complementary and competitive interactions between intercropped maize and faba bean[J]. Plant and Soil, 1999, 212(2): 105–114. DOI:10.1023/A:1004656205144 |
| [2] | LI L, SUN J H, ZHANG F S, et al. Wheat/maize or wheat/soybean strip intercropping. I. Yield advantage and interspecific interactions on nutrients[J]. Field Crops Research, 2001, 71(2): 123–137. DOI:10.1016/S0378-4290(01)00156-3 |
| [3] | LI L, ZHANG F S, LI X L, et al. Interspecific facilitation of nutrient uptake by intercropped maize and faba bean[J]. Nutrient Cycling in Agroecosystems, 2003, 65(1): 61–71. DOI:10.1023/A:1021885032241 |
| [4] | LI L, SUN J H, ZHANG F S, et al. Root distribution and interactions between intercropped species[J]. Oecologia, 2006, 147(2): 280–290. DOI:10.1007/s00442-005-0256-4 |
| [5] | LI L, LI S M, SUN J H, et al. Diversity enhances agricultural productivity via rhizosphere phosphorus facilitation on phosphorus-deficient soils[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(27): 11192–11196. DOI:10.1073/pnas.0704591104 |
| [6] | FAN F L, ZHANG F S, SONG Y N, et al. Nitrogen fixation of faba bean (Vicia faba L.) interacting with a non-legume in two contrasting intercropping systems[J]. Plant and Soil, 2006, 283(1/2): 275–286. |
| [7] |
李玉英, 余常兵, 孙建好, 等.
蚕豆/玉米间作系统经济生态施氮量及对氮素环境承受力[J]. 农业工程学报, 2008, 24(3): 223–227.
LI Y Y, YU C B, SUN J H, et al. Nitrogen environmental endurance and economically-ecologically appropriate amount of nitrogen fertilizer in faba bean/maize intercropping system[J]. Transactions of the CSAE, 2008, 24(3): 223–227. |
| [8] | BARGAZ A, ISAAC M E, JENSEN E S, et al. Intercropping of faba bean with wheat under low water availability promotes faba bean nodulation and root growth in deeper soil layers[J]. Procedia Environmental Sciences, 2015, 29: 111–112. DOI:10.1016/j.proenv.2015.07.188 |
| [9] | LIU Y C, QIN X M, XIAO J X, et al. Intercropping influences component and content change of flavonoids in root exudates and nodulation of faba bean[J]. Journal of Plant Interactions, 2017, 12(1): 187–192. DOI:10.1080/17429145.2017.1308569 |
| [10] | MEI P P, GUI L G, WANG P, et al. Maize/faba bean intercropping with rhizobia inoculation enhances productivity and recovery of fertilizer P in a reclaimed desert soil[J]. Field Crops Research, 2012, 130: 19–27. DOI:10.1016/j.fcr.2012.02.007 |
| [11] | LATATI M, BARGAZ A, BELARBI B, et al. The intercropping common bean with maize improves the rhizobial efficiency, resource use and grain yield under low phosphorus availability[J]. European Journal of Agronomy, 2016, 72: 80–90. DOI:10.1016/j.eja.2015.09.015 |
| [12] | LI B, LI Y Y, WU H M, et al. Root exudates drive interspecific facilitation by enhancing nodulation and N2 fixation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(23): 6496–6501. DOI:10.1073/pnas.1523580113 |
| [13] |
陈文新, 汪恩涛, 陈文峰.
根瘤菌-豆科植物共生多样性与地理环境的关系[J]. 中国农业科学, 2004, 37(1): 81–86.
CHEN W X, WANG E T, CHEN W F. The relationship between the symbiotic promiscuity of rhizobia and legumes and their geographical environments[J]. Scientia Agricultura Sinica, 2004, 37(1): 81–86. |
| [14] |
李淑敏, 武帆.
大豆/玉米间作体系中接种AM真菌和根瘤菌对氮素吸收的促进作用[J]. 植物营养与肥料学报, 2011, 17(1): 110–116.
LI S M, WU F. Nitrogen uptake facilitation in soybean/maize intercropping system inoculated with rhizobium and arbuscular mycorrhizal fungi[J]. Plant Nutrition and Fertilizer Science, 2011, 17(1): 110–116. DOI:10.11674/zwyf.2011.0115 |
| [15] |
汤东生, 朱有勇.
蚕豆/小麦间作对结瘤效应研究初探[J]. 云南农业大学学报, 2005, 20(3): 331–334.
TANG D S, ZHU Y Y. The effect on diverse planting of fababean on its nodulation[J]. Journal of Yunnan Agricultural University, 2005, 20(3): 331–334. |
| [16] |
肖焱波, 李隆, 张福锁.
根瘤菌菌株NM353对小麦/蚕豆间作体系中作物生长及养分吸收的影响[J]. 植物营养与肥料学报, 2006, 12(1): 89–96.
XIAO Y B, LI L, ZHANG F S. The enhancement of growth and nutrients uptake by crops with inoculating rhizobium strain NM353 in wheat and faba bean intercropping system[J]. Plant Nutrition and Fertilizer Science, 2006, 12(1): 89–96. DOI:10.11674/zwyf.2006.0115 |
| [17] |
房增国, 赵秀芬, 孙建好, 等.
接种根瘤菌对蚕豆/玉米间作系统氮营养的影响[J]. 华北农学报, 2009, 24(4): 124–128.
FANG Z G, ZHAO X F, SUN J H, et al. Effects of rhizobium inoculation on nitrogen nutrition in faba bean/maize intercropping system[J]. Acta Agriculturae Boreali-Sinica, 2009, 24(4): 124–128. DOI:10.7668/hbnxb.2009.04.025 |
| [18] | ZHANG N N, SUN Y M, LI L, et al. Effects of intercropping and Rhizobium inoculation on yield and rhizosphere bacterial community of faba bean (Vicia faba L.)[J]. Biology and Fertility of Soils, 2010, 46(6): 625–639. DOI:10.1007/s00374-010-0469-5 |
| [19] |
方中达.
植病研究法[M]. 第3版.北京: 中国农业出版社, 2001.
FANG Z D. Plant Disease Research[M]. 3rd ed. Beijing: China Agricultural Press, 2001. |
| [20] |
王宏, 姚桂荣, 李忠平, 等.
豆科牧草丸衣化接种根瘤菌试验研究[J]. 内蒙古草业, 1997(2/3): 42–46.
WANG H, YAO G R, LI Z P, et al. Experimental research on inoculation of rhizobium to legume forage by pill clothing[J]. Inner Mongolia Prataculture, 1997(2/3): 42–46. |
| [21] | WILLEY R W. Intercropping—its importance and research needs: Part 1. Competition and yield advantages[J]. Field Crops Research, 1979, 32: 1–10. |
| [22] | PEOPLES M B, BODDEY R M, HERRIDGE D F. Quantification of Nitrogen Fixation[M]//LEIGH G J. Nitrogen Fixation at the Millennium. Brighton: Elsevier, 2002: 357–389 |
| [23] | SHEARER G, KOHL D H. N2-fixation in field settings: Estimations based on natural 15N abundance[J]. Australian Journal of Plant Physiology, 1986, 13(6): 699–756. |
| [24] | SAS Institute. SAS User's Guide: Statistics[M]. Cary, NC, United States: SAS Institute, 2001. |
| [25] | SHANTHARAM S, MATTOO A K. Enhancing biological nitrogen fixation: An appraisal of current and alternative technologies for N input into plants[J]. Plant and Soil, 1997, 194(1/2): 205–216. DOI:10.1023/A:1004234315999 |
| [26] | CHU G X, SHEN Q R, CAO J L. Nitrogen fixation and N transfer from peanut to rice cultivated in aerobic soil in an intercropping system and its effect on soil N fertility[J]. Plant and Soil, 2004, 263(1): 17–27. DOI:10.1023/B:PLSO.0000047722.49160.9e |
| [27] | CORRE-HELLOU G, FUSTEC J, CROZAT Y. Interspecific competition for soil N and its interaction with N2 fixation, leaf expansion and crop growth in pea-barley intercrops[J]. Plant and Soil, 2006, 282(1/2): 195–208. |
| [28] | ADU-GYAMFI J J, MYAKA F A, SAKALA W D, et al. Biological nitrogen fixation and nitrogen and phosphorus budgets in farmer-managed intercrops of maize-pigeonpea in semi-arid southern and eastern Africa[J]. Plant and Soil, 2007, 295(1/2): 127–136. |
| [29] | NEUMANN A, SCHMIDTKE K, RAUBER R. Effects of crop density and tillage system on grain yield and N uptake from soil and atmosphere of sole and intercropped pea and oat[J]. Field Crops Research, 2007, 100(2/3): 285–293. |
| [30] | CHALK P M, ALVES B J R, BODDEY R M, et al. Integrated effects of abiotic stresses on inoculants performance, legume growth and symbiotic dependence estimated by 15N dilution[J]. Plant and Soil, 2010, 328(1/2): 1–16. |
| [31] | Zahran H H. Rhizobium-legume symbiosis and nitrogen fixation under severe conditions and in an arid climate[J]. Microbiology and Molecular Biology Reviews, 1999, 63(4): 968–969. |
| [32] |
贾瑞宗. 高效根瘤菌-紫花苜蓿-无芒雀麦农田耕作系统的建立和生物学效应评估[D]. 北京: 中国农业大学, 2009: 205–210
JIA R Z. An evaluation of best practices for a highly effective rhizobia-alfafa-bromus intercropping system in agriculture[D]. Beijing: China Agricultural University, 2009: 205–210 |
| [33] | HAUGGAARD-NIELSEN H, JENSEN E S. Facilitative root interactions in intercrops[J]. Plant and Soil, 2005, 274(1/2): 237–250. |
| [34] |
孙艳梅. 高效根瘤菌-紫花苜蓿-无芒雀麦农田耕作系统的建立和生物学效应评估[D]. 北京: 中国农业大学, 2010: 45–81
SUN Y M. Influence of rhizobia inoculation of alfalfa (Medicago sativa L.) and intercropping with siberian wildrye (Elymus sibiricus L.) on rhizosphere soil microbial activity and community composition[D]. Beijing: China Agricultural University, 2010: 45–81 |
 2018, Vol. 26
2018, Vol. 26



