2. 浙江师范大学生态研究所 金华 321004
2. Institute of Ecology, Zhejiang Normal University, Jinhua 321004, China
土壤是生态环境的重要组成部分, 它与人类生产和生命活动有着密切联系, 因此也极易受多种污染物的污染, 其中重金属盐是土壤污染的重点污染源之一。重金属污染具有不可逆累积性, 易于富集, 不易降解, 它能通过食物链进入人体从而危害人类健康, 这给人类社会以及其所处的生态环境带来了严重的负面影响[1-2]。其中Cu、Pb是我国土壤-植物生态系统中主要的重金属污染物, 过量的Pb进入环境并参与水体-土壤-生物系统循环, 植物吸收富集重金属Pb后会扰乱植物对矿物营养的吸收; Cu是植物生长发育所必需的微量元素, 但过量的Cu具有较高的毒性, 会使植物生长发育受阻、生理代谢过程发生紊乱等[3-9]。因此, 重金属Cu、Pb对土壤生态环境影响的研究引起了普遍关注[10-11]。土壤中的污染源不是单独存在, 往往是多种污染成分同时存在, 产生综合作用, 因此通过研究Cu、Pb复合污染对植物胁迫的影响效应, 可探索土壤复合重金属污染的治理手段[12-13]。
目前对土壤重金属污染治理的研究大多以植物修复为主, 通过植物对重金属的吸收、累积、转化来达到治理目的[14]。该方法适用污染因子广泛, 且修复投入少、成本低, 不会引起二次污染, 能大面积推广应用, 因此成为国内外研究的热点[15-16]。由于国内外关于超积累富集植物的筛选等方面的研究对象以农作物[17]和蔬菜[18]较多, 其研究材料通常矮小、生长慢、生物量低、周期长且大多不具备较好的经济效益, 从而导致难以大规模推广应用[19]。牧草不仅是饲料, 适应性强、生长快速、生物量大, 而且在生态恢复、水土保持等方面也有着重要作用。迄今国内外已有数十种牧草用于重金属污染土壤的植物修复, 如紫花苜蓿(Medicago sativa)、多花黑麦草(Lolium multiflorum)等[20]。然而, 紫花苜蓿作为修复植物对Pb的富集能力较强, 黑麦草对Cu有较强的富集特性, 是Pb-Zn尾矿修复的先锋植物, 而紫花苜蓿、黑麦草(L. perenne)和狼尾草(Pennisetum alopecuroides)对Cu-Pb复合污染土壤的研究报道却较少[21-23]。本研究选择紫花苜蓿、黑麦草和狼尾草等3种牧草作为试验材料, 考察牧草对土壤重金属Cu、Pb的耐受能力、吸收能力和转移能力, 寻找适宜修复Cu-Pb污染的牧草, 以期为今后深入牧草修复重金属污染土壤的适宜性提供一定的研究依据。
1 材料与方法 1.1 供试材料 1.1.1 供试植物供试植物紫花苜蓿、黑麦草和狼尾草种子均购于浙江省金华市种子市场, 选取颗粒饱满、个体均匀的种子作为试验材料, 种植于盆栽中, 用于试验。
1.1.2 供试土壤土壤采自浙江师范大学的生物园基地, 取0~20 cm的表层农田土壤, 自然风干后, 先初步剔除其中粗杂质, 过100目筛后备用。为了在取样时减少对植物根部的伤害, 将黄沙和土壤按1:4混合作为培养基质。测得混合后土壤Cu的背景值为35.94 mg·kg-1, Pb的背景值为78.22 mg·kg-1, pH为6.8左右。用分析纯的CuCl2·2H2O和Pb(NO3)2配制成不同浓度梯度的重金属盐溶液, 拌入风干的土壤中并充分混匀, 静置钝化两周后作为试验土壤。
1.2 研究方法根据《土壤环境质量标准》(GB 15618—2008)、自然背景值及前期试验Cu、Pb单一污染土壤对种子萌发及幼苗影响的结果进行综合设计, 共设9个处理组(表 1), 每组3盆重复。试验所用的每个花盆中加入1.5 kg供试土壤, 加入不同浓度的重金属, 制成各浓度污染土壤, 然后将消毒处理过的种子直接播种在配置好重金属浓度的土壤中。加供试土壤区域地下水使土壤含水率为田间持水量的60%, 根据植株大小, 每盆留取6个植株(同一植物的处理组中植株数一致)。试验60 d后收获所有植物和根系周围土样。
| 表1 重金属交互浓度设计及处理代码 Table 1 Design of heavy metal interaction concentration and processing code |
取植物样先用自来水充分冲洗, 再用0.1 mol·L-1稀盐酸洗净, 最后用去离子水淋洗2~3次, 吸干表面水分。将植物样品分成地上部和根系两部分, 置于烘箱中105 ℃杀青30 min, 70 ℃下烘干至恒重, 称取各部位干重, 研磨过60目尼龙筛待测。将土样自然风干后, 研磨过100目尼龙筛待测。用HNO3-HClO4消解植物样, HCl-HNO3-HClO4消解土样。用电感耦合等离子体原子发射光谱法(Inductively Coupledplasma-Atomic Emission Spectrometry, ICP-AES)进行植物和土壤Cu、Pb含量的测定。
1.4 数据处理与分析| $ 抗性系数 = 处理总生物学产量/对照总生物学 产量 $ | (1) |
| $ 生物富集系数\left( {{\rm{bioaccumulation}}\;\;{\rm{ factor, BAF}}} \right) = C{\rm{p}}/C{\rm{s}} $ | (2) |
| $ 转运系数\left( {{\rm{translocation}}\;\;{\rm{ factor, TF}}} \right) = C{\rm{o}}/C{\rm{u}} $ | (3) |
式中: Cp为植物体内该重金属含量, Cs为土壤中该重金属含量, Co为植物地上部分该重金属含量, Cu为植物根部该重金属含量。
试验数据采用Microsoft Excel 2010、Origin 8.0、SPSS 18.0统计分析软件进行数据分析处理。
2 结果与分析 2.1 Cu、Pb单一及其复合处理对3种牧草生长的影响从图 1A可知, 单一Cu污染下, 紫花苜蓿地上部生物量随处理浓度增加呈下降趋势, 黑麦草和狼尾草地上部生物量随处理浓度增加呈先下降后上升趋势; 高浓度Cu污染下狼尾草地上部生物量显著高于紫花苜蓿和黑麦草(P < 0.05), 表明狼尾草对高浓度Cu污染土壤的耐性更强。单一Pb污染下, 3种牧草地上部生物量均随着处理浓度增加呈先上升后下降的趋势; 紫花苜蓿地上部生物量显著高于黑麦草(P < 0.05)且低浓度下显著高于狼尾草(P < 0.05), 表明紫花苜蓿对Pb污染土壤的耐性更强。Cu-Pb污染条件下, 紫花苜蓿在Cu1Pb2处理组地上部生物量最大, 黑麦草在Cu1Pb1处理组最大, 狼尾草在Cu2Pb2处理组最大; 狼尾草在Cu-Pb复合污染下地上部生物量显著高于黑麦草(P < 0.05), 紫花苜蓿只在Cu1Pb2处理组时显著高于黑麦草(P < 0.05), 而与狼尾草差异不显著(P > 0.05)。同一种牧草地上部生物量在不同处理组之间也存在显著性差异, 紫花苜蓿Pb1处理组地上部生物量显著高于其他处理组(P < 0.05);黑麦草Cu1Pb1处理组地上部生物量显著高于Cu2Pb2处理组(P < 0.05);狼尾草Cu2Pb2处理组地上部生物量显著高于其他处理组(P < 0.05), 其他处理组之间差异不显著(P > 0.05)。

|
图 1 Cu、Pb单一及复合污染对3种牧草地上部(A)和根部(B)生物量的影响 Figure 1 Effects of Cu, Pb single and combined pollution on shoot (A) and root (B) biomass of three pastures 不同大写字母表示在各重金属处理下3种牧草间差异显著(P < 0.05), 不同小写字母表示在同一牧草不同重金属处理间差异显著(P < 0.05)。 Different capital letters indicate significant differences among three pastures under the same heavy metal treatment (P < 0.05). Different lowercase letters indicate significant differences among heavy metal treatments for the same pasture (P < 0.05). |
从图 1B可知, 单一Cu污染下, 紫花苜蓿根部生物量随着处理浓度增加呈下降趋势, 而黑麦草和狼尾草则反之, 高浓度Cu污染下狼尾草根部生物量显著高于紫花苜蓿和黑麦草(P < 0.05), 表明狼尾草对高浓度Cu污染土壤的耐性更强; 单一Pb污染下, 3种牧草根部生物量均随着处理浓度增加呈先上升后下降趋势, 高浓度Pb污染下黑麦草和狼尾草根部生物量显著高于紫花苜蓿(P < 0.05), 表明紫花苜蓿对Pb污染土壤的耐性更弱; Cu-Pb污染条件下, 紫花苜蓿和狼尾草在Cu1Pb2处理组根部生物量最大, 黑麦草在Cu1Pb1处理组最大, 狼尾草在Cu-Pb复合污染下根部生物量显著高于紫花苜蓿(P < 0.05)。同一种牧草根部生物量在不同处理组之间也存在显著性差异, 紫花苜蓿Pb1处理组根部生物量显著高于其他处理组(P < 0.05);黑麦草Pb1和Pb2污染处理组根部生物量显著高于Cu1Pb2、Cu2Pb1和Cu2Pb2处理组(P < 0.05);狼尾草Cu2处理组根部生物量显著高于Pb2、Cu1Pb1和Cu2Pb2处理组(P < 0.05)。
2.2 Cu、Pb单一及其复合处理对3种牧草抗性系数的影响从图 2可知, 单一Cu污染下, 牧草的抗性系数:狼尾草 > 黑麦草 > 紫花苜蓿, 低浓度Cu处理组3种牧草之间对Cu的抗性能力差异不显著(P > 0.05), 而在高浓度Cu处理组黑麦草和狼尾草对Cu的抗性能力显著高于紫花苜蓿(P < 0.05);单一Pb污染下, 紫花苜蓿的抗性系数显著大于黑麦草和狼尾草(P < 0.05), 而且在低浓度Pb处理下最大, 高浓度Pb处理组3种牧草的抗性系数差异不显著(P < 0.05); Cu-Pb复合污染下, 高浓度Cu处理组3种牧草的抗性系数均呈现:狼尾草 > 黑麦草 > 紫花苜蓿, 且3种牧草之间对重金属的抗性能力差异显著(P < 0.05)。同一种牧草抗性系数在不同处理间也存在显著性差异, 紫花苜蓿Pb1处理组的抗性系数显著高于其他处理组(P < 0.05);黑麦草Cu2、单一Pb以及Cu1Pb1污染处理抗性系数显著高于Cu2Pb2处理(P < 0.05);狼尾草Cu2Pb2处理抗性系数显著高于Pb2处理(P < 0.05), 而其他处理之间差异不显著(P > 0.05)。低浓度Cu污染下, 紫花苜蓿和狼尾草的抗性系数: Cu1Pb2 > Cu1Pb1 > Cu1, 表明Pb的添加会促进紫花苜蓿和狼尾草的生长且随着Pb浓度的升高促进作用会加强; 黑麦草的抗性系数: Cu1Pb1 > Cu1 > Cu1Pb2, 表明低浓度Pb会促进黑麦草的生长, Pb浓度过高时则会抑制其生长。高浓度Cu污染条件下, 紫花苜蓿和黑麦草的抗性系数: Cu2 > Cu2Pb1 > Cu2Pb2, 表明Pb的添加会抑制紫花苜蓿和黑麦草的生长且随着Pb浓度的升高抑制作用会加强; 狼尾草的抗性系数: Cu2Pb2 > Cu2 > Cu2Pb1, 表明低浓度Pb会抑制黑麦草的生长, Pb浓度过高时则会促进狼尾草的生长。低浓度Pb污染下, 紫花苜蓿的抗性系数: Pb1 > Cu1Pb1 > Cu2Pb1, 表明Cu的添加会抑制紫花苜蓿的生长且随着Cu浓度的升高抑制作用加强; 黑麦草的抗性系数: Cu1Pb1 > Pb1 > Cu2Pb1, 表明低浓度Cu会促进黑麦草的生长, Cu浓度过高时则会抑制其生长; 狼尾草的抗性系数: Pb1 > Cu2Pb1 > Cu1Pb1, 表明Cu的添加会抑制狼尾草的生长, 但随着Cu浓度升高抑制作用会减弱。高浓度Pb污染下, 紫花苜蓿和黑麦草的抗性系数: Pb2 > Cu1Pb2 > Cu2Pb2, 表明Pb的添加会抑制紫花苜蓿和黑麦草的生长且随着Pb浓度的升高抑制作用加强; 狼尾草的抗性系数: Cu2Pb2 > Cu1Pb2 > Pb2, 表明Cu的添加会促进狼尾草的生长且随着Cu浓度的升高促进作用加强。
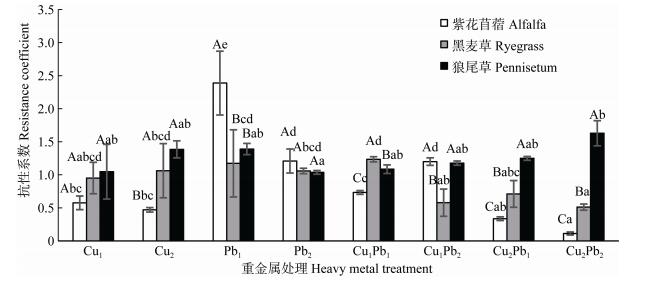
|
图 2 Cu、Pb单一及复合污染中3种牧草的抗性系数 Figure 2 Resistance coefficients of three pastures in Cu, Pb single and combined pollutions 不同大写字母表示在各重金属处理下3种牧草间差异显著(P < 0.05), 不同小写字母表示在同一牧草不同重金属处理间差异显著(P < 0.05)。 Different capital letters indicate significant differences among three pastures under the same heavy metal treatment (P < 0.05). Different lowercase letters indicate significant differences among heavy metal treatments for the same pasture (P < 0.05). |
从图 3可知, 单一Cu及Cu-Pb复合污染下, 随着土壤中Cu浓度增加, 牧草植物地上部分、根的Cu含量都增加。当土壤中Cu添加量为200 mg·kg-1时, 紫花苜蓿地上部分、根部的Cu在300 mg·kg-1 Pb复合暴露时分别升高104.31%、146.2%, 在800 mg·kg-1 Pb复合时地上部分升高13.26%, 根部降低28.06%;继续加大土壤中Cu污染量至400 mg·kg-1, 紫花苜蓿地上部分Cu含量随着Pb含量增加而升高, 根部则随着Pb含量增加而降低, 由此可见土壤中Pb含量增加, 会抑制紫花苜蓿对Cu的吸收, 但高浓度Cu处理下土壤中Pb含量增加, 会促进紫花苜蓿地上部分对Cu的吸收。黑麦草地上部分低浓度Cu处理下土壤中Pb含量增加, 会抑制黑麦草地上部分对Cu的吸收, 高浓度Cu处理下反之; 低浓度Cu处理下土壤中Pb含量增加, 会促进黑麦草根部对Cu的吸收, 高浓度Cu处理下反之; 狼尾草土壤中Pb含量增加, 会促进狼尾草对Cu的吸收。在Cu2Pb1和Cu2Pb2处理组中紫花苜蓿地上部对Cu的富集量显著高于黑麦草和狼尾草(P < 0.05), 而黑麦草根部对Cu的富集量显著高于紫花苜蓿和狼尾草(P < 0.05)。
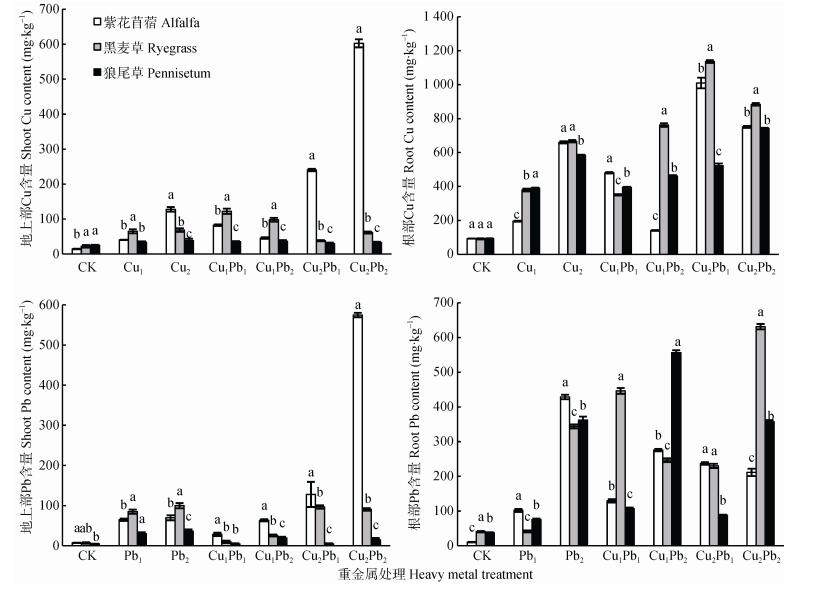
|
图 3 Cu、Pb单一及复合污染中3种牧草的Cu、Pb含量 Figure 3 Cu and Pb contents of three pastures in Cu, Pb single and combined pollutions 不同小写字母表示各重金属处理下3种牧草间差异显著(P < 0.05)。 Different lowercase letters indicate significant differences among three pastures under the same heavy metal treatment (P < 0.05). |
单一Pb及Cu-Pb复合污染下, Pb在牧草植物地上部分、根中的富集情况表明, 单一Pb污染下, 牧草植物地上部分、根部Pb含量随着污染程度增加而增加。300 mg·kg-1 Pb条件下, 对比单一浓度Pb, 低浓度Cu(200 mg·kg-1)复合时紫花苜蓿地上部分Pb含量有所降低, 高浓度Cu则有所增加, 说明添加Cu会抑制紫花苜蓿对Pb的吸收, 随着Cu浓度的增加, Cu对紫花苜蓿吸收Pb的抑制作用会减弱, 达到一定Cu浓度时会促进紫花苜蓿对Pb的吸收。紫花苜蓿地上部对Pb的富集量在复合重金属处理组下均显著高于黑麦草和狼尾草(P < 0.05)。3种牧草根部在单一Pb及Cu-Pb复合污染下对Pb的富集呈差异显著(P < 0.05), Cu2Pb1处理组紫花苜蓿和黑麦草对Pb的富集量差异不显著(P > 0.05)。
整体来看, 这3种牧草植物地上部分和根系对重金属的富集差异很大, 基本上牧草植物的根系中重金属含量大于地上部分, 这可能与植物对重金属的耐性机制有关。Cu-Pb复合污染影响复杂, 在一定浓度下, 土壤Cu-Pb间会相互促进对方在牧草植物中的吸收。
2.4 Cu、Pb单一及其复合处理下3种牧草Cu、Pb的富集系数和转运系数从图 4可知, 3种牧草植物在单一及复合污染下对Cu的富集能力普遍高于Pb, 表明3种牧草植物对重金属Cu的富集能力更强。3种牧草地上部对Cu的富集系数在Cu2Pb2处理组最大, 达1.61, 根部对Cu的富集系数普遍大于1, 只在Cu1Pb2处理组时紫花苜蓿根部Cu富集系数为0.85。3种牧草地上部和根部对Pb的富集系数普遍小于1, 只在Cu1Pb1处理组时黑麦草根部Pb富集系数大于1, 达1.46。3种牧草之间对Cu、Pb的富集系数普遍差异显著(P < 0.05)。
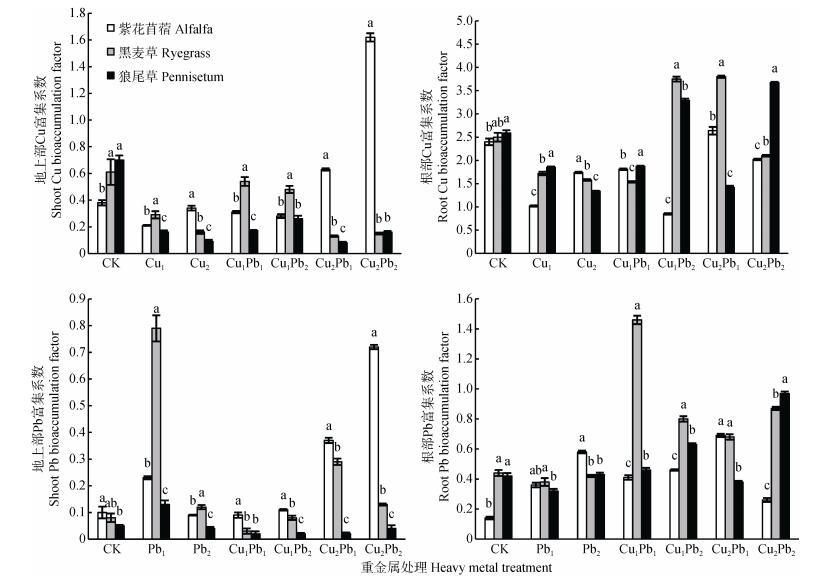
|
图 4 Cu、Pb单一及复合污染中3种牧草对Cu、Pb的富集系数 Figure 4 Bioaccumulation factors of Cu and Pb of three pastures in Cu, Pb single and combined pollutions 不同小写字母表示各重金属处理下3种牧草间间差异显著(P < 0.05)。 Different lowercase letters indicate significant differences among three pastures under the same heavy metal treatment (P < 0.05). |
从图 5可知, 3种牧草植物在单一及复合污染下对Cu的转运系数均低于1, 紫花苜蓿在Cu2Pb2处理组对Pb的转运系数最高, 达2.72, 而黑麦草在低浓度Pb污染条件下对Pb的转运系数大于1, 为2.06, 说明这两种牧草在该污染条件下能较容易地从地下部分向地上部分迁移重金属Pb, 反映出这两种植物对Pb具有植物提取的能力。狼尾草对重金属的转移系数均小于1, 可能是植物会通过自身的排斥机制减少毒害。3种牧草植物之间对Cu的转运系数除对照组均存在显著性差异(P < 0.05), 对Pb的转运系数除对照组和Cu1Pb1均存在显著性差异(P < 0.05), 紫花苜蓿在Cu1Pb2、Cu2Pb1和Cu2Pb2处理组时对Cu、Pb的转运系数均显著高于和黑麦草和狼尾草(P < 0.05)。紫花苜蓿和黑麦草对Cu、Pb的转运能力强于狼尾草。

|
图 5 Cu、Pb单一及复合污染中3种牧草对Cu、Pb的转运系数 Figure 5 Translocation factors of Cu and Pb of three pastures in Cu, Pb single and combined pollutions 不同小写字母表示各重金属处理下3种牧草间间差异显著(P < 0.05)。 Different lowercase letters indicate significant differences among three pastures under the same heavy metal treatment (P < 0.05). |
研究表明, 植物对重金属的吸收存在浓度效应, 即随着环境中重金属离子浓度的升高, 植物富集的重金属含量也会相应增加, 毒害程度也会加深[24-25]。植物是从土壤环境中富集重金属并通过生理生化过程将其累积到植物体中, 而不同植物对重金属的耐性、吸收、转运能力相差很大[26]。本研究所选用的3种牧草植物在对受Cu-Pb复合污染土壤的修复研究中, 植物吸收的重金属均主要积累在植物根系, 这与大多数植物对重金属的累积特性相似, 可能是植物启动了适应重金属的忍耐机制, 根部通常能释放多种有利于对有毒重金属起固定作用的有机化合物, 包括单糖、氨基酸等[27], 即根部的重金属富集量大于地上部分, 不具备超富集植物的一般特征, 而迄今发现的超富集植物大多生长缓慢, 生物量小, 极大限制了植物修复的实际应用[28]。现已探明, 本试验采用的紫花苜蓿、黑麦草和狼尾草对Cu和Pb均有一定的耐性, 适用于Cu-Pb复合污染土壤的修复[29]。
在相同的环境条件下, 紫花苜蓿、黑麦草和狼尾草生物量和抗性系数基本上呈现显著性差异(P < 0.05), 产生差异的主要原因可能是这3种牧草自身各异的形态而非是所受重金属的伤害程度, 因为高大牧草植株的生物量明显要高于矮小的植株。3种牧草在单一及复合污染条件下随着不同处理浓度的变化直接影响到植物的生长发育和新陈代谢, 不同植物根系对重金属的富集能力自然不同, 这一结论与夏汉平等[30]研究的香根草(Vetiveria zizanioides L.)和百喜草(Paspalum notatum Flugge)对铅锌尾矿的抗性研究相似。3种牧草在各重金属浓度下的生物量明显不同, 牧草之间受重金属影响的程度亦不一样, 这可以从它们的生物量抗性指数中反映出来。它能较好地反映植物对重金属的抗性, 指数越高, 表明该植物的生物量所受的影响越小, 对重金属的抗性也就越强。从3种牧草对Cu-Pb复合污染土壤的抗性上可见, 狼尾草可用于Cu或Cu-Pb复合污染地的土壤固定和植被修复, 紫花苜蓿可用于Pb污染地的土壤固定和植被修复。在Cu-Pb复合污染的各浓度水平下, 牧草植物的生物量有所降低, 根系的生长发育受到抑制, 且浓度越高, 抑制作用越明显, 由此可知Cu-Pb复合污染比单一污染具有更高的毒性, 这与赵杨迪等[31]的结论相似。
Cu是植物生长必需的微量元素之一, 能够影响氧化还原过程, 并且参与光合作用的电子传递体系[32]。Cu能促进植物的生长发育, 但达到一定浓度并超过此界限时, 重金属Cu对植物根系的毒害作用必然会抑制植物的生长发育, 而Cu对植物根系的毒害作用是通过抑制根细胞分裂、根活力等造成的。对于Pb的富集, 3种植物在各浓度处理组都表现为根部大于地上部分, 这可能是因为Pb在根系主要以Pb3(PO4)2和PbCO3等沉淀形式存在, 在植物汁液中的离子态和络合态Pb, 由于吸收、钝化或沉淀作用, 向地上部运输困难[33]。贾玉华等[34]研究天竺葵(Pelargonium hortorum Bailey)在Pb污染土壤中对Pb的吸收和体内分布规律时, 发现大部分Pb积累在天竺葵的根部。也有试验证明在Pb污染环境下大部分Pb富集于红薯[Ipomoea batatas (L.) Lam.]根部[35]。本研究所得的结果与此一致, 由于植物吸收的重金属大部分积累在根部, 从而减轻了地上部分各器官的毒害作用。另外, 试验结果还表明, Cu-Pb复合处理在一定程度上促进了牧草植物对Cu、Pb的吸收, 这说明复合重金属土壤处理下两种重金属在牧草植物体内的积累具有协同作用。这一结论和李凡等[36]用Cu、Pb单一及复合处理玉米(Zea mays L.)幼苗体内Cu、Pb积累的结果相似。重金属元素之间的相互作用表现得很复杂, 这种相互作用效应又和多种因素相关, 因此具体机理还有待研究。
富集系数是反映植物对重金属富集特征的物理量, 用来评价植物将重金属吸收转移到其体内能力的大小。该研究结果显示, 因为Cu具有相对较高的生物活性, 并且3种牧草在复合污染条件下对Cu具有较高的耐性, 因此相对于Cu, Pb在牧草体内的富集能力较低。Pb在土壤中很难移动, 因为Pb主要以化学吸附为主, 生成稳定的络合物, 从而使其难以迁移, 起到对重金属的排斥作用。林大松等[37]在Cu-Pb复合污染条件下对小白菜(Brassica campestris L.)的研究得出相似的结论。转移系数是用来反映植物将重金属从根部向地上部转移富集的能力。转移系数越大, 重金属从根部向地上部的转运能力越强。紫花苜蓿对于Cu单一及Cu-Pb复合污染土壤具有较好的修复效果, 3种牧草中除了Pb1和Cu2Pb2处理组, Pb的转运系数小于1, 这与叶春和[21]对重金属“积累量M根 > M地上”的研究结果一致。紫花苜蓿对比黑麦草和狼尾草, 对Cu-Pb复合污染土壤中Pb具有富集潜力。植物对重金属Cu、Pb的富集能力和转运能力决定了相应污染土壤种类的修复。
4 结论从抗性系数上看, Cu单一及Cu-Pb复合污染中高浓度Cu污染条件下狼尾草的抗性系数最大, 狼尾草对单一Cu污染及Cu-Pb复合污染中高浓度Cu污染土壤具有最好的修复效果, 紫花苜蓿对Pb的抗性系数最大, 紫花苜蓿对单一Pb污染土壤具有最好的修复效果。
紫花苜蓿在Cu-Pb复合污染条件下地上部分对Cu、Pb的富集能力高于黑麦草和狼尾草, 黑麦草在Cu-Pb复合污染条件下根部对Cu、Pb的富集能力高于紫花苜蓿和狼尾草。
黑麦草虽富集能力不突出, 但易种植, 对Cu、Pb单一及Cu-Pb复合土壤仍有一定的改善作用, 可以作为Pb单一污染土壤的修复植物; 紫花苜蓿对土壤Cu-Pb污染综合富集能力最强, 可以考虑作为Cu单一或者是Cu-Pb污染土壤的修复植物; 狼尾草对Cu、Pb的耐受性相对较差, 不适合进行Cu-Pb复合污染土壤的修复。
| [1] |
何兰兰, 角媛梅, 王李鸿, 等.
Pb、Zu、Cu和Cd的超富集植物研究进展[J]. 环境科学与技术, 2009, 32(11): 120–123.
HE L L, JIAO Y M, WANG L H, et al. Advance in study of Pb, Zn, Cu and Cd hyperaccumulators[J]. Environmental Science & Technology, 2009, 32(11): 120–123. DOI:10.3969/j.issn.1003-6504.2009.11.028 |
| [2] |
王玉婷, 吕梦园, 韩新燕.
宁波地区不同规模猪场粪便中重金属含量分析[J]. 家畜生态学报, 2016, 37(3): 55–58.
WANG Y T, LYU M Y, HAN X Y. Content analysis of heavy metals in manure samples from different scales of pig farms in Ningbo City[J]. Acta Ecologae Animalis Domastici, 2016, 37(3): 55–58. |
| [3] |
张国军, 江虹, 郑丽芹, 等.
Cu胁迫对脐橙幼苗光合特性的影响[J]. 中国生态农业学报, 2009, 17(1): 130–134.
ZHANG G J, JIANG H, ZHENG L Q, et al. Effect of copper stress on photosynthesis of navel orange seedlings[J]. Chinese Journal of Eco-Agriculture, 2009, 17(1): 130–134. |
| [4] |
齐雪梅, 李培军, 刘宛.
Cu胁迫对大麦幼苗生长及DNA损伤效应的研究[J]. 农业环境科学学报, 2008, 27(5): 1925–1928.
QI X M, LI P J, LIU W. Plantlets growth and DNA damage of barley (Hordeum vulgare L) under copper stress[J]. Journal of Agro-Environment Science, 2008, 27(5): 1925–1928. |
| [5] |
赵艳, 徐迎春, 吴晓丽, 等.
Cu胁迫对狭叶香蒲体内元素吸收分配的影响[J]. 生态学杂志, 2009, 28(4): 665–670.
ZHAO Y, XU Y C, WU X L, et al. Element absorption and distribution in Typha angustifolia under Cu stress[J]. Chinese Journal of Ecology, 2009, 28(4): 665–670. |
| [6] |
张开明, 佟海英, 黄苏珍, 等.
Cu胁迫对黄菖蒲和马蔺Cu富集及其他营养元素吸收的影响[J]. 植物资源与环境学报, 2007, 16(1): 18–22.
ZHANG K M, TONG H Y, HUANG S Z, et al. Effect of Cu stress on Cu accumulation and other nutrient element absorption of Iris pseudacaorus and I. lactea var. chinensis[J]. Journal of Plant Resources and Environment, 2007, 16(1): 18–22. |
| [7] |
邱栋梁, 张国军, 余东, 等.
Cu胁迫对柑桔叶片膜透性及酶活性的影响[J]. 农业环境科学学报, 2007, 26(3): 1008–1013.
QIU D L, ZHANG G J, YU D, et al. Effects of copper stress on permeability of plasma membrane and activity of enzyme in citrus leaves[J]. Journal of Agro-Environment Science, 2007, 26(3): 1008–1013. |
| [8] |
吴秋玲, 王文初, 何闪英.
GA3与EDTA强化黑麦草修复Pb污染土壤及其解毒机制[J]. 应用生态学报, 2014, 25(10): 2999–3005.
WU Q L, WANG W C, HE S Y. Enhancement of GA3 and EDTA on Lolium perenne to remediate Pb contaminated soil, and its detoxification mechanism[J]. Chinese Journal of Applied Ecology, 2014, 25(10): 2999–3005. |
| [9] |
美英, 杨晓华, 张鹏.
植物滞留系统草本植物对人工雨水中铜的富集及去除效果研究[J]. 内蒙古大学学报:自然科学版, 2015, 46(2): 204–210.
MEI Y, YANG X H, ZHANG P. Study on bioaccumulation and removal of copper by grasses in bioretention system[J]. Journal of Inner Mongolia University:Natural Science Edition, 2015, 46(2): 204–210. |
| [10] |
闵九康.
土壤酶活性及其意义[M]. 北京: 中国农业科学院土壤肥料研究所, 1987: 48-63.
MIN J K. Soil Enzyme Activity and Its Significance[M]. Beijing: Soil and Fertilizer Institute, Chinese Academy of Agricultural Sciences, 1987: 48-63. |
| [11] | CHINO M. Uptake-transport of toxic metals in rice plants[M]//KITAGISHI K, YAMANE I. Heavy Metal Pollution in Soils of Japan. Tokyo: Japan Scientific Press, 1981: 1141-1146 |
| [12] | WITZEL B. The influence of zinc on the uptake and loss of cadmium and lead in the woodlouse, Porcellio scaber (Isopoda, Oniscidea)[J]. Ecotoxicology and Environmental Safety, 2000, 47(1): 43–53. DOI:10.1006/eesa.2000.1940 |
| [13] | KIM D S. The removal by crab shell of mixed heavy metal ions in aqueous solution[J]. Bioresource Technology, 2003, 87(3): 355–357. DOI:10.1016/S0960-8524(02)00259-6 |
| [14] |
李华娟, 汤洁, 张楠, 等.
不同植物对煤矿废弃地土壤重金属富集转化规律[J]. 湖北农业科学, 2014, 53(16): 3784–3787.
LI H J, TANG J, ZHANG N, et al. Accumulation and transformation of soil heavy metals in different plants of abandon coal mine[J]. Hubei Agricultural Sciences, 2014, 53(16): 3784–3787. DOI:10.3969/j.issn.0439-8114.2014.16.015 |
| [15] |
李红霞, 马伟芳, 赵新华.
浅述利用植物对受污染土壤中重金属的修复[J]. 吉林农业科学, 2007, 32(1): 35–39.
LI H X, MA W F, ZHAO X H. The prospect of studies on the phytoremediation of heavy metal contamination in soil[J]. Journal of Jilin Agricultural Sciences, 2007, 32(1): 35–39. |
| [16] |
李松克, 张春林, 李克勤, 等.
多年生黑麦草对黄壤重金属污染的修复[J]. 贵州农业科学, 2014, 42(11): 147–151.
LI S K, ZHANG C L, LI K Q, et al. Repairation of Lolium perenne on yellow soil heavy metal pollution[J]. Guizhou Agricultural Sciences, 2014, 42(11): 147–151. DOI:10.3969/j.issn.1001-3601.2014.11.038 |
| [17] |
杨海菊.
农作物富集土壤重金属的规律及其运用[J]. 绿色科技, 2011(4): 162–164.
YANG H J. Regularity and application of heavy metal enriched by crops from soil[J]. Journal of Green Science and Technology, 2011(4): 162–164. |
| [18] |
黄永东, 黄永川, 于官平, 等.
蔬菜对重金属元素的吸收和积累研究进展[J]. 长江蔬菜, 2011(10): 1–6.
HUANG Y D, HUANG Y C, YU G P, et al. Progress of absorption and accumulation of heavy metal in vegetables[J]. Journal of Changjiang Vegetables, 2011(10): 1–6. DOI:10.3865/j.issn.1001-3547.2011.10.001 |
| [19] |
铁柏清, 袁敏, 唐美珍, 等.
Cd、Pb、Cu、Zn、As复合污染对龙须草生长的影响[J]. 土壤通报, 2005, 36(2): 286–288.
TIE B Q, YUAN M, TANG M Z, et al. Effects of compound pollution of Cd, Pb, Cu, Zn and As on the growth of Eulaliopsis binata[J]. Chinese Journal of Soil Science, 2005, 36(2): 286–288. |
| [20] |
张杏锋, 夏汉平, 李志安, 等.
牧草对重金属污染土壤的植物修复综述[J]. 生态学杂志, 2009, 28(8): 1640–1646.
ZHANG X F, XIA H P, LI Z A, et al. Forage grass in phytoremediation of heavy metals-contaminated soils:A review[J]. Chinese Journal of Ecology, 2009, 28(8): 1640–1646. |
| [21] |
叶春和.
紫花苜蓿对铅污染土壤修复能力及其机理的研究[J]. 土壤与环境, 2002, 11(4): 331–334.
YE C H. Phytoremediation of Pb-contaminated soil with alfalfa:Capacity and mechanisms[J]. Soil and Environmental Sciences, 2002, 11(4): 331–334. |
| [22] |
徐卫红, 王宏信, 王正银, 等.
重金属富集植物黑麦草对锌、镉复合污染的响应[J]. 中国农学通报, 2006, 22(6): 365–368.
XU W H, WANG H X, WANG Z Y, et al. Response of hyperaccumulator ryegrass (Loliurn perenne L.) to cadmium, zinc and their combined pollution[J]. Chinese Agricultural Science Bulletin, 2006, 22(6): 365–368. |
| [23] |
杨强, 林琦, 王兆炜, 等.
重金属污染土壤H2O2预处理的植物修复技术研究[J]. 浙江大学学报:农业与生命科学版, 2005, 31(3): 315–320.
YANG Q, LIN Q, WANG Z W, et al. Study on phytoremediation with H2O2 pretreatment in heavy metal contaminated soils[J]. Journal of Zhejiang University:Agriculture & Life Sciences, 2005, 31(3): 315–320. |
| [24] |
胡金朝. 重金属污染对不同生境水生植物的毒害机理研究[D]. 南京: 南京师范大学, 2006: 27-30
HU J C. The toxic mechanism study of heavy metal pollution on aquatic plant under different growth conditions[D]. Nanjing: Nanjing Normal University, 2006: 27-30 |
| [25] |
高伟, 归静, 刘娟, 等.
重金属Cd、Cu以及干旱胁迫对柳枝稷的影响分析[J]. 家畜生态学报, 2016, 37(9): 65–70.
GAO W, GUI J, LIU J, et al. Effects of Cd, Cu and drought on switchgrass (Panicum virgatum L.)[J]. Acta Ecologae Animalis Domastici, 2016, 37(9): 65–70. |
| [26] |
侯新村, 范希峰, 武菊英, 等.
草本能源植物修复重金属污染土壤的潜力[J]. 中国草地学报, 2012, 34(1): 59–64.
HOU X C, FAN X F, WU J Y, et al. Potentiality of herbaceous bioenergy plants in remediation of soil contaminated by heavy metals[J]. Chinese Journal of Grassland, 2012, 34(1): 59–64. |
| [27] |
黄淑萍, 陈爱侠, 常亚飞, 等.
皂河湿地植物对多种重金属污染湿地的修复研究[J]. 环境工程, 2016, 34(6): 177–181.
HUANG S P, CHEN A X, CHANG Y F, et al. Phytoremediation on wetland in Zaohe river watershed contaminated with multi heavy metals[J]. Environmental Engineering, 2016, 34(6): 177–181. |
| [28] | MATTINA M I, LANNUCCI-BERGER W, MUSANTE C, et al. Concurrent plant uptake of heavy metals and persistent organic pollutants from soil[J]. Environmental Pollution, 2003, 124(3): 375–378. DOI:10.1016/S0269-7491(03)00060-5 |
| [29] |
林云青, 章钢娅, 许敏, 等.
添加凹凸棒土和钠基蒙脱石对铜锌镉污染红壤的改良效应研究[J]. 土壤, 2009, 41(6): 892–896.
LIN Y Q, ZHANG G Y, XU M, et al. Studies on modified effects of attapulgite and Na-montmorillonite on Cu-Zn-Cd contaminated red soil[J]. Soils, 2009, 41(6): 892–896. |
| [30] |
夏汉平, 束文圣.
香根草和百喜草对铅锌尾矿重金属的抗性与吸收差异研究[J]. 生态学报, 2001, 21(7): 1121–1129.
XIA H P, SHU W S. Resistance to and uptake of heavy metals by Vetiveria zizanioides and Paspalum notatum from lead/zinc mine tailings[J]. Acta Ecologica Sinica, 2001, 21(7): 1121–1129. |
| [31] |
赵杨迪, 潘远智, 刘碧英, 等.
Cd、Pb单一及复合污染对花叶冷水花生长的影响及其积累特性研究[J]. 农业环境科学学报, 2012, 31(1): 48–53.
ZHAO Y D, PAN Y Z, LIU B Y, et al. Pilea cadierei Gagnep. et Guill's growth and accumulation under single and combined pollution of Cd and Pb[J]. Journal of Agro-Environment Science, 2012, 31(1): 48–53. |
| [32] |
潘瑞炽, 董愚得.
植物生理学[M]. 第3版. 北京: 高等教育出版社, 1995: 31-34.
PAN R C, DONG Y D. Plant Physiology[M]. 3rd ed. Beijing: Higher Education Press, 1995: 31-34. |
| [33] |
刘秀梅, 聂俊华, 王庆仁.
6种植物对Pb的吸收与耐性研究[J]. 植物生态学报, 2002, 26(5): 533–537.
LIU X M, NIE J H, WANG Q R. Research on lead uptake and tolerance in six plants[J]. Acta Phytoecologica Sinica, 2002, 26(5): 533–537. |
| [34] |
贾玉华, 朱建雯, 钱翌, 等.
天竺葵对土壤中铅的吸收和耐性研究[J]. 新疆农业大学学报, 2008, 31(4): 38–40.
JIA Y H, ZHU J W, QIAN Y, et al. Studies on accumulation and tolerance of Pelargonium horlarum to Pb in the Soil[J]. Journal of Xinjiang Agricultural University, 2008, 31(4): 38–40. |
| [35] |
寇士伟, 吴锦标, 谢素, 等.
红薯对Pb、Cd的吸收累积特征及根际土壤Pb、Cd形态分布研究[J]. 农业环境科学学报, 2011, 30(4): 677–683.
KOU S W, WU J B, XIE S, et al. Absorption and accumulation of Pb and Cd in sweet potato and species distribution of Pb and Cd in rhizosphere soil[J]. Journal of Agro-Environment Science, 2011, 30(4): 677–683. |
| [36] |
李凡, 张义贤.
单一及复合污染下铅铜在玉米幼苗体内积累与迁移的动态变化[J]. 农业环境科学学报, 2010, 29(1): 19–24.
LI F, ZHANG Y X. Dynamics of accumulation and distribution of Cu, Pb in Zea mays L. seedlings under single or combined pollution of Cu and Pb[J]. Journal of Agro-Environment Science, 2010, 29(1): 19–24. |
| [37] |
林大松, 徐应明, 孙国红, 等.
土壤重金属污染复合效应对小白菜生长及重金属累积的影响[J]. 农业环境科学学报, 2006, 25(S1): 72–75.
LIN D S, XU Y M, SUN G H, et al. Combined effects and bioaccumulation of heavy metals in pakchoi grown in polluted soil[J]. Journal of Agro-Environment Science, 2006, 25(S1): 72–75. |
 2018, Vol. 26
2018, Vol. 26



