2. 中国农业大学植物保护学院 北京 100193;
3. 中国农业大学生物多样性与有机农业北京市重点实验室 北京 100193
2. College of Plant Protection, China Agricultural University, Beijing 100193, China;
3. Beijing Key Laboratory of Biodiversity and Organic Farming, China Agricultural University, Beijing 100193, China
传粉是重要的生态系统服务之一, 自然界中87.5%的被子植物[1]和全球约75%的农作物[2]都不同程度地依赖于传粉动物进行有性生殖以形成种子和果实。因此, 传粉动物多样性是维持植物遗传多样性、全球粮食安全和人类福祉的保障[3]。
蜜蜂总科的传粉昆虫是主要的传粉者[2, 4]。有研究显示野生蜂多样性与传粉服务正相关[5-6], 其机制可能与野生蜂功能性生态位的互补有关, 如访花天气条件和访花植物[7]、访花高度[6]、生活方式[8-9]、与扩散能力相关的体长[10-11]等, 使其对生境和资源的需求[9, 12-13]以及传粉效率[14-15]存在差异, 从而影响传粉服务的提供。具有同种功能特征的野生蜂功能群, 较高的物种多样性为生态系统功能抵御外界不利的环境变化提供了缓冲和保险[16], 不同特征功能群的野生蜂能通过生态位的转移利用互补资源[6, 15]。因此, 野生蜂功能群的多样性可能与传粉服务更相关, 尤其是与传粉服务相关的功能特征, 是传粉服务更好的预测因子[6, 15]。所以, 在研究野生蜂多样性与生境类型或传粉服务之间的关系时, 需要充分考虑不同野生蜂群落的功能特征组成情况。
近年来, 景观简化和自然生境丧失[17-18], 再加上其他因素的变化, 如气候变化、外来物种的入侵和疾病等[19], 导致野生蜂和饲养蜜蜂均出现不同程度地下降[20-22], 使与此相关的传粉服务的丧失日益严重[18, 23], 从而影响农业的可持续发展。
目前, 虽然野生蜂多样性的下降得到了国内外的较多关注, 但多数研究只侧重于对农作物有重要经济价值的个别蜂物种, 很少关注自然半自然生境和其他野生蜂物种。在集约化的农业景观中, 单一的农田生境不能满足野生蜂所有的资源需求, 不同生境中具有物候学特征多样化的植被, 野生蜂可利用资源也在数量上和多样性上随时间发生显著变化[17]。因此, 多样化的生境类型能在时间和空间尺度上为野生蜂提供持续的资源, 这种农田-半自然生境互补机制是促使野生蜂在破碎化景观中得以续存的一种机制[10, 24-25], 并塑造了它们在农业景观中的时空分布格局[26]。
目前鲜有关于传粉昆虫及其功能群在农田-半自然景观镶嵌体中利用资源的时空动态信息[2], 缺乏关于传粉昆虫在农业景观不同生境中随时间变化的分布格局和促使这些物种在农业景观中续存以及形成它们多样性特征的机制研究[27], 更缺乏相应的监测网络和特定的保护措施[28-29]。因此, 迫切需要大量的传粉蜂多样性调查工作, 以深入了解野生蜂多样性在时间和空间尺度上的分布规律, 认识物种与其生境需求关系, 从而制定更科学的野生蜂保护战略[30]。本研究通过调查分析北京市昌平区农业景观中野生蜂多样性及其功能群在农业景观中的时空变化特征, 为该地区野生蜂的保护提供研究基础。
1 材料与方法 1.1 研究区概况研究区位于北京市昌平区(40°2′~40°23′N, 115°50′~116°29′E), 该区地处太行山、燕山和华北平原的交汇处, 海拔约30~1 000 m, 属温带大陆性季风气候, 春季干旱多风, 夏季高温多雨, 年平均日照时数约2 600 h, 年平均气温约12 ℃, 年降水量约550 mm。昌平西北部为山区, 多为自然灌木林和乔灌混合林; 东南部为平原区, 盛产水果, 主要有苹果(Malus pumila)、桃(Amygdalus persica)和草莓(Fragaria×ananassa)等, 且自2012年起开展了大规模的平原造林工程。根据昌平区2015年的遥感影像解译和景观分类结果可知, 昌平区的主要生境类型及其所占面积比例分别为自然林(47.6%)、人工林(11.8%)、果园(7.18%)、荒草地(2.8%)和非生境(29.22%)等(图 1)。
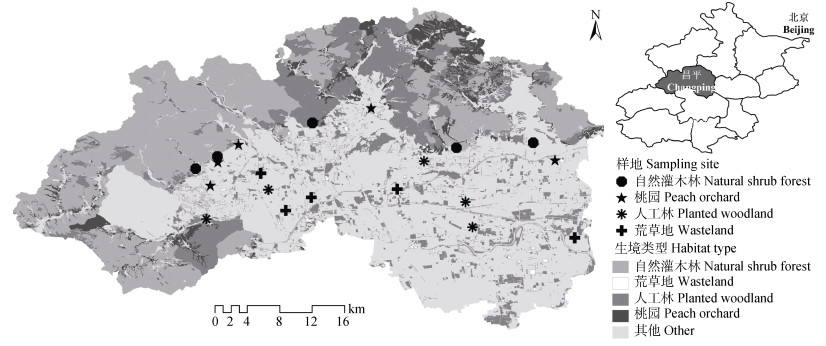
|
图 1 研究区生境类型及样地分布图 Figure 1 Distribution of habitats and sampling sites in the study area |
2016年, 在该研究区选择4种生境类型, 包括自然灌木林(山区自然生境)、人工林(平原区半自然生境)和荒草地(平原区半自然生境)以及桃园(平原区人工生境), 每种生境5个样地(图 1), 海拔范围为32~257 m, 相邻样地间距大于2 000 m(自然灌木林和桃园的两个样地除外, 二者间距为1 482 m)。每个样地设置3条50 m×3 m的平行样带, 相邻样带间距10 m。在4—9月的每月23—28日, 依次在各样地用网捕法采集出现在样带中的蜜蜂总科的野生蜂(盗寄生蜂除外)[31], 每月各样地野生蜂的调查顺序依据各样地的地理位置顺序在4—5 d内完成, 每个样地每月取样1次, 每次采集30 min(取样时, 收标本的过程不计时)。将野生蜂标本装入酒精瓶中带回实验室, 制作成针插标本后请分类学专家将其鉴定到物种。野生蜂的取样时间和天气要求: 8:30—17:30, 天气晴朗或微云, 气温不低于18 ℃, 风速小于3 m×s-1[32]。
1.3 数据处理将野生蜂物种按体长和生活方式分别划分功能群。小、中、大体长野生蜂的体长(L)范围分别为: L≤ 7.5 mm、7.5 mm<L≤11.5 mm和L>11.5 mm[33]。生活方式包括社会性(初级真社会性)和独居性[34]。鉴于盗寄生蜂不筑巢不贮粮, 传粉效率低, 因此不作为本试验的研究对象。
在DPS软件中[35], 根据野生蜂多样性数据是否服从正态性分布, 选择单因素试验统计分析或非参数检验, 分析不同生境中野生蜂的物种数和个体数差异。
2 结果与分析 2.1 不同生境中野生蜂群落组成2016年4—9月, 在北京昌平农业景观中共采集到6科21属61种378头野生蜂(表 1), 其中淡脉隧蜂属(Lasioglossum)物种数最多, 包括13个物种71头, 物种数和个体数占比分别为21.31%和18.78%;其次为地蜂属(Andrena), 包括8个物种29头, 物种数和个体数占比分别为13.11%和7.67%。隧蜂属个体数最多(78头), 占总个体数的20.63%。
| 表1 不同生境中野生蜂组成及分布 Table 1 Composition and distribution of wild bees in different habitats |
不同生境类型中野生蜂优势种存在差异, 自然灌木林为黄胸彩带蜂(N. thoracica), 人工林和荒草地为铜色隧蜂(H. aerarius), 而桃园无优势种。自然灌木林和荒草地中特有种最多, 均为11个, 桃园和人工林分别有4个和2个特有种。自然灌木林中野生蜂的物种数(F=4.124, P=0.024 1)和个体数(t=3.406 3, P=0.003 6)最高, 桃园最低, 人工林和荒草地居中, 且二者无显著差异(图 2)。
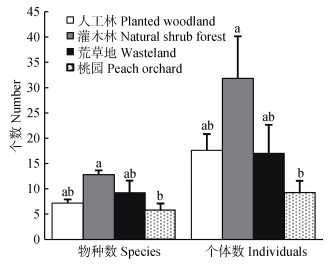
|
图 2 不同生境中野生蜂物种数和个体数的比较 Figure 2 Species richness and individual numbers of wild bees in different habitats 不同小写字母表示差异显著(P<0.05)。 Different lowercase letters mean significant differences at 0.05 level. |
不同功能群野生蜂在生境间的物种数和个体数存在差异(图 3), 就物种数而言, 中体长野生蜂、大体长野生蜂和独居蜂的物种数在自然灌木林中最高, 其他功能群的物种数在生境间无显著差异。就个体数而言, 中体长野生蜂和独居蜂的个体数在自然灌木林中最高; 小体长野生蜂物种数在人工林中最高, 在桃园中最低; 大体长野生蜂个体数在自然灌木林中最高, 在人工林中最低。

|
图 3 不同生境中各野生蜂功能群物种数和个体数的比较 Figure 3 Species richness and individual numbers of different wild bee functional groups in different habitats |
除荒草地以外, 其他生境野生蜂总物种数和总个体数在4—8月整体上呈现相似的趋势(图 4), 4—5月下降, 5—8月先上升后下降, 出现了两个峰值。在荒草地中, 野生蜂物种数和个体数先上升, 7月份达到最大值后下降, 出现了1个峰值。

|
图 4 不同生境中野生蜂及其不同功能群物种数和个体数的时间动态 Figure 4 Temporal dynamics of species richness and individual numbers of wild bees and their functional groups in different habitats |
不同功能群野生蜂多样性在生境类型间的时间变化不一致。小体长蜂个体数在8月人工林中最高, 9月只在人工林中有分布; 物种数在6、7月荒草地中最高, 且个体数和物种数在5月桃园中最低。中体长蜂物种数在7月自然灌木林中最高, 在5月桃园中最低; 个体数在6月自然灌木林中最高, 在5月桃园中最低。大体长蜂物种数在6、7、9月的自然灌木林, 4、8月的荒草地和7月桃园中最高; 个体数在4、8月的荒草地中最高, 且物种数和个体数均在4、5、8月的人工林和桃园以及5月荒草地中最低。社会性蜂物种数在6月荒草地和7月人工林中最高, 个体数在7月人工林中最高, 且个体数和物种数均在5、9月的桃园中最低。独居蜂物种数和个体数分别在自然灌木林7月和6月中最高, 且均在5月桃园中最低。
2.3 不同野生蜂物种在不同生境中的时空分布格局个体数最多的4个野生蜂物种依次为黄胸彩带蜂(N. thoracica)、铜色隧蜂(H. aerarius)、黄芦蜂(C. flavipes)和隧淡脉隧蜂(L. halictoides)。这4种野生蜂的时空分布特征不同(图 5), 黄胸彩带蜂和黄芦蜂分布于除荒草地以外的其他生境, 且前者在6—8月活动, 而后者在整个取样季均有活动; 铜色隧蜂和隧淡脉隧蜂在四种生境中均有分布, 前者在5—9月活动, 而后者的活动期为4—7月。
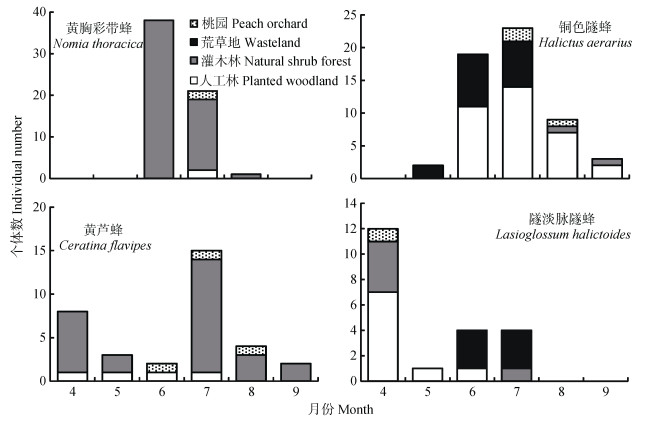
|
图 5 多度最大的4个野生蜂物种在不同生境中的时间动态 Figure 5 Temporal dynamics of four wild bee species with the highest abundance in different habitats |
自然灌木林中野生蜂的总物种数和总个体数最高, 均显著高于桃园(最低)。自然灌木林位于山区, 灌草物种丰富, 有高质量的蜜源植物, 如荆条(Vitex negundo var. heterophylla)等多年生开花植被[36], 还有较多裸露的、向阳的土地, 人为干扰小, 能为野生蜂提供较好的觅食资源和筑巢地点, 尤其是能量需求高的较大体长野生蜂和独居蜂[37-38]。与小体长野生蜂相比, 体长较大的野生蜂有更大的体表面积和翅膀, 拥有较高的飞行能力[11, 39]和传粉效率[14]。因此, 在该地区, 就野生蜂多样性维持和传粉服务潜在供给而言, 自然灌木林有重要的保护价值。
人工林中虽然没有丰富的高质量的多年生灌草物种, 但能满足能量需求小的小体长野生蜂[37-38]。荒草地虽然也具有较丰富的草本植物, 但其在研究区总面积和斑块面积小, 易受人为干扰。因此, 与人工林相比, 小体长蜂在荒草地中的多样性较低。桃园地表草本植物常年遭受灌溉、翻地、农药等农业活动的干扰和毒害, 仅在果树花期提供短暂但大面积的觅食资源, 如果农业活动管理得当, 如花期不打农药, 花后保留适当的地表开花植被, 则能为野生蜂提供更好的觅食资源[40-41]。
虽然不同生境的适宜性和资源可利用性差异较大, 但由于不同生境具有不同的开花植物物种, 本研究4种生境均有特有种, 且自然灌木林和荒草地中的特有种物种数最多。因此, 维持生境类型的多样性以及生境内植被的多样性, 有助于保护生境特有种和野生蜂多样性。
在自然灌木林、人工林和桃园生境中, 野生蜂总的物种数和个体数均在4月、6月或7月出现两个较明显的峰值, 主要原因可能为: 1)本研究区为昌平果园种植区, 且果树多在4月开花, 为野生蜂提供了较充足的觅食资源, 导致野生蜂多样性在4月高于5月; 2)中国北方野生蜂主要为一年1代的春季种类、夏季初秋种类和一年多代物种[42], 而北京4月和5月属于春季, 6—9月属于夏季初秋, 与不同类群野生蜂的年生活周期一致。荒草地中野生蜂的总物种数和总个体数的时间动态趋势呈单峰型, 可能与其优势种铜色隧蜂的活跃活动期在6月、7月有关。
虽然不同功能群野生蜂的多样性在生境类型间的时间动态特征存在差异, 但整体上在自然半自然生境中最高, 说明自然半自然生境在时间和空间尺度上均为野生蜂提供了较好的资源。但在桃园, 桃树(A. persica)落花后集约化的管理强度高, 降低了桃园中觅食资源的可利用性, 导致各功能群野生蜂物种数和个体数均在5月最低。但果园周围其他自然半自然生境能为不同功能群野生蜂提供替补资源, 从而使其在农业景观中得以续存。因此, 为了提高5月野生蜂多样性及其潜在的传粉服务, 建议在大面积连片种植果园的区域, 适当保留果园和农田边界中的地表杂草, 杜绝施用对野生蜂危害较大的农药和除草剂, 从而为不同功能群野生蜂的续存提供替代的觅食资源, 同时保护果园周围的自然半自然生境, 在时空尺度上为野生蜂提供持续的可利用资源。
3.2 不同物种的时空分布格局多度最大的4种野生蜂的时空分布特征不同。黄胸彩带蜂和黄芦蜂的生境分布相同, 但活动期不同, 这可能与不同类群的生活周期有关, 如有研究发现彩带蜂属于一年1代物种, 夏季初秋为其大量活动期[42], 而芦蜂属的温带物种活动期较长, 可能整年都在活动[43]。铜色隧蜂和隧淡脉隧蜂在4种生境中均有分布, 但二者的活动期也不相同, 原因可能与隧蜂属的年生活史复杂多样有关, 随蜂属的不同物种和同一物种不同地理种群的生活方式和年生活史变化较大, 有一年1代、两代或多代物种[44]。因此, 可以推测铜色隧蜂在该地区可能为一年1代物种, 活动高峰期为6—7月。而淡脉隧蜂的生活周期也较复杂多样[45], 隧淡脉隧蜂在该地区的活动期为春夏季。
在野生蜂生活史的相同或不同时期, 野生蜂会在多种生境间转移, 主要原因可能是生境间的开花植被多样性及其物候学特征(如花期)存在差异, 导致不同生境的觅食资源在数量和多样性上随时间显著变化[17], 这种生境间的互补机制使野生蜂在破碎化的景观中得以续存[10, 24], 因此塑造了它们在农业景观中的时空分布格局[26]。
本研究中3个野生蜂优势种在生境间的分布特征与前人记录其访花植物的文献大体一致, 文献记录黄芦蜂访花植物为荆条、苦荬菜(Ixeris polycephala)、蒿子(Artemisia selengensis)、鸡冠花(Celosia cristata)[42], 铜色隧蜂的访花植物为荆条、月季(Rosa chinensis)、三叶草(Trifolium repens)、蜀葵(Alcea rosea)、山兰(Oreorchis patens)、苦菜(Sonchus oleraceus)和黄刺玫(Rosa xanthina)[44], 黄胸彩带蜂访花植物为荆条、蔷薇(Rosa sp.)、木槿(Hibiscus syriacus)、菊花(Dendranthema morifolium)和玉米(Zea mays)[46]。文献记录隧淡脉隧蜂的访花植物为桃[45], 而本研究发现除桃园外, 隧淡脉隧蜂还在人工林、荒草地和自然灌木林中有分布, 考虑到隧淡脉隧蜂为地下筑巢者, 这3种自然半自然生境究竟为该物种提供了筑巢地点还是其他植物的觅食资源, 有待于进一步研究。
4 结论在北京昌平区, 不同功能群野生蜂在果园和自然半自然生境中均有分布, 但在不同生境和不同月份的分布特征不同。因此, 无论是果园还是自然半自然生境, 均对野生蜂多样性的维持扮演了重要作用, 但由于各野生蜂物种和功能特征、植被结构、筑巢资源的适宜性和局部管理等因素的差异, 自然半自然生境, 尤其是自然灌木林, 对野生蜂多样性的维持作用更大。因此, 为了在该地区农业景观中维持更丰富的野生蜂资源及其提供的高质量传粉服务, 不仅需要保护和提高生境多样性, 还需在生境管理过程中降低集约化程度。
| [1] | OLLERTON J, WINFREE R, TARRANT S. How many flowering plants are pollinated by animals?[J]. Oikos, 2011, 120(3): 321–326. DOI:10.1111/more.2010.120.issue-3 |
| [2] | KLEIN A M, VAISSIÈRE B E, CANE J H, et al. Importance of pollinators in changing landscapes for world crops[J]. Proceedings of the Royal Society B:Biological Sciences, 2007, 274(1608): 303–313. DOI:10.1098/rspb.2006.3721 |
| [3] |
戴漂漂, 张旭珠, 刘云慧. 传粉动物多样性的保护与农业景观传粉服务的提升[J]. 生物多样性, 2015, 23(3): 408–418.
DAI P P, ZHANG X Z, LIU Y H. Conserving pollinator di-versity and improving pollination services in agricultural landscapes[J]. Biodiversity Science, 2015, 23(3): 408–418. DOI:10.17520/biods.2014248 |
| [4] |
安建东, 陈文锋. 中国水果和蔬菜昆虫授粉的经济价值评估[J]. 昆虫学报, 2011, 54(4): 443–450.
AN J D, CHEN W F. Economic value of insect pollination for fruits and vegetables in China[J]. Acta Entomologica Sinica, 2011, 54(4): 443–450. |
| [5] | KREMEN C, WILLIAMS N M, THORP R W. Crop pollination from native bees at risk from agricultural intensification[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(26): 16812–16816. DOI:10.1073/pnas.262413599 |
| [6] | HOEHN P, TSCHARNTKE T, TYLIANAKIS J M, et al. Functional group diversity of bee pollinators increases crop yield[J]. Proceedings of the Royal Society B:Biological Sci-ences, 2008, 275(1648): 2283–2291. DOI:10.1098/rspb.2008.0405 |
| [7] | BLÜTHGEN N, KLEIN A M. Functional complementarity and specialisation:The role of biodiversity in plant-pollinator interactions[J]. Basic and Applied Ecology, 2011, 12(4): 282–291. DOI:10.1016/j.baae.2010.11.001 |
| [8] | JHA S, VANDERMEER J H. Contrasting bee foraging in re-sponse to resource scale and local habitat management[J]. Oikos, 2009, 118(8): 1174–1180. DOI:10.1111/oik.2009.118.issue-8 |
| [9] | JHA S, VANDERMEER J H. Impacts of coffee agroforestry management on tropical bee communities[J]. Biological Conservation, 2010, 143(6): 1423–1431. DOI:10.1016/j.biocon.2010.03.017 |
| [10] | CANE J H, MINCKLEY R L, KERVIN L J, et al. Complex responses within a desert bee guild (Hymenoptera:Apiformes) to urban habitat fragmentation[J]. Ecological Applications, 2006, 16(2): 632–644. DOI:10.1890/1051-0761(2006)016[0632:CRWADB]2.0.CO;2 |
| [11] | GREENLEAF S S, WILLIAMS N M, WINFREE R, et al. Bee foraging ranges and their relationship to body size[J]. Oeco-logia, 2007, 153(3): 589–596. DOI:10.1007/s00442-007-0752-9 |
| [12] | KLEIN A M, STEFFAN-DEWENTER I, TSCHARNTKE T. Pollination of Coffea canephora in relation to local and re-gional agroforestry management[J]. Journal of Applied Ecology, 2003, 40(5): 837–845. DOI:10.1046/j.1365-2664.2003.00847.x |
| [13] |
谢正华, Jonathan Teichroew, 安建东. 滇东南南瓜传粉昆虫密度对生境丧失的差异性响应[J]. 中国生态农业学报, 2017, 25(3): 337–344.
XIE Z H, TEICHROEW J, AN J D. Response of summer squash pollinator density to habitat loss in Southeast Yunnan, China[J]. Chinese Journal of Eco-Agriculture, 2017, 25(3): 337–344. |
| [14] | SAHLI H F, CONNER J K. Visitation, effectiveness, and ef-ficiency of 15 genera of visitors to wild radish, Raphanus raphanistrum (Brassicaceae)[J]. American Journal of Botany, 2007, 94(2): 203–209. DOI:10.3732/ajb.94.2.203 |
| [15] | FRÜND J, DORMANN C F, HOLZSCHUH A, et al. Bee di-versity effects on pollination depend on functional comple-mentarity and niche shifts[J]. Ecology, 2013, 94(9): 2042–2054. DOI:10.1890/12-1620.1 |
| [16] | WINFREE R, WILLIAMS N M, DUSHOFF J, et al. Native bees provide insurance against ongoing honey bee losses[J]. Ecology Letters, 2007, 10(11): 1105–1113. DOI:10.1111/ele.2007.10.issue-11 |
| [17] | TSCHARNTKE T, KLEIN A M, KRUESS A, et al. Landscape perspectives on agricultural intensification and biodi-versity-ecosystem service management[J]. Ecology Letters, 2005, 8(8): 857–874. DOI:10.1111/ele.2005.8.issue-8 |
| [18] | BOMMARCO R, KLEIJN D, POTTS S G. Ecological inten-sification:Harnessing ecosystem services for food security[J]. Trends in Ecology & Evolution, 2013, 28(4): 230–238. |
| [19] | VANBERGEN A J, INITIATIVE T I P. Threats to an eco-system service:Pressures on pollinators[J]. Frontiers in Ecology and the Environment, 2013, 11(5): 251–259. DOI:10.1890/120126 |
| [20] | COOK D C, THOMAS M B, CUNNINGHAM S A, et al. Predicting the economic impact of an invasive species on an ecosystem service[J]. Ecological Applications, 2007, 17(6): 1832–1840. DOI:10.1890/06-1632.1 |
| [21] | GENERSCH E. Honey bee pathology:Current threats to honey bees and beekeeping[J]. Applied Microbiology and Biotechnology, 2010, 87(1): 87–97. DOI:10.1007/s00253-010-2573-8 |
| [22] | POTTS S G, ROBERTS S P M, DEAN R, et al. Declines of managed honey bees and beekeepers in Europe[J]. Journal of Apicultural Research, 2010, 49(1): 15–22. DOI:10.3896/IBRA.1.49.1.02 |
| [23] | HOOPER D U, CHAPIN Ⅲ F S, EWEL J J, et al. Effects of biodiversity on ecosystem functioning:A consensus of cur-rent knowledge[J]. Ecological Monographs, 2005, 75(1): 3–35. DOI:10.1890/04-0922 |
| [24] | DAILY G C, EHRLICH P R, SÁNCHEZ-AZOFEIFA G A. Countryside biogeography:Use of human-dominated habitats by the avifauna of southern Costa Rica[J]. Ecological Appli-cations, 2001, 11(1): 1–13. DOI:10.1890/1051-0761(2001)011[0001:CBUOHD]2.0.CO;2 |
| [25] | MAYFIELD M M, DAILY G C. Countryside biogeography of neotropical herbaceous and shrubby plants[J]. Ecological Applications, 2005, 15(2): 423–439. DOI:10.1890/03-5369 |
| [26] | LONSDORF E, KREMEN C, RICKETTS T, et al. Modelling pollination services across agricultural landscapes[J]. Annals of Botany, 2009, 103(9): 1589–1600. DOI:10.1093/aob/mcp069 |
| [27] | MENDENHALL C D, SEKERCIOGLU C H, BRENES F O, et al. Predictive model for sustaining biodiversity in tropical countryside[J]. Proceedings of the National Academy of Sci-ences of the United States of America, 2011, 108(39): 16313–16316. DOI:10.1073/pnas.1111687108 |
| [28] |
徐环李, 杨俊伟, 孙洁茹. 我国野生传粉蜂的研究现状与保护策略[J]. 植物保护学报, 2009, 36(4): 371–376.
XU H L, YANG J W, SUN J R. Current status on the study of wild bee-pollinators and conservation strategies in China[J]. Journal of Plant Protection, 2009, 36(4): 371–376. |
| [29] |
谢正华, 徐环李, 杨璞. 传粉昆虫物种多样性监测、评估和保护概述[J]. 应用昆虫学报, 2011, 48(3): 746–752.
XIE Z H, XU H L, YANG P. Notes on monitoring, assessing and conserving pollinator biodiversity[J]. Chinese Journal of Applied Entomology, 2011, 48(3): 746–752. DOI:10.7679/j.issn.2095-1353.2011.126 |
| [30] | GARIBALDI L A, STEFFAN-DEWENTER I, KREMEN C, et al. Stability of pollination services decreases with isolation from natural areas despite honey bee visits[J]. Ecology Let-ters, 2011, 14(10): 1062–1072. DOI:10.1111/ele.2011.14.issue-10 |
| [31] | WESTPHAL C, BOMMARCO R, CARRÉ G, et al. Measuring bee diversity in different European habitats and biogeo-graphical regions[J]. Ecological Monographs, 2008, 78(4): 653–671. DOI:10.1890/07-1292.1 |
| [32] | HOLZSCHUH A, DUDENHÖFFER J, TSCHARNTKE T. Landscapes with wild bee habitats enhance pollination, fruit set and yield of sweet cherry[J]. Biological Conservation, 2012, 153: 101–107. DOI:10.1016/j.biocon.2012.04.032 |
| [33] | TSCHEULIN T, NEOKOSMIDIS L, PETANIDOU T, et al. Influence of landscape context on the abundance and diversity of bees in Mediterranean olive groves[J]. Bulletin of Entomological Research, 2011, 101(5): 557–564. DOI:10.1017/S0007485311000149 |
| [34] | KREMEN C, M'GONIGLE L K. Small-scale restoration in intensive agricultural landscapes supports more specialized and less mobile pollinator species[J]. Journal of Applied Ecology, 2015, 52(3): 602–610. DOI:10.1111/1365-2664.12418 |
| [35] |
唐启义, 冯明光. DPS数据处理系统[M]. 北京: 科学出版社, 2007.
TANG Q Y, FENG M G. DPS Data Processing System[M]. Beijing: Science Press, 2007. |
| [36] |
张兵伟, 王露露, 赵良成, 等. 北京市野生蜜粉源植物资源调查[J]. 北京林业大学学报, 2010, 32(S1): 18–22.
ZHANG B W, WANG L L, ZHAO L C, et al. Investigation of wild nectar and pollen plant resources in Beijing[J]. Journal of Beijing Forestry University, 2010, 32(S1): 18–22. |
| [37] | OSBORNE J L, WILLIAMS I H, CORBET S A. Bees, polli-nation and habitat change in the European community[J]. Bee World, 1991, 72(3): 99–116. DOI:10.1080/0005772X.1991.11099088 |
| [38] | LARSEN T H, WILLIAMS N M, KREMEN C. Extinction order and altered community structure rapidly disrupt eco-system functioning[J]. Ecology Letters, 2005, 8(5): 538–547. DOI:10.1111/j.1461-0248.2005.00749.x |
| [39] | GATHMANN A, TSCHARNTKE T. Foraging ranges of soli-tary bees[J]. Journal of Animal Ecology, 2002, 71(5): 757–764. DOI:10.1046/j.1365-2656.2002.00641.x |
| [40] | HOLZSCHUH A, STEFFAN-DEWENTER I, KLEIJN D, et al. Diversity of flower-visiting bees in cereal fields:Effects of farming system, landscape composition and regional con-text[J]. Journal of Applied Ecology, 2007, 44(1): 41–49. |
| [41] | CARVALHEIRO L G, VELDTMAN R, SHENKUTE A G, et al. Natural and within-farmland biodiversity enhances crop productivity[J]. Ecology Letters, 2011, 14(3): 251–259. DOI:10.1111/ele.2011.14.issue-3 |
| [42] |
吴燕如. 中国动物志, 膜翅目:准蜂科, 蜜蜂科[M]. 北京: 科学出版社, 2000: 1-442.
WU Y R. Fauna Sinica, Hymenoptera:Melittidae, Apidae[M]. Beijing: Science Press, 2000: 1-442. |
| [43] | MICHENER C D, EICKWORT K R. Observations on nests of Ceratina in Costa Rica (Hymenoptera, Apoidea)[J]. Revista de Biologia Tropical, 1966, 14(2): 279–286. |
| [44] |
牛泽清. 中国隧蜂属(膜翅目: 蜜蜂总科: 隧蜂科: 隧蜂亚科)的分类研究[D]. 北京: 中国科学院动物研究所, 2004: 1-157
NIU Z Q. A taxonomic study of the genus Halictus (Hyme-noptera: Apoidea: Halictidae: Halictinae) from China[D]. Beijing: Institute of Zoology, Chinese Academy of Sciences, 2004: 1-157 |
| [45] |
张睿. 中国淡脉随蜂属分类及系统发育研究[D]. 昆明: 云南农业大学, 2012: 1-309
ZHANG R. Taxonomy and phylogeny of Lasiogolossum (Hymenoptera: Apoidea: Halictidae) from China[D]. Kun-ming: Yunnan Agricultural University, 2012: 1-309 |
| [46] |
吴燕如. 中国经济昆虫志[M]. 北京: 科学出版社, 1965: 1-83.
WU Y R. The Economic Insect Fauna of China[M]. Beijing: Science Press, 1965: 1-83. |
 2018, Vol. 26
2018, Vol. 26



