2. 赤峰学院生命科学学院 赤峰 024000;
3. 巴彦淖尔市农牧业科学研究院 巴彦淖尔 015000
2. Chifeng College of Life Sciences, Chifeng 024000, China;
3. Bayannao'er Institute of Agricultural Sciences, Bayannao'er 015000, China
黄瓜枯萎病是黄瓜生产栽培中一种危害十分严重的土传病害, 防治困难, 至今未找到一种有效的防治方法。目前, 黄瓜(Cucumis sativus L.)生产上主要采用化学农药进行防治, 但防治效果不佳且易造成环境污染、农药残留等问题。化感作用是指植物或微生物的代谢分泌物对环境中其他植物或微生物的有利或不利作用[1-2]。了解不同植物的化感作用以及利用植物间化感促进或抑制作用防治植物土传病害, 是当今“规模化”、“单一化”种植生产上亟待解决的突出问题。已有研究证实, 植物间作、轮作是改善植物土传病害发生的有效方法之一。吴凤芝等[3]研究表明黄瓜与小麦(Triticum aestivum L.)、毛苕子(Vicia villosa Roth.)和三叶草(Trifolium chinensis L.)间作降低了黄瓜枯萎病的病情指数和尖孢镰刀菌(Fusarium oxysporum Schl.)的数量; 苏世鸣[4]证实了西瓜[Citrullus lanatus (Thunb.) Matsum. et Nakai]与旱作水稻(Oryza sativa L.)间作抑制了西瓜枯萎病的发生。近年来, 利用植物之间化感促进或抑制作用防控植物土传病害发生的研究, 日益受到国内外研究者的重视, 也有了相关报道。李云鹏等[5]证实了野生茄子(Solanum tirvum L.)根、茎、叶和腐解物对茄子黄萎病具有明显的化感抑制作用; 张淑红[6]筛选出了7种对茄子黄萎病具有化感抑制效果的材料; 杨江舟等[7]发现韭菜(Allium tuberosum Rottl. ex Spreng.)根系浸提液对香蕉枯萎病菌的菌丝生长和孢子萌发均具有明显的抑制作用。但利用西芹(Apium graveolens L.)的化感作用与黄瓜进行间作来防控黄瓜土传病害的研究尚未见报道。
本课题组已证实西芹对黄瓜枯萎病菌具有一定化感抑制作用[8-11], 但仅限于西芹种子、鲜根、腐根等离体组织浸提液对黄瓜枯萎病化感作用的研究, 田间种植西芹与黄瓜, 利用西芹与黄瓜进行间作, 西芹对黄瓜枯萎病是否还具有化感作用?化感强度如何?能否降低黄瓜枯萎病的田间发病率等问题, 有待于进一步研究。本试验在上述研究的基础上, 利用西芹与黄瓜进行间作, 通过对黄瓜枯萎病菌菌落直径、黄瓜营养生长指标以及黄瓜枯萎病田间发病率的测定, 探讨与西芹间作后对黄瓜生长、黄瓜枯萎病的化感作用以及黄瓜枯萎病田间化感防控的效果, 为今后黄瓜高效生产栽培和土传病害化感防控提供科学理论依据。
1 材料与方法 1.1 试验地概况及供试材料试验地位于内蒙古呼和浩特市赛罕区(110°40′~112°10′E, 40°36′~40°57′N), 该区土壤为黏壤土, 年平均气温13.6 ℃, 年照时数1 600 h, 无霜期113~134 d, 年平均降水量335.2~534.6 mm, 中温带大陆性季风气候。供试黄瓜品种为‘津春四号’, 由天津科润黄瓜研究所提供。供试西芹品种为‘美国西芹’, 由寿光惠农种业有限公司提供。供试菌种黄瓜枯萎病菌(Fusarium oxysporium f. sp. cucumerinum)由内蒙古农业大学农学院蔬菜栽培实验室提供。
1.2 试验设计本试验以西芹单作和黄瓜单作为对照, 黄瓜与西芹间作为处理, 于2016年在内蒙古农业大学教学基地完成。西芹单作于2月14日播种育苗, 4月24日定植, 株行距30 cm×20 cm。黄瓜单作于3月24日播种育苗, 4月24日定植, 株行距35 cm×55 cm。黄瓜与西芹间作采用二者隔行种植, 1行黄瓜, 2行西芹, 4月24日定植, 西芹与黄瓜间距20 cm, 种植密度同上。每一处理, 4次重复, 完全随机区组排列, 小区面积18 m2, 常规田间管理。
1.3 测定指标及方法 1.3.1 取样方法5月22日(定植后30 d)开始测定黄瓜营养生长指标, 每周测1次, 共测5次; 6月5日开始, 记录黄瓜第1雌花节位及1~30节内雌花数; 6月12日第1次采集土样, 使用土钻采集植株根际0~15 cm耕层土壤, 采用“X”型5点取样法, 田间充分混匀后装塑封袋, 送实验室于室内阴凉处, 摊开晾干, 剔除植物残体、石块和其他杂物。将风干的土样磨碎, 过1 mm孔径筛, 备用, 7 d取1次, 共采集5次。土样风干后, 实验室内采用丙酮、乙醇、蒸馏水3种土壤浸提剂浸提土壤, 获得不同处理土壤浸提液。无菌条件下在PDA培养基加入上述不同土壤浸提液, 28 ℃恒温干燥箱中培养黄瓜枯萎病菌, 计算菌落直径和化感效果。黄瓜拉秧前, 取上述不同处理土壤, 田间装苗钵种植黄瓜, 在黄瓜第1片真叶完全展开时接种黄瓜枯萎病菌(FOC), 调查黄瓜枯萎病发病情况, 计算病情指数和防治效果。
1.3.2 生长发育指标测定每个处理每个小区随机挂牌标记10株, 田间测定黄瓜营养生长和发育指标。株高采用卷尺测量植株心叶最高高度; 茎粗采用游标卡尺测量距地表 1 cm处; 最大叶面积选取植株最大叶片, 用卷尺测量长与宽, 计算二者乘积; 叶片数以直径≥5 cm为一片叶。田间记录有上述标记植株的第1雌花节位及1~30节内雌花数。每个指标取10株的平均值。
1.3.3 菌落直径及化感效果测定方法土壤浸提液制备:用丙酮、乙醇和蒸馏水分别作为土壤浸提剂。按照土样质量:浸提剂体积=1:2进行浸提。置于摇床(25 ℃, 110 r·min–1)振荡浸提24 h后, 先经6层纱布过滤, 再经一层定性滤纸过滤, 即得各处理土壤浸提液。
平板制备:将上述不同土壤浸提液2 mL移到9 cm直径的培养皿中, 然后加入18 mL熔融态的PDA培养基, 并混匀, 制成平板。以加入2 mL浸提液平板为处理, 2 mL 3种浸提剂平板和20 mL PDA培养基(空白)平板为浸提剂对照和总对照。
接菌培养:在无菌条件下, 用直径为0.6 cm的打孔器打取菌饼, 用接种针将菌饼移入上述不同的培养基上, 菌丝面向下, 每皿1块, 放置于皿中央, 25 ℃恒温培养箱中培养, 每个处理5次重复。菌落直径采用十字交叉法测定。
| $ 菌落直径(\rm{cm})=测量菌落直径的平均值-0.6 $ | (1) |
| $ {\rm{化感效果}}\left( {\rm{\% }} \right){\rm{ = }}\left( {{\rm{对照菌落直径 - 处理菌落直径}}} \right)/{\rm{对照菌落直径}} \times {\rm{100\% }} $ | (2) |
黄瓜拉秧前采用上述土壤采集方法, 将不同处理土壤田间装苗钵, 每个处理装25个苗钵, 苗钵直径为8 cm, 装满土, 4次重复。黄瓜种子在光照培养箱恒温(28 ℃)催芽, 待种子露白时, 将其播于装好的苗钵里, 每穴1粒, 常规管理。待黄瓜幼苗第1片真叶完全展开时, 用小刀在距黄瓜根部1 cm处切一正方形, 采用灌根法接种黄瓜枯萎病菌(浓度为1.0×106, 于正方形内每苗钵浇灌5 mL)。接种7 d后开始调查发病情况, 每隔1 d调查1次, 共调查6次。计算病情指数及抑病效果。黄瓜枯萎病不同病级参照标准如下: 0级, 无症状; 1级, 胚轴及子叶轻微萎蔫, 子叶失去光泽; 2级, 植株轻度萎蔫或子叶萎蔫; 3级, 植株明显萎蔫或矮化; 4级, 植株严重萎蔫或倒伏枯死。
| $ \begin{array}{l} {\rm{病情指数}}\left( \% \right) = \sum {\left( {{\rm{病情级值}} \times {\rm{该级病情株数}}} \right)} \\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\left( {{\rm{病情最高极值}} \times {\rm{总株数}}} \right) \times 100\ \end{array} $ | (3) |
| $ \begin{array}{l} {\rm{防治效果}}\left( \% \right) = \left( {{\rm{对照病情指数 - 处理病情指数}}} \right)/\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{对照病情指数}} \times {\rm{100\ }} \end{array} $ | (4) |
采用Microsoft Excel 2003软件、SPSS 17.0软件和SAS软件进行方差分析与数据处理。
2 结果与分析 2.1 黄瓜与西芹间作对黄瓜生长发育的影响 2.1.1 对黄瓜营养生长的影响黄瓜定植30 d后, 开始测定黄瓜营养生长指标, 不同处理对黄瓜营养生长的影响如表 1所示。黄瓜与西芹间作促进了黄瓜营养生长。黄瓜营养生长前期(5月29日前), 黄瓜与西芹间作与黄瓜单作间各生长指标差异不显著。6月5日后, 间作的黄瓜茎粗和叶片数显著高于黄瓜单作(P < 0.05)。6月12日后, 间作的株高和最大叶面积显著高于黄瓜单作(P < 0.05)。
| 表1 黄瓜与西芹间作对黄瓜营养生长的影响 Table 1 Effect of cucumber-celery intercropping on vegetative growth of cucumber |
与西芹间作降低了黄瓜第1雌花节位, 第1雌花节位为4.52, 比黄瓜单作显著降低(P < 0.05) 11.20%。说明黄瓜与西芹间作能够降低黄瓜第1雌花节位, 促进黄瓜提早开雌花。
与西芹间作对黄瓜1~30节内每5节节位雌花数的影响如图 1所示。与西芹间作黄瓜1~30节内每5节雌花数高于黄瓜单作, 其中, 前15节每5节内雌花数未达到显著差异, 而15节后每5节内雌花数达到显著差异(P < 0.05), 与西芹间作黄瓜1~30节内每5节内雌花数比黄瓜单作增加幅度达8.74%~ 22.14%。黄瓜1~30节内雌花数的增多, 有利于黄瓜早期产量的形成, 为黄瓜高产打下了坚实的基础。

|
图 1 黄瓜与西芹间作对黄瓜不同节位雌花数的影响 Figure 1 Effect of cucumber-celery intercropping on female flower numbers of different cucumber nodes 同一节位不同小写字母表示黄瓜与西芹间作和黄瓜单作间在0.05水平差异显著。 Different lowercase letters indicate significant difference between cucumber-celery intercropping and cucumber monoculture at 0.05 level. |
如表 2所示, 不同土壤取样时间, 黄瓜与西芹间作土壤浸提液培养的黄瓜枯萎病菌菌落直径均与西芹单作和黄瓜单作达到显著差异(P < 0.05), 而西芹单作和黄瓜单作间差异性未达到显著。5次取样时间, 黄瓜与西芹间作的菌落直径最小, 显著抑制了黄瓜枯萎病菌菌落的生长, 说明对黄瓜枯萎病菌具有一定化感作用。且随着土壤取样时间的延后, 不同土壤浸提液培养的黄瓜枯萎病菌菌落直径呈逐渐减小趋势, 化感抑制作用逐渐加强。5次取样时间, 3种不同浸提剂间菌落直径均达到显著性差异(P < 0.05), 其中, 乙醇浸提剂培养菌落直径最小, 其次为丙酮和蒸馏水。随着田间作物生育期的延后, 与黄瓜间作处理土壤浸提液培养菌落直径逐渐减小, 可能由于不同处理取样后期, 西芹植株体逐渐增大, 根系逐渐增强, 根系分泌物也逐渐增加, 这些分泌物能够抑制黄瓜枯萎病菌菌落的生长, 因此, 菌落直径会逐渐减小。
| 表2 不同种植模式土壤浸提液PDA培养基25 ℃下培养144 h黄瓜枯萎病菌菌落直径 Table 2 Colony diameters of Fusaium oxysporum f. sp. cucumerinum cultivated on PDA culture medium prepared with different soil extracts under cucumber-celery intercropping, celery monoculture and cucumber monoculture for 144 h at 25 ℃ mm |
不同取样时间, 黄瓜与西芹间作处理对黄瓜枯萎病菌的化感效果如图 2所示。6月19日前取样, 与西芹间作处理相对黄瓜单作和西芹单作的化感效果未达到显著性差异, 但丙酮浸提剂与乙醇和蒸馏水浸提剂达到显著差异(P < 0.05);随着土壤取样时间延后, 与西芹间作相对西芹单作和黄瓜单作的化感效果呈现逐渐增加趋势, 且相对西芹单作和黄瓜单作的化感效果达到极显著差异(P < 0.01)。与西芹间作处理相对西芹单作的化感抑制效果达38.11%~74.95%, 对黄瓜单作的化感抑制效果达42.15%~75.90%。说明与西芹间作处理对黄瓜枯萎病菌具有明显的化感抑制作用, 且随着作物生育期的延长, 化感抑制作用效果逐渐加强。
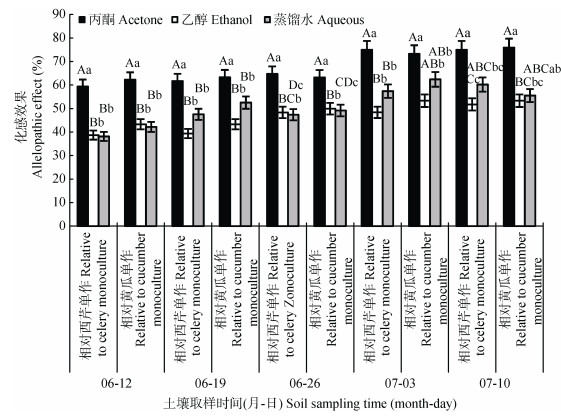
|
图 2 不同取样时间黄瓜与西芹间作相对西芹单作和黄瓜单作对黄瓜枯萎病菌的化感效果(丙酮、乙醇和蒸馏水指土壤的丙酮、乙醇和蒸馏水浸提液) Figure 2 Allelopathy effects on cucumber fusarium wilt of cucumber-celery intercropping relative to celery monoculture and cucumber monoculture in different sampling times (acetone, ethanol and aqueous indicate soil extracts of acetone, ethanol and distill water, respectively) 不同小写字母表示不同种植模式不同浸提液间在0.05水平差异显著。 Different lowercase letters indicate significant differences among different planting |
不同处理土壤田间营养钵种植黄瓜, 在黄瓜第1片真叶完全展开时采用灌根法接种FOC, 接种后黄瓜枯萎病田间发病情况及防治效果如表 3所示。黄瓜与西芹间作处理植株的黄瓜枯萎病病情指数显著(P < 0.05)低于西芹单作和黄瓜单作。随着调查日期的延后, 不同处理植株病情指数均呈现逐渐增加趋势, 接种13 d后, 病情指数趋于稳定。黄瓜与西芹间作相对于西芹单作的防治效果达57.03%~63.54%, 相对于黄瓜单作的防治效果达66.95%~72.15%。
| 表3 不同处理植株黄瓜枯萎病发病情况及防治效果 Table 3 Morbidity and control efficiency of cucumber fusarium wilt under different planting modes |
进行合理的间套混作, 伴生作物的根系分泌物及根茬腐解物能促进主茬作物生长[12-13]。主要原因一是不同作物需要矿质元素的种类和比例不同, 可以降低土壤盐分积累, 改善土壤物理性状; 二是不同作物根系分泌物和残体腐解物不同, 可以抑制土壤病原菌增殖, 恢复原有微生物群落结构多样性; 三是有益的伴生作物通过根系分泌物和残体腐解物等途径释放化感物质, 产生有益的化感作用, 促进主茬作物生长[14-17]。王玉彦等[18]证实用小麦、大豆(Giycine max)、燕麦(Avena sativa)为伴生作物与黄瓜间作, 促进了黄瓜生长; 刘正鲁等[19]研究表明, 菌菜与黄瓜间作模式下黄瓜的生长优于单作模式。高晓敏等[20]采用GC-MS方法证实, 西芹鲜根乙醇浸提液4次层析能够分泌酸类、酯类、酚类、醇类及含氮化合物等5类物质, 这些物质与植物间化感作用密切相关。本研究表明:利用西芹与黄瓜进行间作, 能够促进黄瓜的营养生长和生殖生长。这说明西芹是黄瓜的有益伴生作物, 它能够通过根系分泌物途径产生一定化感作用[21], 且这种作用是有益的, 从而促进了主茬作物黄瓜的生长, 与上述研究结果一致。但黄瓜与西芹间作后, 哪些化感物质对黄瓜生长起到了关键作用, 还有待于进一步研究。
3.2 黄瓜与西芹间作对黄瓜枯萎病菌化感作用及化感效果的影响菌落直径大小常被用作衡量病原菌菌落生长的指标。关于植物及其土壤浸提液对病原菌化感作用的研究已有报道。刘晓燕等[22]证实施氯化钾处理的土壤浸提液对禾谷镰刀菌(Fusarium graminearum Schw.)生长有明显的抑制效果; 黄奔立等[23]研究发现, 茄根浸提液对大丽轮枝菌(Verticillium dahliae Klebahn)、核盘菌[Sclerotinia sclerotiorum (Lib.) de Bary]和灰葡萄孢(Botrytis cinerea Pers.)3种病原菌生长有明显促进作用。本课题组成员对西芹鲜根和腐根根际区物浸提液对黄瓜枯萎病菌的化感作用已进行了相关报道[10, 24]。本研究表明:不同处理土壤浸提液对黄瓜枯萎病菌具有一定化感抑制作用, 与刘晓燕等[22]研究结果一致。其中, 黄瓜与西芹间作处理土壤浸提液对枯萎病菌的化感抑制作用最强, 明显抑制了黄瓜枯萎病菌病原菌繁殖与生长。目前已证实从作物根系分泌物中分离出的化感物质主要包括有机酸及其衍生物[25]、酯类[26]以及酚类[27]和硫化物[28]。且已有研究表明十字花科(Brassicaceae)芸薹属(Bassica)植物对土壤中细菌和立枯丝核菌(Rhizoctonia solani Kuhn.)的化感抑制作用主要与其根系分泌的3种含氮化合物有关[29]。而高晓敏等[20]证实西芹鲜根乙醇浸提液能够分泌4种含氮化合物。随着田间作物生育期的延长, 这些化感物质会增加, 对黄瓜枯萎病病菌菌丝生长和繁殖的抑制作用也会逐渐增强。3种浸提剂中, 乙醇抑制效果最高, 其次为丙酮和蒸馏水, 这与曹阳[10]研究结果一致。但黄瓜与西芹间作后能够产生哪些化感物质, 这些化感物质的作用及功能如何?还有待于进一步研究。
杨玉锋等[30]研究发现较高浓度的西芹根水浸提液对西瓜枯萎病菌的抑制率达11.05%~29.31%。韩燕[9]证实发现西芹对黄瓜枯萎病菌的最高抑制率达94.37%。本研究发现, 西芹根系分泌物对黄瓜枯萎病菌具有一定抑制作用, 抑制效果明显。3种不同浸提剂的黄瓜与西芹间作处理土壤浸提液均对黄瓜枯萎病菌菌丝生长具有一定化感抑制作用, 且随土壤采样时间和作物田间生育期的延后, 化感抑制效果逐渐增强, 对黄瓜枯萎病菌的最高抑制率可达75.90%。
3.3 黄瓜与西芹间作对黄瓜枯萎病发生的影响目前, 有关对黄瓜枯萎病菌抑病性的研究大多数停留在利用生防菌[31]或化学合成物质[32-34]进行预防或防治。有关蔬菜作物间作模式防治主栽作物病害发生的报道较少, 乔鹏等[35]证实不同抗性小麦品种与蚕豆(Vicia faba L.)间作降低了各抗性小麦品种白粉病的发生程度, 相对防效为0.76%~81.49%。程智慧等[36]证实大蒜(Allium sativum L.)鳞茎粗提物对黄瓜枯萎病的防病效果达65.5%~81.8%。利用黄瓜与西芹间作模式抑制枯萎病发生的研究尚鲜见报道。本研究利用上述3种不同处理土壤田间装苗钵种植黄瓜, 在黄瓜苗期采用灌根法接种黄瓜枯萎病菌, 研究发现, 与西芹间作土壤对黄瓜枯萎病菌表现出一定的抑制作用, 抑制效果最强, 明显降低了黄瓜枯萎病的田间发病率。陈磊等[11]证实西芹乙醇浸提液对FOC生长有较强的抑制作用; 高晓敏等[20]证实西芹鲜根乙醇浸提液中能分离出5种有机酸, 其中4-甲氧基水杨酸值属于水杨酸类物质, 而植物中水杨酸信号传导途径与植物的抗病性密切相关[37]。因此, 对黄瓜与西芹间作土壤进行化感物质的GC-MS鉴定, 是接下来需要做的工作。
本研究利用西芹与黄瓜进行间作, 通过对田间黄瓜生长发育指标、实验室不同处理土壤浸提液培养菌落直径以及黄瓜枯萎病田间发病率的测定。结果表明:与西芹间作处理促进了黄瓜营养生长; 降低了黄瓜第1雌花节位, 增加了黄瓜的雌花数, 为黄瓜高产栽培打下了良好的基础; 与西芹间作处理土壤浸提液对黄瓜枯萎病菌具有一定化感作用, 这种作用表现为抑制作用, 而且随着田间作物生育期的延长, 这种抑制作用逐渐加强, 化感抑制效果显著; 不同处理土壤苗钵种植黄瓜, 苗期接种黄瓜枯萎病菌后, 与西芹间作处理能有效降低黄瓜枯萎病的田间发病率。因此, 本研究不仅能为黄瓜枯萎病化感防控提供重要的科学依据, 还对黄瓜高产栽培具有一定实践指导意义。
| [1] | RICE E L. Allelopathy[M]. 2nd ed. New York: Academic Press, 1984: 1-50. |
| [2] | INDERJIT, WARDLE D A, KARBAN R, et al. The ecosystem and evolutionary contexts of allelopathy[J]. Trends in Ecology & Evolution, 2011, 26(12): 655–662. |
| [3] |
吴凤芝, 周新刚. 不同作物间作对黄瓜病害及土壤微生物群落多样性的影响[J]. 土壤学报, 2009, 46(5): 899–906.
WU F Z, ZHOU X G. Effect of intercropping of cucumber with different crops on cucumber diseases and soil microbial community diversity[J]. Acta Pedologica Sinica, 2009, 46(5): 899–906. DOI:10.11766/trxb200804020519 |
| [4] |
苏世鸣. 西瓜与旱作水稻间作抑制西瓜连作枯萎病及其机理[D]. 南京: 南京农业大学, 2007
SU S M. Decreasing Fusarium wilt of watermelon in continuing cropping system intercropping with aerobic rice[D]. Nanjing: Nanjing Agricultural University, 2007 |
| [5] |
李云鹏, 周宝利, 李之璞, 等. 野生抗病茄植株腐解物对茄子黄萎病菌的化感作用研究[J]. 沈阳农业大学学报, 2007, 38(4): 500–503.
LI Y P, ZHOU B L, LI Z P, et al. Allelopathic effects of wild anti-disease eggplant decomposing products on verticillium wilt (Verticillium dahliae)[J]. Journal of Shenyang Agricultural University, 2007, 38(4): 500–503. |
| [6] |
张淑红. 植物提取物对茄子黄萎病菌的抑制作用及活性成分研究[D]. 沈阳: 沈阳农业大学, 2007
ZHANG S H. Study on the inhibiting effect on Verticillium dahliae and active constituent of plant extracts[D]. Shenyang: Shenyang Agricultural University, 2007 |
| [7] |
杨江舟, 张静, 胡伟, 等. 韭菜根系浸提液对香蕉枯萎病和土壤微生物生态的影响[J]. 华南农业大学学报, 2012, 33(4): 480–487.
YANG J Z, ZHANG J, HU W, et al. Effects of allium tuberosum root extracts on banana fusarium wilt and soil microbial ecology[J]. Journal of South China Agricultural University, 2012, 33(4): 480–487. |
| [8] |
贾俊英. 西芹种子浸提液对黄瓜枯萎病菌化感作用及其机理的研究[D]. 呼和浩特: 内蒙古农业大学, 2011
JIA J Y. Studies on allelopathy and mechanism of the extract solution of the parsley seed on Fusarium oxysporium f. sp. cucumerinum[D]. Hohhot: Inner Mongolia Agricultural University, 2011 |
| [9] |
韩燕. 西芹根及根际区物浸提液对黄瓜枯萎病菌化感作用的研究[D]. 呼和浩特: 内蒙古农业大学, 2007
HAN Y. The study on the allelopathy of extracts of the root and the rhizosphere of parsley on Fusarium oxysporiumf. sp. cucumeris[D]. Hohhot: Inner Mongolia Agricultural University, 2007 |
| [10] |
曹阳. 西芹腐根及腐根际区物浸提液对黄瓜枯萎病菌化感作用的研究[D]. 呼和浩特: 内蒙古农业大学, 2009
CAO Y. The study on the allelopathy of extracts of the rotten root and the rhizosphere zone rot soil of parsley on Fusarium oxysporum. sp. cucumeris[D]. Hohhot: Inner Mongolia Agricultural University, 2009 |
| [11] |
陈磊, 李蕾, 项鹏宇, 等. 西芹挥发物对黄瓜枯萎病菌的化感作用[J]. 生态学杂志, 2012, 31(4): 877–881.
CHEN L, LI L, XIANG P Y, et al. Allelopathy of parsley volatiles on Fusarium oxysporium f. sp. cucumeris[J]. Chinese Journal of Ecology, 2012, 31(4): 877–881. |
| [12] | HICKMAN M V. Long-term tillage and crop rotation effects on soil chemical and mineral properties[J]. Journal of Plant Nutrition, 2002, 25(7): 1457–1470. DOI:10.1081/PLN-120005402 |
| [13] | CZARNOTA M A, RIMANDO A M, WESTON L A. Evaluation of root exudates of seven sorghum accessions[J]. Journal of Chemical Ecology, 2003, 29(9): 2073–2083. DOI:10.1023/A:1025634402071 |
| [14] | NISHIO M, KUSANO S. Fungi associated with roots of continuously cropped upland rice[J]. Soil Science and Plant Nutrition, 1993, 19(3): 205–217. |
| [15] | MOLISCH H. Der Einfluss einer Pflanze auf die andere Allelopathie[M]. Jena: Gustav Fischer, 1937. |
| [16] | WILLIAMSON G B, RICHARDSON D. Bioassays for allelopathy:Measuring treatment responses with independent controls[J]. Journal of Chemical Ecology, 1988, 14(1): 181–187. DOI:10.1007/BF01022540 |
| [17] | YU J Q, MATSUI Y. p-thiocyanatophenol as a novel allelopathic compound in exudatian from root of encumber[J]. Chem Express, 1993, 8: 577–580. |
| [18] |
王玉彦, 吴凤芝, 周新刚. 不同间作模式对设施黄瓜生长及土壤环境的影响[J]. 中国蔬菜, 2009(16): 8–13.
WANG Y Y, WU F Z, ZHOU X G. Effects of different intercropping patterns on the growth of cucumber in greenhouse and soil environment[J]. China Vegetables, 2009(16): 8–13. |
| [19] |
刘正鲁, 刘敏德, 姚永康. 荷兰温室菌菜间作对黄瓜和榆黄菇生长及产量的影响[J]. 江苏农业科学, 2010(1): 162–163.
LIU Z L, LIU M D, YAO Y K. Effects of intercropping on growth and yield of Pleurotus citrinopileatus and cucumber under greenhouse[J]. Jiangsu Agricultural Sciences, 2010(1): 162–163. |
| [20] |
高晓敏, 王琚钢, 云兴福, 等. 西芹醇层物对黄瓜枯萎病菌的化感作用及化感物质鉴定[J]. 中国生物防治学报, 2017, 33(2): 281–288.
GAO X M, WANG J G, YUN X F, et al. Allelopathic effects of fresh parsley root ethanol extracts on Fusarium oxysporum f. sp. cucumberinum and allelochemicals identification[J]. Chinese Journal of Biological Control, 2017, 33(2): 281–288. |
| [21] |
高晓敏, 王琚钢, 李杰, 等. 西芹鲜根丙酮浸提物层析流分对黄瓜枯萎病菌的化感作用以及化感物质鉴定[J]. 中国生态农业学报, 2014, 22(11): 1364–1371.
GAO X M, WANG J G, LI J, et al. Allelopathic effects of fresh parsley root acetone extracts on Fusarium oxysporum f. sp. cucumberinum and allelochemicals identification[J]. Chinese Journal of Eco-Agriculture, 2014, 22(11): 1364–1371. |
| [22] |
刘晓燕, 金继运, 何萍, 等. 氯化钾抑制玉米茎腐病发生与土壤微生物关系初探[J]. 植物营养与肥料学报, 2007, 13(2): 279–285.
LIU X Y, JIN J Y, HE P, et al. Preliminary study on the relation between potassium chloride suppressing corn stalk rot and soil microorganism characteristics[J]. Plant Nutrition and Fertilizer Science, 2007, 13(2): 279–285. DOI:10.11674/zwyf.2007.0216 |
| [23] |
黄奔立, 朱键鑫, 许云东, 等. 茄根分泌物及其浸提液对3种土传病原菌生长的促进作用[J]. 江苏农业学报, 2005, 21(4): 301–305.
HANG B L, ZHU J X, XU Y D, et al. Promotion of eggplant root exudates and extract on mycelial growth of three soil-borne pathogens[J]. Jiangsu Journal of Agricultural Sciences, 2005, 21(4): 301–305. |
| [24] |
项鹏宇, 韩燕, 云兴福. 西芹根及根际区物乙醇浸提液对黄瓜枯萎病菌的化感作用[J]. 华北农学报, 2008, 23(4): 45–50.
XIANG P Y, HAN Y, YUN X F. The allelopathy of ethanol extract of the root and the rhizosphere of parsley on Fusarium oxysporiumf. sp. cucumeris[J]. Acta Agriculturae Boreali-Sinica, 2008, 23(4): 45–50. DOI:10.7668/hbnxb.2008.04.011 |
| [25] | HAO W Y, REN L X, RAN W, et al. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f. sp. niveum[J]. Plant and Soil, 2010(1/2): 485–497. |
| [26] | WU H S, LIU Y D, YANG X I, et al. Growth responses of in vitro Fusarium oxysporum f. sp. niveum to external supply of tannic acid[J]. Journal of Environmental Biology, 2010, 31(6): 1017–1022. |
| [27] | SUN J B, PENG M, WANG Y G, et al. Isolation and characterization of antagonistic bacteria against Fusarium wilt and induction of defense related enzymes in banana[J]. African Journal of Microbiology Research, 2011, 5(5): 509–515. |
| [28] | ZHANG H, MALLIK A, ZENG R S. Control of panama disease of banana by rotating and intercropping with Chinese chive (Allium tuberosum Rottler):Role of plant volatiles[J]. Journal of Chemical Ecology, 2013, 39(2): 243–252. DOI:10.1007/s10886-013-0243-x |
| [29] | MOWLICK S, YASUKAWA H, INOUE T, et al. Suppression of spinach wilt disease by biological soil disinfestation incorporated with Brassica juncea plants in association with changes in soil bacterial communities[J]. Crop Protection, 2013, 54: 185–193. DOI:10.1016/j.cropro.2013.08.012 |
| [30] |
杨玉锋, 姚战军, 李保利. 西芹根水浸提液对西瓜枯萎病菌的化感作用[J]. 江苏农业科学, 2011, 39(6): 224–225.
YANG Y F, YAO Z J, LI B L. Allelopathy of aqueous extracts from parsley roots towards fusarium wilt of cucumber[J]. Jiangsu Agricultural Sciences, 2011, 39(6): 224–225. |
| [31] |
赵帅. 放线菌HD-087防治黄瓜枯萎病作用机制研究[D]. 哈尔滨: 黑龙江大学, 2010
ZHAO S. Study on the mechanism of Actinomycetes HD-087 preventing and curing fusarium wilt of cucumber[D]. Harbin: Heilongjiang University, 2010 |
| [32] |
刘海南. 木霉菌T23菌株对瓜类枯萎病生防机制的研究[D]. 沈阳: 沈阳农业大学, 2005
LIU H N. Study on the biocontrol mechanism of Trichoderma strains T23 towards Cucurbits Fusarium Wilt[D]. Shenyang: Shenyang Agricultural University, 2005 |
| [33] |
姚艳平, 刘亚力, 徐同, 等. 化学合成的几丁寡糖类似物诱导黄瓜对镰孢霉枯萎病的抗性[J]. 浙江大学学报:农业与生命科学版, 2007, 33(1): 8–14.
YAO Y P, LIU Y L, XU T, et al. Induced resistance of cucumbers to Fusarium wilt disease by synthesized N-acetylchitooligosaccharide analogues[J]. Journal of Zhejiang University:Agriculture & Life Sciences, 2007, 33(1): 8–14. |
| [34] |
石明旺, 宋以星, 胡锐. 水杨酸复配物诱导黄瓜幼苗对枯萎病的抗性研究[J]. 河南科技学院学报, 2010, 38(2): 35–38.
SHI M W, SONG Y X, HU R. Preliminary study on resistance of cucumber seedling to fusarium wilt induced by salicylic compound[J]. Journal of Henan Institute of Science and Technology, 2010, 38(2): 35–38. |
| [35] |
乔鹏, 汤利, 郑毅, 等. 不同抗性小麦品种与蚕豆间作条件下的养分吸收与白粉病发生特征[J]. 植物营养与肥料学报, 2010, 16(5): 1086–1093.
QIAO P, TANG L, ZHENG Y, et al. Characteristics of nutrient uptakes and powdery mildew incidence of different resistant wheat cultivars intercropping with faba bean[J]. Plant Nutrition and Fertilizer Science, 2010, 16(5): 1086–1093. DOI:10.11674/zwyf.2010.0507 |
| [36] |
程智慧, 宋莉, 孟焕文, 等. 大蒜鳞茎粗提物对黄瓜枯萎病的抑菌作用和防病效果[J]. 西北农林科技大学学报:自然科学版, 2008, 36(5): 113–118.
CHENG Z H, SONG L, MENG H W, et al. Study on the effects of garlic bulb crude extracts on inhibition of Fusarium axysporum (Schl.) f. sp. Cucumerinum Owen. and disease contro[J]. Journal of Northwest A&F University:Natural Science Edition, 2008, 36(5): 113–118. |
| [37] | WANG Z, JIA C H, LI J Y, et al. Activation of salicylic acid metabolism and signal transduction can enhance resistance to Fusarium wilt in banana (Musa acuminata L. AAA group, cv. Cavendish)[J]. Functional & Integrative Genomics, 2015, 15(1): 47–62. |
 2018, Vol. 26
2018, Vol. 26



