植物根系分泌物高度影响和调节着根际土壤的物理特性、营养有效性以及植物根系与根际土壤微生物、病原菌及其他生物之间化学信号交流的生物学过程[1-2]。根系分泌物的化学特性以及精确定量分析是更好理解根际过程的主要先决条件。由于根系分泌物的局部沉积, 土壤微生物对其降解以及根际土壤的动态吸附作用, 对根系分泌代谢物进行定量及定性分析变得相对困难[3]。近年来, 非靶标无偏向性的根际代谢组学(rhizosphere metabolomics)技术平台的发展, 使得对根土界面内根系分泌物组进行分析成为可能[4-6]。核磁共振(NMR)具有无破坏性、无偏向性、高灵敏度以及测量快速等特点, 是代谢组学研究主要的分析技术平台之一, 已经应用NMR方法对植物地上部的生理生态学问题进行了大量研究[7], 而应用该方法进行地下植物分泌作用方面的研究则相对有限。如何收集原生状态的根系分泌物是根际代谢组学研究的关键。通常采用营养液、琼脂、灭菌石英砂等基质进行植物培养收集根系分泌物, 从而可以避免根际微生物的影响, 有效消除土壤环境噪音[8]。然而根系生长介质会影响根系构型、分泌方式和分泌物构成, 同时考虑到农业田间生产实际, 尤其是当需要关注土壤物理性状(如机械阻力、孔隙度等)对根系分泌过程扰动时, 土壤是最佳培养基质。本文基于植物土壤培养, 实施了根系土壤沥出、根鞘土收集及短期水培养3种根系分泌物收集方案, 对于建立根际生态学研究方法, 理解根土相互作用而言具有重要意义。
植物内的氮素状态及土壤环境的氮素水平对植物根系分泌物的数量和构成具有重要影响[9]。在化学氮肥减量施用条件下, 作物根系分泌过程及分泌物的响应特征, 是降低氮肥使用量、改善氮利用率, 进而减缓氮过剩引发的环境负效应以及实现农业可持续生产过程中亟需明确的关键问题。目前鲜有在氮肥减施条件下玉米(Zea mays L.)根系代谢组学特征的报道。本文基于核磁共振波谱法研究了不同氮肥减施量对玉米幼苗根系分泌物及根际代谢物组的影响, 从而为获取优化根际内氮平衡和提高氮利用率提供理论依据。
1 材料与方法 1.1 玉米幼苗土壤培养及根系分泌物收集以玉米杂交品种‘铁研38’为材料进行盆栽试验(盆钵直径25 cm, 高40 cm)。盆栽用土为东北地区典型潮棕壤土, pH 5.46, 含有机质17.8 g·kg-1、全氮1.36 g·kg-1、碱解氮52.9 mg·kg-1、速效磷22.7 mg·kg-1、速效钾83.5 mg·kg-1。以常规施氮量180 kg·hm-2为对照(N100), 氮肥减施处理用量分别为常规用量的85%(N85, 153 kg·hm-2)、55%(N55, 99 kg·hm-2)。磷肥和钾肥均采用75 kg·hm-2的常规施肥量。按照不同施氮量称取相应肥料与土壤混合装盆, 每种施氮量种植21盆。玉米种子催芽后播种, 盆钵置于光照培养箱中, 出苗后每盆定苗3株。培养箱温度设置为28 ℃/18 ℃(昼/夜), 其他条件按照常规设置。培养28 d后, 将不同施氮量处理的玉米幼苗从光照培养箱中取出并分别按照下述不同方案收集根系分泌物: 1)土壤沥出液收集法(soil leachate, SL):按照Zhu等[9]的方法并稍作修改, 将带苗盆钵置于烧杯上, 缓慢将蒸馏水经由植株茎基部浇入土壤, 收集盆钵底部土壤沥出液, 经0.45 mm滤膜过滤后, 收集滤液于-80 ℃冰箱冻存。2)根鞘土收集法(rhizosheath soil, RS):按照Ma等[10]的方法并稍作修改, 将玉米幼苗小心从土壤中分离, 注意保留根鞘土, 将带有根鞘土的玉米根系在装有蒸馏水的离心管中反复浸洗, 将收集到的土水混合物涡旋震荡30 s, 6 700 r·min-1离心10 min, 收集上清液于-80 ℃冰箱冻存。3)短期水培养收集法(distilled water cultivation, DWC):按照Valentinuzzi等[11]的方法并稍作修改, 将土壤培养的玉米幼苗根系冲洗干净, 转移到装有蒸馏水的培养瓶中, 培养瓶外部用锡箔纸包裹, 对根部做遮光处理, 继续在光照培养箱内培养, 6 h后取出, 经0.45 mm滤膜过滤培养液, 收集滤液于-80 ℃冰箱冻存, 为将该方案与常规营养液液体培养收集法相区分, 将其称为短期水培养收集法。同时, 按照SL方法收集无植物土壤培养的沥出液为空白对照(CK)。每种样品收集方案中各施氮量处理分别重复6次, 无植物土壤培养对照重复3次。
1.2 核磁共振氢谱(1H NMR)采谱采用真空冷冻干燥器将冻存的根系分泌物样品干燥。干燥后样品加入650 μL磷酸盐缓冲液[0.1 mol·L-1, pH=7.0, H2O: D2O=9: 1, 内含1 mmol·L-1 3-三甲基甲硅烷基丙酸-d4钠盐(TSP)], 18 000 g离心20 min, 取600 μL上清液转移到核磁管中进行检测。用核磁共振波谱仪(Bruker Biospin, AV 600, Germany)调用zg 30脉冲序列进行1H NMR采集。600 MHz、300 K条件下, 对FID进行128 T累加, 谱图宽度设为6 009 Hz、采样点数为32 k, 每次扫描在3.5 s内完成。将所得NMR谱图用TopSpin软件进行自动Fouier变化、相位校正和基线校正, 并将TSP的甲基质子信号的峰值位移定位为零(δ 0), 对化学位移进行定标。
1.3 数据处理及统计分析使用MestRe-C软件将整个谱图(δ 9~-0.04)以δ 0.04区间为单位积分, 其中删除残留水峰区(δ 4.55~4.95)。为消除样本个体间浓度差异的影响, 把TSP峰面积定位为1进行数据归一化处理。为增加各个变量在不同样本中的可比性, 按照Par标度化(Par-scaling)方法进行数据中心化及标准化处理。将处理后的数据矩阵导入SIMCA-P13.0软件进行偏最小二乘法-判别分析(Partial least squares projection to latent structures- discriminant analysis, PLS-DA)。采用SPSS 13.0对指认代谢物的相对含量进行单因素方差分析。
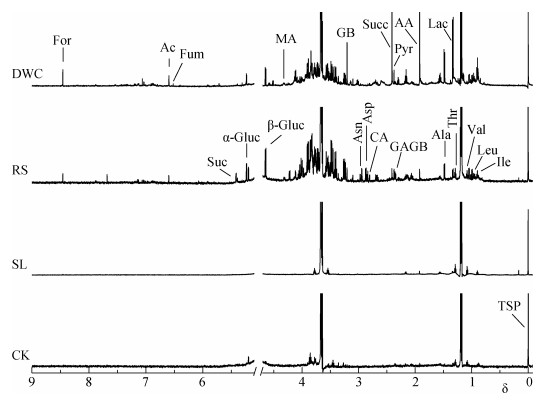
2 结果与分析 2.1 不同收集方法的玉米幼苗根系分泌物的1H NMR谱图本研究基于玉米土壤培养, 分别收集了玉米幼苗的根系土壤沥出液(SL)、根鞘土浸提液(RS)、根系水培养液(DWC)内的根系分泌物, 同时以无植物培养的土壤为对照(CK)。因不同施氮量下不同根系分泌物收集方案获得的谱图轮廓相似, 此处仅以常规施氮量为例进行分泌物指认和谱图比较。研究结果表明:在常规施氮量条件下, 不同收集方式获取的根际及根系分泌物提取液的核磁共振氢谱图有明显差别(图 1)。SL与CK的谱图轮廓相似; 与SL法比较, RS和DWC法可获得较多的峰信号。根据核磁波谱数据库和文献[12]对核磁共振氢谱的主要特征谱峰进行归属, 如图 1所示。可能是由于特定根系分泌物发生了局部沉积或者是微生物的降解作用以及土壤颗粒的吸附作用, 3种收集方案获取的根系分泌物的数量上有所不同。采用RS和DWC根系分泌物收集方法并结合1H NMR代谢组学技术平台可以检测到玉米幼苗根系分泌物中有糖、有机酸、氨基酸等组分。
|
图 1 不同收集方法的常规施氮下玉米幼苗根系分泌物的典型1H NMR谱图 Figure 1 Typical 1H NMR spectra of root exudates of maize seedlings collected by different methods conventional nitrogen application CK:无植物对照; SL:土壤沥出; RS:根鞘土; DWC:根系水培养。Leu:亮氨酸; Ile:异亮氨酸; Val:缬氨酸; Thr:苏氨酸; Lac:乳酸; Ala:丙氨酸; AA:乙酸; Pyr:丙酮酸; Succ:琥珀酸; CA:柠檬酸; Asp:天冬氨酸; GB:甜菜碱; MA:苹果酸; Asn:天冬酰胺; GAGB: γ-氨基丁酸; Suc:蔗糖; β-Gluc: β-葡萄糖; α-Gluc: α-葡萄糖; Fum:延胡索酸; Ac:乌头酸; For:甲酸。 CK: control without plants; SL: soil leachate; RS: rhizosheath soil; DWC: distilled water cultivation. Leu: leucine; Ile: isoleucine; Val: valine; Thr: threonine; Lac: lactate; Ala: alanine; AA: acetate; Pyr: pyruvate; Succ: succinate; CA: citrate; Asp: aspartate; GB: glycinebataine; MA: malate; Asn: asparagine; GAGB: γ-amino-butyrate; Suc: sucrose; β-Gluc: β-glucose; α-Gluc: α-glucose; Fum: fumarate; Ac: aconitic acid; For: formate. |
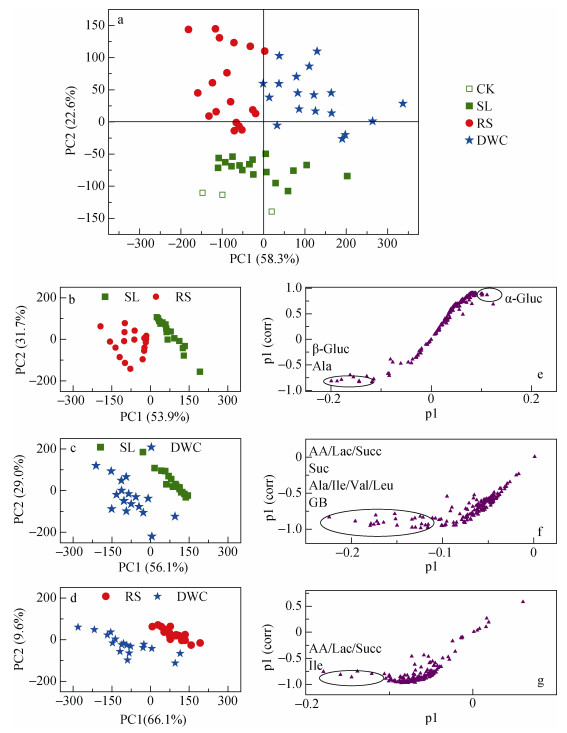
采用代谢组学数据简化和降维的常用方法即PLS-DA对不同收集方式的常规施氮处理下玉米幼苗根系分泌物的1H NMR轮廓进行判别分析。结果表明: 3种收集方法提取液中的代谢物轮廓呈现明显的分组; SL与CK分组不明显(图 2a)。其中, 对SL法与RS法代谢物轮廓分组贡献较大的主要标记物为葡萄糖和丙氨酸(图 2b, e); 对SL法与DWC法代谢物轮廓分组贡献较大的主要标记物为乙酸、乳酸、琥珀酸、蔗糖、丙氨酸、亮氨酸、异亮氨酸、缬氨酸和甜菜碱(图 2c, f); 对RS法与DWC法代谢物轮廓分组贡献较大的主要标记物为乙酸、乳酸、琥珀酸和异亮氨酸(图 2d, g)。RS和DWC两种方案的代谢物轮廓与对照组的分离效果均较好。
|
图 2 不同收集方法的常规施氮量下玉米幼苗根系分泌物轮廓的PLS-DA分析 Figure 2 PLS-DA of metabolite profiles of root exudates of maize seedlings under conventional nitrogen application obtained with different methods CK:无植物对照; SL:土壤沥出; RS:根鞘土; DWC:根系水培养。a、b、c和d是得分图; e、f和g为特征代谢物筛选图。Ala:丙氨酸; Ile:异亮氨酸; Leu:亮氨酸; Val:缬氨酸; Suc:蔗糖; β-Gluc: β-葡萄糖; α-Gluc: α-葡萄糖; AA:乙酸; Lac:乳酸; Succ:琥珀酸; GB:甜菜碱。 CK: control without plants; SL: soil leachate; RS: rhizosheath soil; DWC: distilled water cultivation. Figure a, b, c and d are score plots. Figure e, f and g are metabolites screening for discrimination. Ala: alanine; Ile: isoleucine; Val: valine; Suc: sucrose; β-Gluc: β-glucose; α-Gluc: α-glucose; AA: acetate; Lac: lactate; Succ: succinate; GB: glycinebataine. |
从图 3可以看出, 在不同施氮量条件下, 根鞘土浸提(图 3a, 3b, 3c的1H NMR谱图轮廓与短期水培养收集图 3d, 3e, 3f)的根系分泌物有明显差别; 同时, 同种收集方式下随着施氮量的不同, 整个1H NMR谱图轮廓亦发生一定程度的变化。由表 1可知, 与氮肥常量施用比较, 在氮肥减施条件下, 仅有α-葡萄糖显著增加(变幅高达1.44倍, P < 0.05), 其他玉米幼苗根鞘土内的分泌物水平没有发生显著性改变; 短期水培养的根系分泌物水平变化相对明显, 苹果酸、亮氨酸、缬氨酸显著增加, 变幅分别为1.32倍、1.20倍和1.46倍, 但是随着氮肥减施量的增加, 这些代谢物水平不再继续增加, 呈下降趋势。

|
图 3 不同施氮量下的玉米幼苗根系分泌物的典型1H NMR谱图 Figure 3 Typical 1H NMR spectra of root exudates of maize seedlings grown under different nitrogen fertilizer rates 图a、b、c分别为100%(180 kg·hm-2)、85%和55%施氮量下的根鞘土浸提; 图d、e、f分别为100%(180 kg·hm-2)、85%和55%施氮量下的根系水培养。 Spectra of figure a, b and c are obtained using method of rhizosheath soil extraction (RS) from treatments of 100%-, 85%-and 55%-N application rate (N100, N85 and N55), respectively; spectra of figure d, e and f are obtained using method of roots distilled water cultivation (DWC) from treatments of 100%-, 85%-and 55%-N application rate (N100, N85 and N55), respectively. |
| 表1 相对于常规施氮量不同减氮处理[85%(N85)和55%(N55)常规施氮量]下玉米幼苗根系分泌代谢物的变化比 Table 1 Change rates of metabolites in root exudates of maize seedlings under different reduced-nitrogen application conditions [85% (N85) and 55% (N55) conventional nitrogen application] relative to conventional nitrogen application (180 kg·hm-2) |
根际代谢组学旨在分析整个根土交互界面的代谢物组, 包括与植物根系分泌作用相关的初生代谢物、化学信号物质等, 以及与根系相关的微生物菌群的分泌物[6]。最早, Fan等[12]基于营养液培养法, 建立了小麦(Triticum aestivum L.)、大麦(Hordeum vulgare L.)和水稻(Oryza sativa L.)根系分泌物的NMR非靶标分析的工作流程。随后, Escudero等[4]采用1H NMR分析了在灭菌沙培条件下西红柿(Lycopersicon esculentum L.)幼苗根系分泌物。精确对根系分泌物的数量和构成进行分析需要合理的试验设计。如前所述, 虽然采用营养液、灭菌沙等基质进行植物培养并收集根系分泌物的方法具有控制土壤环境噪音干扰的优势, 但是其无法模拟植物的实际生境而存在局限性。本研究结合玉米土壤盆栽培养实验, 对经过土壤沥出、根鞘土浸提及短期水培养收集的根系分泌物进行了1H NMR分析, 结果表明不同收集方法的根系分泌物的1H NMR谱图轮廓及主要标志物明显不同, 根鞘土浸提和土培结合短期水培养均可用于根际代谢组学研究。
尽管我们将3种方案的收集物均称为根系分泌物, 实际上SL和RS法的收集物是根系分泌物和微生物分泌物、分解物的混合物[9]。但是这两种方法可提供田间土壤培养条件下植物根际的真实信息, 尤其适合用来探究植物与根际微生物发生相互作用之后的化学组成变化, 解读根系分泌物的生态功能。将植物的土壤培养与短期水培养相结合的DWC方法, 可最大限度地控制由于土壤异质性存在的环境噪音干扰。在自然田间条件下, 土壤微生物可通过分泌、沉积及其他活动影响根际微区的化学构成[13-15]。尤其是, 一些土壤微生物参与了土壤氮循环[16], 所以考虑土壤微生物群落及活动对氮肥减施条件下根系分泌物构成的影响是非常重要的。在土壤生物多样性的复杂背景下, 根际代谢组学技术有利于真正获取并理解根系分泌物的生态功能及农业意义。植物根系分泌物的种类复杂, 收集方式及根际代谢组学技术平台的灵敏度会限制能够检测的根系分泌物的数量, 尚需结合不同收集方法以及特定靶标分析检测处于皮摩尔水平的某些信号化合物。
3.2 氮肥减施对玉米幼苗根系分泌物的影响增施氮肥是促进玉米籽粒增产及提高生物量的主要策略之一。然而, 增施氮肥导致的氮过剩以及氮利用率降低已经产生土壤酸化、环境污染、土壤微生物活力下降等负面影响[17]。减少氮肥施用量, 控制氮供给, 降低土壤氮损耗风险, 是改善氮利用率促进玉米可持续生产的有效途径。植物固定碳总量的20%~50%可以转移到根系, 其中10%~18%经由根系分泌物释放到土壤中[18]。根系分泌物的分泌过程同时依赖于植物的生理状态和土壤的营养有效性。土壤营养有效性的高低会影响植物源向根系分泌物的分配。本研究表明, 与常规施氮量比较, 减氮条件下, 除α-葡萄糖显著增加外, 玉米幼苗根鞘土内的分泌物水平基本上没有发生显著改变; 短期水培养的根系分泌物水平的变化相对明显, 苹果酸、亮氨酸、缬氨酸显著增加, 但是随着氮肥减施量的增加, 这些代谢物水平不再继续增加, 呈下降趋势。
根系分泌物中的糖和糖醇可作为许多微生物的能量源和通用的趋化性物质[9, 19]。根系分泌物中的苹果酸可能与特定的促进根围细菌向化吸引的植物生长有关系。植物根系分泌物中的碳水化合物和氨基酸可以作为向化因子引诱植物生长, 促进根围细菌到植物根际区域从而有助于植物的生长[20]。根系分泌物中数量比较多的糖、氨基酸和有机酸等组分和植物应对土壤营养供应不足的适应性调整有关[1, 9]。这种适应性的分子机制尚不十分清楚, 但是可能与植物内源激素有关。生长素促进质膜H+-ATPase活性增加, 为次级主动运输过程提供了更强的驱动力, 从而可将渗漏的糖、有机酸和氨基酸再次回输[21]。
根系分泌物在植物避免重金属毒害, 土壤电性的产生, 蛋白或药化物质的生成, 寄生虫、病原菌及其天敌的相互作用, 微生物生长的促进方面均发挥了重要作用[18]; 另外, 植物可通过根系分泌物的增溶作用、还原/配位作用、配体交换反应影响土壤营养有效性[11]。有研究表明, 根系分泌物的释放可以通过增加土壤碳素有效性(输入水溶性碳)而降低潜在的氮损耗风险[22]。Carvalhais等[21]基于液体培养的研究结果表明, 氮亏缺条件下玉米根系分泌物中的氨基酸(尤其是天冬氨酸、酪氨酸、异亮氨酸、赖氨酸)和麦芽糖含量下降。Zhu等[9]研究表明, 土壤沥出液中玉米根系分泌物总量随着施氮量的增加而增加。与无氮施加对照比较, 在320 kg·hm-2的高氮条件下(高出最适量的2.0~3.2倍), 玉米根系分泌物中的糖、糖醇、酚显著增加, 而羧酸类化合物、胺类、多元醇、脂类在两种施氮量下没有显著差异。上述研究结果均表明, 氮素水平可影响玉米根系分泌物的数量和构成, 而特定根系分泌物的数量水平与氮量之间的关系尚存歧义。这可能是由于根系分泌物的构成和数量随着植物生长的外部环境条件, 如土壤类型、元素含量、pH、温度、微生物的存在而发生变化[20, 23]。另一个影响根系分泌物构成和数量的重要因子是植物固有的生物学特性, 如植物种类、品系和发育阶段。例如, M nchgesang等[24]根据根系分泌物的非靶标代谢物轮廓分析发现, 19个拟南芥(Arabidopsis thaliana L.)种质材料的根际化学构成存在自然遗传变异。为适应不同的环境, 植物根际存在高水平的化学多样性。在氮肥减施条件下, 不同玉米品种在不同生育时期及土壤环境条件下的根系分泌物数量和构成尚需进一步研究。为获取优化根际内氮平衡、提高氮利用率的有效解决途径, 根系分泌物及整个根土界面内代谢物组的无偏分析与植物组织内代谢物组的协同分析将有助于探查出土壤环境中引发植物促进生长的特定信号分子及植物内在的环境适应机制。
综上所述, 本文研究结果表明, 与常规施氮量比较, 在85%施氮量下, 玉米幼苗根系分泌物中的α-葡萄糖、苹果酸、亮氨酸、缬氨酸水平显著增加; 而当施氮量减少到55%时, 玉米幼苗根系分泌物水平不再显著增加并呈现下降趋势, 受施氮量影响变化显著, 这可能和玉米根系对土壤氮营养供应水平的适应性调节有关。采用RS和DWC法收集根系分泌物并结合1H NMR技术进行根际代谢组学分析, 可为根际生态及根际氮素营养研究提供重要理论依据。
| [1] |
严小龙, 廖红, 年海. 根系生物学:原理与应用[M]. 北京: 科学出版社, 2007: 1-305.
YAN X L, LIAO H, NIAN H. Roots Biology:Principles and Applications[M]. Beijing: Science Press, 2007: 1-305. |
| [2] | VAN DAM N M, BOUWMEESTER H J. Metabolomics in the rhizosphere:Tapping into belowground chemical communication[J]. Trends in Plant Science, 2016, 21(3): 256–265. DOI:10.1016/j.tplants.2016.01.008 |
| [3] | STREHMEL N, BÖTTCHER C, SCHMIDT S, et al. Profiling of secondary metabolites in root exudates of Arabidopsis Thaliana[J]. Phytochemistry, 2014, 108: 35–46. DOI:10.1016/j.phytochem.2014.10.003 |
| [4] | ESCUDERO N, MARHUENDA-EGEA F C, IBANCO-CAÑETE R, et al. A metabolomic approach to study the rhi-zodeposition in the tritrophic interaction:Tomato, Pochonia chlamydosporia and Meloidogyne javanica[J]. Me-tabolomics, 2014, 10(5): 788–804. |
| [5] |
罗庆, 孙丽娜, 胡筱敏. 镉超富集植物东南景天根系分泌物的代谢组学研究[J]. 分析化学, 2015, 43(1): 7–12.
LUO Q, SUN L N, HU X M. Metabonomics study on root exudates of Cd hyperaccumulator Sedum alfredii[J]. Chinese Journal of Analytical Chemistry, 2015, 43(1): 7–12. |
| [6] | RUGOVA A, PUSCHENREITER M, KOELLENSPERGER G, et al. Elucidating rhizosphere processes by mass spectrometry-A review[J]. Analytica Chimica Acta, 2017, 956: 1–13. DOI:10.1016/j.aca.2016.12.044 |
| [7] | SUN C X, CHEN X, CAO M M, et al. Growth and metabolic responses of maize roots to straw biochar application at dif-ferent rates[J]. Plant and Soil, 2017, 416(1/2): 487–502. |
| [8] |
李春霞, 吴凤芝. 根系分泌物的收集及其介导的种间互作[J]. 西北农业学报, 2016, 25(6): 795–803.
LI C X, WU F Z. Advances of root exudates collection and root exudates mediated interspecific interactions[J]. Acta Ag-riculturae Boreali-Occidentalis Sinica, 2016, 25(6): 795–803. DOI:10.7606/j.issn.1004-1389.2016.06.001 |
| [9] | ZHU S S, VIVANCO J M, MANTER D K. Nitrogen fertilizer rate affects root exudation, the rhizosphere microbiome and nitrogen-use-efficiency of maize[J]. Applied Soil Ecology, 2016, 107: 324–333. DOI:10.1016/j.apsoil.2016.07.009 |
| [10] | MA W, LI X X, LI C J. Modulation of soil particle size and nutrient availability in the maize rhizosheath[J]. Pedosphere, 2011, 21(4): 483–490. DOI:10.1016/S1002-0160(11)60150-1 |
| [11] | VALENTINUZZI F, PⅡ Y, VIGANI G, et al. Phosphorus and iron deficiencies induce a metabolic reprogramming and affect the exudation traits of the woody plant Fragaria×ananassa[J]. Journal of Experimental Botany, 2015, 66(20): 6483–6495. DOI:10.1093/jxb/erv364 |
| [12] | FAN T W M, LANE A N, PEDLER J, et al. Comprehensive analysis of organic ligands in whole root exudates using nu-clear magnetic resonance and gas chromatography-mass spectrometry[J]. Analytical Biochemistry, 1997, 251(1): 57–68. DOI:10.1006/abio.1997.2235 |
| [13] | FISCHER H, ECKHARDT K U, MEYER A, et al. Rhizodep-osition of maize:Short-term carbon budget and composi-tion[J]. Journal of Plant Nutrition and Soil Science, 2010, 173(1): 67–79. DOI:10.1002/jpln.v173:1 |
| [14] | TIWARI S, SINGH P, TIWARI R, et al. Salt-tolerant rhizo-bacteria-mediated induced tolerance in wheat (Triticum aes-tivum) and chemical diversity in rhizosphere enhance plant growth[J]. Biology and Fertility of Soils, 2011, 47: 907–916. DOI:10.1007/s00374-011-0598-5 |
| [15] | PROCTOR C, HE Y H. Quantifying root extracts and exu-dates of sedge and shrub in relation to root morphology[J]. Soil Biology and Biochemistry, 2017, 114: 168–180. DOI:10.1016/j.soilbio.2017.07.006 |
| [16] | COSKUN D, BRITTO D T, SHI W M, et al. How plant root exudates shape the nitrogen cycle[J]. Trends in Plant Science, 2017, 22(8): 661–673. DOI:10.1016/j.tplants.2017.05.004 |
| [17] |
闫湘, 金继运, 何萍, 等. 提高肥料利用率技术研究进展[J]. 中国农业科学, 2008, 41(2): 450–459.
YAN X, JIN J Y, HE P, et al. Recent advances in technology of increasing fertilizer use efficiency[J]. Scientia Agricultura Sinica, 2008, 41(2): 450–459. |
| [18] | KUIJKEN R C P, VAN EEUWIJK F A, MARCELIS L F M, et al. Root phenotyping:From component trait in the lab to breeding[J]. Journal of Experimental Botany, 2015, 66(18): 5389–5401. DOI:10.1093/jxb/erv239 |
| [19] | BAUDOIN E, BENIZRI E, GUCKERT A. Impact of artificial root exudates on the bacterial community structure in bulk soil and maize rhizosphere[J]. Soil Biology and Bio-chemistry, 2003, 35(9): 1183–1192. DOI:10.1016/S0038-0717(03)00179-2 |
| [20] | HUANG X F, CHAPARRO J M, REARDON K F, et al. Rhi-zosphere interactions:Root exudates, microbes, and mi-crobial communities[J]. Botany, 2014, 92(4): 267–275. DOI:10.1139/cjb-2013-0225 |
| [21] | CARVALHAIS L C, DENNIS P G, FEDOSEYENKO D, et al. Root exudation of sugars, amino acids, and organic acids by maize as affected by nitrogen, phosphorus, potassium, and iron deficiency[J]. Journal of Plant Nutrition and Soil Science, 2011, 174(1): 3–11. DOI:10.1002/jpln.v174.1 |
| [22] | FISK L M, BARTON L, JONES D L, et al. Root exudate carbon mitigates nitrogen loss in a semi-arid soil[J]. Soil Bi-ology and Biochemistry, 2015, 88: 380–389. DOI:10.1016/j.soilbio.2015.06.011 |
| [23] | LUO Q, WANG S Y, SUN L N, et al. Metabolic profiling of root exudates from two ecotypes of Sedum alfredii treated with Pb based on GC-MS[J]. Scientific Reports, 2017, 7: 39878. DOI:10.1038/srep39878 |
| [24] | MÖNCHGESANG S, STREHMEL N, SCHMIDT S, et al. Natural variation of root exudates in Arabidopsis thaliana-linking metabolomic and genomic data[J]. Scientific Reports, 2016, 6: 29033. DOI:10.1038/srep29033 |
 2018, Vol. 26
2018, Vol. 26



