2. 作物生态与分子生理学福建省高校重点实验室/福建农林大学生命科学学院 福州 350002
2. Key Laboratory of Crop Ecology and Molecular Physiology of Fujian Province University/College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, China
镉(Cd)具有生物蓄积性强、毒性持久及“致突变、致畸、致癌”作用[1]。环境中的镉极易通过生物循环进入食物链, 进而危害人体健康[2]。据2014年中国环境状况公报, 我国土壤Cd污染面积达2×105 km2, 约占耕地总面积的1/6。我国已有11个污水灌溉区的土壤镉含量严重超标, 年产镉米5×104 t, 仅沈阳市张士灌区就约有2 533 hm2的农田遭受镉污染, 其中13%的面积为严重污染, 水稻糙米的镉浓度高达0.4~1.0 mg·kg-1; 江西省大余县镉污染农田面积达5 500 hm2, 严重污染的面积占12%[3]; 上海的沙川灌区、广东的广州、韶关地区、广西的阳朔以及湖南的衡阳等地均可能产生镉米[4]。农田镉污染已严重威胁我国的粮食安全, 如何控制农田镉污染已成为当前农业生产中亟待解决的难题。植物、微生物等生物修复技术因具无二次污染、不破坏土壤环境、处理时间短、投资少、操作简单、适应性广、金属选择性高等特点倍受人们关注[5]。铜绿假单胞菌(Pseudomonas aeruginosa)是一种植物根际促生菌, 其根际集群能力强、世代时间短, 能分泌植物抗病及生长调节物质等, 已被用作生防菌[6-7]。铜绿假单胞菌还具较强的重金属耐性与富集能力, 可望用于重金属污染环境的修复, 因而备受人们关注[8-12]。Sinha等[8]从污水中分离出1株铜绿假单胞菌, 其细胞内镉浓度高达8 mmol·L-1, 经Zn2+和Cd2+诱导的菌株Co2+耐性浓度达3 mmol·L-1[9], 而菌株产生的表面活性剂对Cu2+和Zn2+的去除率分别达63.7%、15.3%[10]; 铜绿假单胞菌经聚合物固定制备的菌剂对Cu2+的最大吸附容量达0.34 mmol·g-1(约21.7 mg·g-1)[11]。可见, 将具有较强重金属耐性和富集能力的铜绿假单胞菌制成菌剂用于农田重金属污染修复, 可为农产品安全生产提供技术支持[12]。现有可供选择的菌剂载体种类繁多、性能各异, 以硅藻土和活性炭等载体具良好的吸附性能最为常见。活性炭纤维对镉离子的吸附率最高达85%[13], 而硅藻土原土对重金属离子Pb(Ⅱ)、Cu(Ⅱ)的去除率为15.92%、3.92%[14], 已有用硅藻土做荧光假单胞菌P13菌剂的载体的研究报道[15]。但目前针对铜绿假单胞菌的研究仍然主要停留在研究其对重金属的耐性与去除率上, 鲜见铜绿假单胞菌菌剂用于水稻镉污染修复的研究报道。本课题组前期从水稻根际分离出1株具有镉富集作用的铜绿假单胞菌, 耐镉浓度为700 mg·L-1[16], 并对水稻生长具有一定的促进作用[17], 但有关该菌株及其菌剂对水稻生长及镉积累的研究尚少见报道。为此, 本文拟通过水培试验, 考察菌株载体、菌液及其制备的菌剂对水稻生长及镉积累的影响, 为菌株应用于水稻镉污染修复提供理论依据。
1 材料与方法 1.1 材料培养与试验设计供试水稻为抗镉水稻品种‘PI312777’[18], 菌株为前期从水稻根际分离出的铜绿假单胞菌。菌剂载体材料硅藻土购买自上海秋草园艺设备有限公司, 硅藻土A的粒径为1~3 mm, 硅藻土B的粒径为3~6 mm; 颗粒状活性炭购买自上海展云化工有限公司, 比表面积约为1 000 m2·g-1。
试验设置11个处理, 对比研究菌液、菌剂对水稻生长及镉吸收的影响: 1)无镉无菌(CK); 2)Cd; 3)Cd+菌液A; 4)Cd+菌液B; 5)Cd+菌液C; 6)Cd+硅藻土A; 7)Cd+硅藻土B; 8)Cd+活性炭; 9)Cd+菌剂A; 10)Cd+菌剂B; 11)Cd+菌剂C。各处理3次重复, 具体处理详见表 1。菌剂的制备方法参照文献[12]。分别称取等质量的硅藻土A、硅藻土B和活性炭于烧杯中, 经121 ℃间歇式高压灭菌30 min两次后, 65 ℃烘干后用于制备菌剂。在无菌条件下, 参照3种载体材料的吸水率(硅藻土A、硅藻土B和活性炭依次为60.3%、43.3%和23.4%)加入铜绿假单胞菌菌液(以在37 ℃培养24 h的铜绿假单胞菌悬液计, 浓度为3.21×107 CFU·mL-1), 混匀并保持载体湿润、疏松、不结块, 制成菌剂A、菌剂B和菌剂C, 用于后续试验。不同菌液活菌数为:菌液A, 2.90×109 CFU; 菌液B, 2.08×109 CFU; 菌液C, 1.13×109 CFU。不同菌剂接种后的活菌数量大小为:菌剂A(2.90×109 CFU) > 菌剂B(2.08×109 CFU) > 菌剂C(1.13×109 CFU)。水稻盆栽试验在玻璃温室中进行。将3叶期的水稻“PI312777”秧苗移栽至装有10 L营养液的塑料盆(50 cm×40 cm×15 cm)中, 每盆20株, 秧苗采用泡沫板分隔、海绵固定, 营养液采用国际水稻研究所常规配方[19], pH 5.5左右, 每7 d更换1次营养液。在水稻生长至5叶期时进行处理, 水培4周后, 取样, 测定水稻的生长状况及各部位的镉含量。
| 表1 水培试验各处理的镉、载体、菌液及菌剂添加量 Table 1 Amounts ofCd2+, bacteria suspensions, carriers and microbial inoculum in different treatments of hydroponic experiment |
水稻水培4周后, 采样各处理水稻植株, 植株根部经EDTA-Na2浸泡去除表面吸附的镉后, 用去离子水淋洗3次, 以吸水纸吸干根部, 然后用直尺分别测量水稻株高、根长; 采集的植株按根、茎鞘和叶3个组分分别取样。根、茎鞘和叶样品经105 ℃杀青1 h、72 ℃烘干后称重, 生物量以干重表示。最后, 各样品经粉碎、过筛后用于镉含量测定。各处理3次重复。
镉含量测定采用原子吸收火焰光度计法。根、茎鞘和叶样品采用微波消解, 经0.22 μm滤膜过滤后用于测定。水稻地上部及全株的镉含量为相应组分的加权平均值。迁移系数(transport factor, TF)=地上部镉含量/根部镉含量, 富集系数(biological concentration factor, BCF)=地上部镉含量/营养液镉含量。
1.3 数据处理数据计算和作图采用Microsoft Excel 2007软件进行, 采用SPSS 19.0软件进行单因素方差分析和Duncan多重比较, P=0.05。
2 结果与分析 2.1 菌液、菌剂对水稻生长的影响由图 1A可见, 镉胁迫处理显著抑制了水稻根长、株高的生长和干物质积累, 菌液及菌剂处理后促进了水稻的生长。镉处理水稻根长比对照(15.5 cm)显著降低28.5%。除硅藻土B外, 其余各处理均对水稻的根长具有显著的促进作用。菌剂C处理的根长比镉处理增加了59.5%, 亦比CK高出14.2%;菌液A、菌液B、活性炭及菌剂A处理的比镉处理高出29.7%、50.5%、48.6%和41.4%, 与CK无显著差异; 菌液C、硅藻土A、菌剂B处理的依次比镉处理高出23.4%、18.0%、18.0%, 显著低于CK(图 1A)。
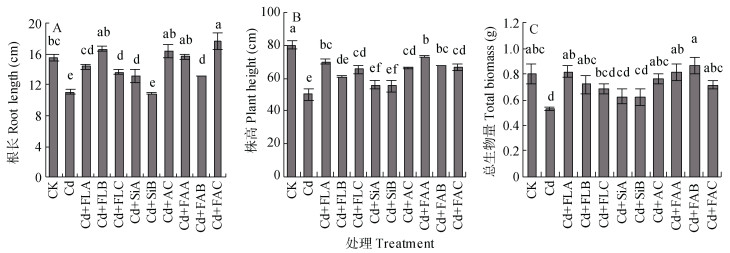
|
图 1 不同菌液与菌剂处理对镉胁迫下水稻的根长(A)、株高(B)和生物量(C)的影响 Figure 1 Root length (A), plant height (B) and biomass (C) of rice treated with different bacterial agents under cadmium stress condition 不同小写字母表示处理间差异显著(P < 0.05)。 Different lowercase letters mean significant differences at 0.05 level among treatments. |
镉处理水稻株高(50.1 cm)比对照(80.3 cm)下降37.6%, 各处理亦显著低于对照(图 1B)。经菌液B、硅藻土A、硅藻土B处理后株高依次增加9.9%、11.8%、22.2%, 处理间差异不显著; 菌液A、菌液C、活性炭及不同菌剂处理后株高增加32.7%~46.4%, 均显著高于镉处理(图 1B)。
镉处理水稻单株生物量(0.52 g)比对照(0.80 g)下降35.0%(图 1C)。菌液C、硅藻土A、硅藻土B处理水稻生物量与镉处理间无显著差异, 其余处理的水稻生物量与对照无显著差异, 但比镉处理的高出38.5%~67.3%, 以菌剂B处理的生物量最高, 达0.87 g(图 1C)。
2.2 菌液、菌剂对水稻镉含量及其迁移能力的影响由图 2A可见, 镉含量在水稻不同部位间存在显著差异, 镉含量平均值从高到低为:根(633.8 mg·kg-1) > 茎鞘(128.5 mg·kg-1) > 叶(33.0 mg·kg-1), 地上部平均镉含量为71.8 mg·kg-1, 显著低于根系(633.8 mg·kg-1)和全株(188 mg·kg-1)。菌剂及活性炭处理显著降低了水稻根、茎鞘、叶的镉含量, 降低幅度依次为17.2%~41.2%、1.4%~59.9%、31.1%~62.6%;镉钝化能力大小为:菌剂C/活性炭 > 菌剂A/B > 菌液A/B > 硅藻土A/B; 菌剂C处理水稻根、茎鞘、叶的镉浓度最低, 分别为500.0 mg·kg-1、68.0 mg·kg-1、21.3 mg·kg-1, 依次比镉处理降低41.2%、59.9%、62.6%;菌剂A处理降低了35.6%、41.8%、58.9%;菌剂B处理降低了33.5%、43.2%、59.0%。经菌剂A、菌剂B、菌剂C及活性炭处理后, 水稻地上部镉含量依次比镉处理(101.3 mg·kg-1)下降了45.9%、47.9%、59.9%和59.9%。经菌剂及活性炭处理后, 水稻全株镉含量为136.2~220.1 mg·kg-1, 显著降低(图 2A)。
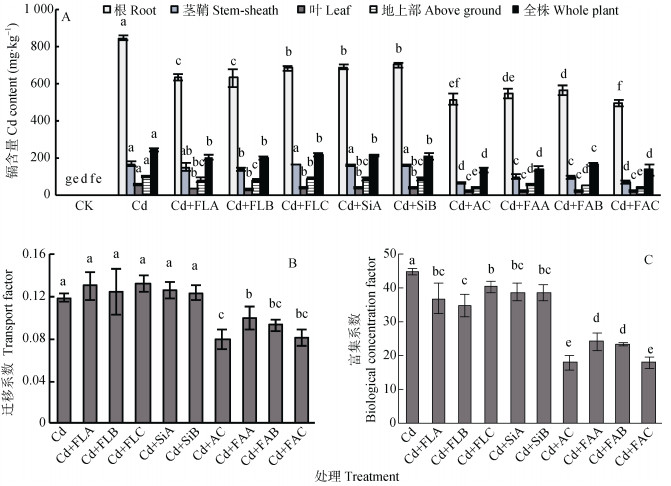
|
图 2 不同菌液与菌剂处理对镉胁迫下水稻各部位镉含量(A)、迁移系数(B)和富集系数(C)的影响 Figure 2 Cadmium contents in organs (A), transport factor (B) and biological concentration factor (C) of rice treated with different bacterial agents under cadmium stress condition 不同小写字母表示处理间差异显著(P < 0.05)。 Different lowercase letters mean significant differences at 0.05 level among treatments. |
从镉的迁移系数(TF)看, 不同处理的镉TF为0.08~0.13。添加空载体硅藻土A、硅藻土B及菌液处理后TF无显著变化, 添加活性炭、菌剂A、菌剂B、菌剂C处理后显著降低了TF, 降低幅度依次为33.3%、16.7%、25.0%和33.3%(图 2B)。从富集系数(BCF)看, 各不同处理均显著抑制了水稻的镉富集作用, 活性炭和菌剂C处理的BCF分别为17.8和18.3, 比镉处理(45.0)降低了60.9%和58.8%, 菌剂A、菌剂B处理的BCF分别为23.6和23.3, 降低了48.1%%和48.8%(图 2C)。
2.3 菌液、菌剂对水稻镉积累的影响从镉积累总量看, 菌液A处理显著提高了镉积累量, 菌液B、菌液C、硅藻土A、硅藻土B及菌剂B处理在一定程度上提高了镉积累量, 但与镉处理无显著差异(图 3)。菌液A、菌液B、菌液C、硅藻土A、菌剂B处理后镉积累量依次增加了30.4%、14.9%、16.9%、5.5%、2.0%、15.0%(图 3)。活性炭、菌剂C处理降低了单株水稻的镉积累, 降低幅度分别为18.2%和24.3%, 菌剂C处理的镉积累量最低(96.8 μg), 是镉处理的75.7%(图 3)。菌剂A处理的镉积累量降低了9.5%, 但与镉处理间无显著差异。
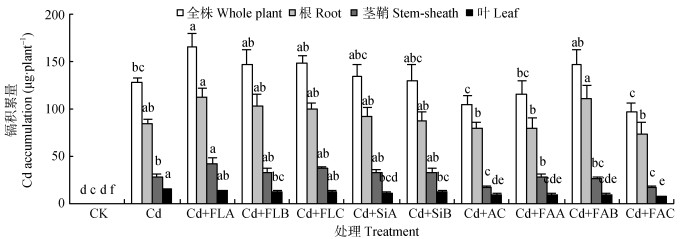
|
图 3 不同菌液与菌剂处理对镉胁迫下水稻镉积累量的影响 Figure 3 Cd accumulation of rice treated with different bacterial agents under cadmium stress condition 不同小写字母表示处理间差异显著(P < 0.05)。 Different lowercase letters mean significant differences at 0.05 level among treatments. |
从各器官镉积累量看, 根是水稻最主要的积累部位, 不同处理水稻的根部镉积累量存在一定的差异, 但与镉处理(85.0 μg)间均无显著差异(图 3); 经菌液A处理的茎鞘的镉积累量显著高于镉处理(28.3 μg), 而活性炭、菌剂C处理的则显著低于镉处理; 经不同菌剂、不同载体、菌液B处理的水稻叶镉积累量均显著低于镉处理(14.6 μg)。
从地上部镉积累量所占的比例看, 菌液A、菌液B、菌液C处理依次比镉处理(42.9%)提高了11.0%, 0.9%、5.8%;活性炭、菌剂A、菌剂B、菌剂C处理则分别降低了18.3%、6.1%、7.6%、19.8%。
3 讨论与结论镉位列重金属污染物“五毒”之首, 可通过迁移、富集对植物产生毒害作用[1-2, 20]。镉胁迫往往导致植物根系伸长受抑、活力降低、根数减少, 影响植物的营养吸收与生长, 最终降低了生物量[21]。本研究表明, 镉胁迫下水稻的株高、根长及干物质积累均显著下降, 这与前人的研究结论一致[18, 22]。添加菌液及菌剂处理显著促进了镉胁迫水稻的生长和干物质积累, 在一定程度上缓解了镉胁迫, 这可能与铜绿假单胞菌具较强的重金属耐性与富集能力, 可通过细胞表面吸附、络合或胞内外富集作用降低了镉毒害有关[8-11, 16]。此外, 铜绿假单胞菌还可通过次生代谢产生的HPO42-等与Cd2+形成难溶的沉淀[23], 通过分泌植物抗病与生长调节物质促进生长, 表现出根际促生菌的作用[6-7]。
添加空载体也在一定程度上促进了水稻生长及其干物质积累, 但不同载体间存在显著差异。活性炭、硅藻土空载体具有疏松多孔的结构, 本身具有一定的重金属吸附能力, 但其比表面积不同, 吸附性能也不同[13-14, 24-27]。天然的硅藻土比表面积一般在19~65 m2·g-1[24], 活性炭的比表面积可高达1 000~3 000 m2·g-1[25], 具有极强吸附能力, 在本研究中表现出显著的镉钝化吸收效应。一些研究表明, 活性炭对Pb2+的吸附率可达90%[26], 生物炭+石灰+硅藻土(BLD)配施处理后土壤有效态镉可降低71.0%[27], 活性炭纤维对镉离子的吸附率最高达85%[13], 而硅藻土原土对重金属离子Pb(Ⅱ)、Cu(Ⅱ)的去除率仅为15.92%、3.92%[14], 因此活性炭比硅藻土具有更显著的镉钝化效应[13-14, 24-27]。但硅藻土与菌液制备成菌剂后, 其对镉胁迫的缓解效应显著大于硅藻土与菌液, 这种增效作用是否与硅藻土和菌株具有较好亲和性, 促进了生长调节物质的分泌或降低了镉的有效性等有关, 有待进一步的研究加以证实。但活性炭与菌液制备成菌剂后并未观察到这种增效作用。
一般地, 镉胁迫水稻各器官的镉含量高低为:根 > 茎鞘 > 稻谷 > 叶片[28], 这与本研究结果:根 > 茎鞘 > 叶片相吻合。菌液、菌剂和空载体处理, 促进了水稻生长, 同时显著降低了各部位的镉含量, 一方面体现了生物量的稀释效应, 另一方面可能通过影响水稻的镉吸收与转运, 降低镉含量。硅藻土和菌液处理并不改变镉在水稻体内的迁移系数, 活性炭和菌剂却显著降低了镉的迁移, 这可能与活性炭对重金属具有极强的吸附有关[13, 26], 也可能是铜绿假单胞菌对镉的结合或通过影响水稻的次生代谢作用, 改变了镉的形态和有效性, 从而影响镉的迁移[28]。硅藻土的吸附性能远低于活性炭, 但与铜绿假单胞菌复合后, 有效地抑制了镉从水稻根部向上的迁移, 降低水稻体内的镉浓度, 对镉胁迫起到一定的缓解作用[16], 这也证明了铜绿假单胞菌具有应用于水稻镉污染修复的潜力。
农业环境重金属污染的治理方法多种多样, 物理、化学及生物修复技术各具优势[29]。活性炭具有优异的吸附性能, 在工业生产中广泛用作脱色剂、吸附剂, 也用于水处理等高附加值的工艺, 效果极佳, 但成本高昂[30]。在农业生产中, 应用活性炭去除环境中的重金属, 投入产出比差, 推广应用难度大[31]。硅藻土的吸附性能虽然不如活性炭, 但环境友好、价格低廉, 已被广泛用作环境治理的材料[32], 与铜绿假单胞菌结合, 制成菌剂后, 对水稻生长既有一定的促进作用, 又可有效降低水稻体内的镉含量, 制备的菌剂在农业生产上具有一定的应用前景[12]。
镉胁迫下, 添加铜绿假单胞菌菌液及菌剂处理显著促进了水稻的生长与干物质积累, 降低了水稻各部位的镉含量与富集量。添加菌剂处理显著降低了镉在水稻体内的迁移系数。铜绿假单胞菌既是一种促生菌, 又可降低水稻对镉的吸收,具有镉污染环境修复的应用前景。
| [1] | THÉVENOD F, LEE W K. Toxicology of cadmium and its damage to mammalian organs[M]//SIGEL A, SIGEL H, SIGEL R K. Cadmium: From Toxicity to Essentiality. Dor-drecht: Springer, 2013 |
| [2] | ZHUANG P, ZOU B, LI N Y, et al. Heavy metal contamina-tion in soils and food crops around Dabaoshan mine in Guangdong, China:Implication for human health[J]. Envi-ronmental Geochemistry and Health, 2009, 31(6): 707–715. DOI:10.1007/s10653-009-9248-3 |
| [3] |
柳絮, 范仲学, 张斌, 等. 我国土壤镉污染及其修复研究[J]. 山东农业科学, 2007(6): 94–97.
LIU X, FAN Z X, ZHANG B, et al. Cadmium pollution soil and its remediation in China[J]. Shandong Agricultural Sci-ences, 2007(6): 94–97. |
| [4] |
徐良将, 张明礼, 杨浩. 土壤重金属镉污染的生物修复技术研究进展[J]. 南京师大学报:自然科学版, 2011, 34(1): 102–106.
XU L J, ZHANG M L, YANG H. Research progress of bio-remediation technology of cadmium polluted soil[J]. Journal of Nanjing Normal University:Natural Science Edition, 2011, 34(1): 102–106. |
| [5] |
钱春香, 王明明, 许燕波. 土壤重金属污染现状及微生物修复技术研究进展[J]. 东南大学学报:自然科学版, 2013, 43(3): 669–674.
QIAN C X, WANG M M, XU Y B. Current situation of soil contamination by heavy metals and research progress in bio-remediation technique[J]. Journal of Southeast University:Natural Science Edition, 2013, 43(3): 669–674. |
| [6] | BANO N, MUSARRAT J. Characterization of a new Pseu-domonas aeruginosa strain NJ-15 as a potential biocontrol agent[J]. Current Microbiology, 2003, 46(5): 324–328. DOI:10.1007/s00284-002-3857-8 |
| [7] | RANE M R, SARODE P D, CHAUDHARI B L, et al. Ex-ploring antagonistic metabolites of established biocontrol agent of marine origin[J]. Applied Biochemistry and Bio-technology, 2008, 151(2/3): 665–675. |
| [8] | SINHA S, MUKHERJEE S K. Cadmium-induced sidero-phore production by a high Cd-resistant bacterial strain re-lieved Cd toxicity in plants through root colonization[J]. Current Microbiology, 2008, 56(1): 55–60. DOI:10.1007/s00284-007-9038-z |
| [9] |
李群, 杨洪江, 林书祥, 等. 铜绿假单胞菌重金属离子耐受性调查及相关机制的研究[J]. 生物技术通报, 2013(6): 160–166.
LI Q, YANG H J, LIN S X, et al. Heavy metal resistance and its related mechanisms in pseudomonas aeruginosa[J]. Bio-technology Bulletin, 2013(6): 160–166. |
| [10] |
明聪聪, 莫创荣, 吴小寅, 等. 生物表面活性剂产生菌的筛选及其对重金属的去除[J]. 广西大学学报:自然科学版, 2014, 39(3): 578–585.
MING C C, MO C R, WU X Y, et al. Isolation of a biosurfactant-producing bacteria and its removal of heavy metals in sludge[J]. Journal of Guangxi University:Natural Science Edition, 2014, 39(3): 578–585. |
| [11] |
罗晓虹, 戴松林, 李雪芳. 固定化铜绿假单胞菌吸附Cu2+的特性[J]. 环境科学与技术, 2008, 31(11): 41–44.
LUO X H, DAI S L, LI X F. Biosorption properties of Cu2+ onto immobilized P. aeruginosa[J]. Environmental Science & Technology, 2008, 31(11): 41–44. DOI:10.3969/j.issn.1003-6504.2008.11.012 |
| [12] |
王微, 李圆萍, 谢惠玲, 等. 铜绿假单胞菌菌剂载体的筛选[J]. 福建农林大学学报:自然科学版, 2016, 45(3): 325–330.
WANG W, LI Y P, XIE H L, et al. Screening of carrier for Pseudomonas aeruginosa bacterial agent[J]. Journal of Fujian Agriculture and Forestry University:Natural Science Edition, 2016, 45(3): 325–330. |
| [13] |
朱冬冬, 任淑华. 活性炭纤维对镉离子吸附性能的研究[J]. 当代化工, 2013, 42(10): 1383–1384.
ZHU D D, REN S H. Study on adsorption performance of activated carbon fibers for cadmium ions[J]. Contemporary Chemical Industry, 2013, 42(10): 1383–1384. DOI:10.3969/j.issn.1671-0460.2013.10.010 |
| [14] |
廖经慧. 硅藻土吸附剂的制备及其对重金属离子吸附性能的研究[D]. 北京: 中国地质大学(北京), 2012
LIAO J H. Study on preparation and heavy metals ion adsorption properties of diatomite adsorbent[D]. Beijing: China University of Geosciences (Beijing), 2012 http://cdmd.cnki.com.cn/Article/CDMD-11415-1012364592.htm |
| [15] |
李慧, 王平, 肖明. 硅藻土和滑石粉作为荧光假单胞菌P13菌剂的载体研究[J]. 中国生物防治, 2009, 25(3): 239–244.
LI H, WANG P, XIAO M. Use of diatomite and talc as carri-ers of the Pseudomonas fluorescens P13[J]. Chinese Journal of Biological Control, 2009, 25(3): 239–244. |
| [16] |
周丽英, 叶仁杰, 林淑婷, 等. 水稻根际耐镉细菌的筛选与鉴定[J]. 中国生态农业学报, 2012, 20(5): 597–603.
ZHOU L Y, YE R J, LIN S T, et al. Screening and identifica-tion of cadmium-tolerant bacteria from rhizosphere soils under rice[J]. Chinese Journal of Eco-Agriculture, 2012, 20(5): 597–603. |
| [17] | DE VLEESSCHAUWER D, CORNELIS P, HÖFTE M. Re-dox-active pyocyanin secreted by Pseudomonas aeruginosa 7NSK2 triggers systemic resistance to Magnaporthe grisea but enhances Rhizoctonia solani susceptibility in rice[J]. Molecular Plant-Microbe Interactions, 2006, 19(12): 1406–1419. DOI:10.1094/MPMI-19-1406 |
| [18] |
肖清铁, 王经源, 郑新宇, 等. 水稻根系响应镉胁迫的蛋白质差异表达[J]. 生态学报, 2015, 35(24): 8276–8283.
XIAO Q T, WANG J Y, ZHENG X Y, et al. Analysis of the differently expressed proteins in rice roots in response to cadmium stress[J]. Acta Ecologica Sinica, 2015, 35(24): 8276–8283. |
| [19] | YOSHIDA S, FORNO D A, COCK J H. Laboratory Manual for Physiological Studies of Rice[M]//Laboratory Manual for Physiological Studies of Rice. International Rice Research Institute, 1976 |
| [20] | KAWASHIMA C G, NOJI M, NAKAMURA M, et al. Heavy metal tolerance of transgenic tobacco plants over-expressing cysteine synthase[J]. Biotechnology Letters, 2004, 26(2): 153–157. DOI:10.1023/B:BILE.0000012895.60773.ff |
| [21] | BENAVIDES M P, GALLEGO S M, TOMARO M L. Cad-mium toxicity in plants[J]. Brazilian Journal of Plant Physi-ology, 2005, 17(1): 21–34. DOI:10.1590/S1677-04202005000100003 |
| [22] |
肖美秀, 林文雄, 陈冬梅, 等. 镉胁迫对耐性不同的水稻幼苗膜脂过氧化和保护酶活性的影响[J]. 中国生态农业学报, 2006, 14(4): 256–258.
XIAO M X, LIN W X, CHEN D M, et al. Effects of Cd on the cell membrance lipid peroxidation and activity of protecting enzymes in seedlings of rice with different tolerance to Cd pollutant[J]. Chinese Journal of Eco-Agriculture, 2006, 14(4): 256–258. |
| [23] | MACASKIE L E, DEAN A C R, CHEETHAM A K, et al. Cadmium accumulation by a Citrobacter sp.:The chemical nature of the accumulated metal precipitate and its location on the bacterial cells[J]. Microbiology, 1987, 133(3): 539–544. DOI:10.1099/00221287-133-3-539 |
| [24] |
詹树林, 林俊雄, 方明晖, 等. 硅藻土在工业污水处理中的应用研究进展[J]. 工业水处理, 2006, 26(9): 10–13.
ZHAN S L, LIN J X, FANG M H, et al. Research progress of the application of diatomite to industrial wastewater treat-ment[J]. Industrial Water Treatment, 2006, 26(9): 10–13. DOI:10.11894/1005-829x.2006.26(9).10 |
| [25] |
张春山, 邵曼君. 活性炭材料改性及其在环境治理中的应用[J]. 过程工程学报, 2005, 5(2): 223–227.
ZHANG C S, SHAO M J. Modification of activated carbon material and its applications in environmental protection[J]. The Chinese Journal of Process Engineering, 2005, 5(2): 223–227. |
| [26] | ABDEL-HALIM S H, SHEHATA A M A, EL-SHAHAT M F. Removal of lead ions from industrial waste water by different types of natural materials[J]. Water Research, 2003, 37(7): 1678–1683. DOI:10.1016/S0043-1354(02)00554-7 |
| [27] |
杜彩艳, 段宗颜, 曾民, 等. 田间条件下不同组配钝化剂对玉米(Zea mays)吸收Cd、As和Pb影响研究[J]. 生态环境学报, 2015, 24(10): 1731–1738.
DU C Y, DUAN Z Y, ZENG M, et al. Effects of different combined amendments on cadmium, arsenic and lead absorption of maize under field conditions[J]. Ecology and Environmental Sciences, 2015, 24(10): 1731–1738. |
| [28] |
刘春梅, 罗盛国, 刘元英. 硒对镉胁迫下寒地水稻镉含量与分配的影响[J]. 植物营养与肥料学报, 2015, 21(1): 190–199.
LIU C M, LUO S G, LIU Y Y. Effects of Se on Cd content and distribution in rice plant under Cd stress in cold climate[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(1): 190–199. DOI:10.11674/zwyf.2015.0121 |
| [29] | WU G, KANG H B, Zhang X Y, et al. A critical review on the bio-removal of hazardous heavy metals from contaminated soils:Issues, progress, eco-environmental concerns and op-portunities[J]. Journal of Hazardous Materials, 2010, 174(1/3): 1–8. |
| [30] |
蔡青. 烟气脱汞用活性炭低成本制备方法研究[D]. 徐州: 中国矿业大学, 2015
CAI Q. Study on low-cost preparation technology of activated carbons for flue gas mercury removal[D]. Xuzhou: China University of Mining and Technology, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10290-1015971670.htm |
| [31] | TAN Z Q, SUN L S, XIANG J, et al. Gas-phase elemental mercury removal by novel carbon-based sorbents[J]. Car-bon, 2012, 50(2): 362–371. |
| [32] |
郑水林, 孙志明, 胡志波, 等. 中国硅藻土资源及加工利用现状与发展趋势[J]. 地学前缘, 2014, 21(5): 274–280.
ZHENG S L, SUN Z M, HU Z B, et al. The processing and utilization of China diatomite resource and its development trend[J]. Earth Science Frontiers, 2014, 21(5): 274–280. |
 2018, Vol. 26
2018, Vol. 26



