2. 中山大学环境科学与工程学院 广州 510006
2. School of Environmental Science and Engineering, Sun Yat-sen University, Guangzhou 510006, China
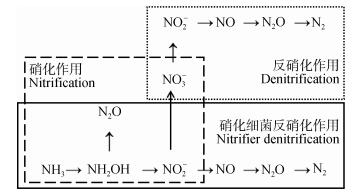
N2O是一种十分重要的温室气体, 在100年的时间尺度里, 其温室效应是CO2的265倍。N2O的排放会造成全球变暖和平流层臭氧的消耗[1]。研究表明, 农业排放占N2O总排放量的79%[2], 其中土壤微生物的硝化和反硝化作用是农业土壤中N2O产生的重要途径, 其微生物转化过程如图 1所示。农业生产活动中, 灌溉、氮肥的施用、作物类型、耕作方式等都可能改变土壤理化特性, 进而影响微生物介导的N2O的产生和排放[3-5]。因此, 分析土壤剖面各层N2O浓度及N2O同位素特征值的垂直分布规律, 不仅有助于甄别土壤N2O的来源, 研究其转换过程及其机理, 而且对如何减少农田土壤N2O产生和排放具有重要的指导意义。
研究N2O产生与转换机制的传统方法包括15N同位素标记法、硝化抑制剂等都受到前体(产生N2O的反应物)同位素的影响以及标记物或者抑制剂扩散不均匀等限制。因此, 目前国内外利用N2O在产生及还原过程中, 15N会发生同位素分馏现象, 来解释N2O的来源[7]。而且针对N2O的氮同位素分馏研究也可以用于野外田间实地条件下N2O残留比的量化[8-10]。
农田土壤特征反映了区域原有的地球化学环境条件的影响。研究表明, 重金属和pH均会显著影响氮的矿化、硝化和反硝化作用[11-12]。重金属还能抑制N2O还原酶在反硝化作用过程中的活性, 使N2O还原成N2的过程受阻而引起土壤中N2O累积, 最终导致N2O排放量的增加[13]。低pH也会降低N2O还原酶活性导致土壤空气中N2O浓度增高[14]。因此, 酸性矿山废水(acid mine drainage, AMD)灌溉农田不仅会造成土壤团粒结构的破坏, 盐基阳离子淋滤加剧, 有机质分解受抑制, 保水保肥能力严重退化[15], 而且土壤重金属积累、低pH形成都可能对N2O还原率产生抑制效应, 从而引发N2O的大量排放[6]。
红壤是我国南方广泛发育和分布的酸性土壤, 由于其性质上存在酸、瘦、黏等弱点, 容易被污染, 导致生态环境恶化。Liu等[16]研究表明, AMD灌溉农田土壤会对负责氮循环的土壤微生物群落产生影响, 从而影响水稻田产生N2O的潜在量。Zhou等[17]通过对AMD灌区农田土壤进行室内培养试验发现, 受到重金属污染的水稻田N2O排放量增加, 重金属对N2O还原为N2的抑制作用大于反硝化过程。李爽等[18]通过对华南红壤地区稻田土壤室内模拟试验发现, 加入Fe(Ⅱ)促进了N2O的生成, 提高了N2O还原基因nosZ的拷贝数; 该研究增加了对华南红壤区稻田体系中的氮、铁循环转化的了解。实际农田环境中氮循环过程十分复杂, N2O产生和转换过程缺乏单一主控制因子[13]。因此, 在野外田间试验条件下, 明确各土层N2O及其同位素分布特征, 探究农田土壤包气带中N2O的产生与转换机制, 以及影响控制因子仍是亟待解决的科学难题。本研究利用组合同位素特征值溯源法, 揭示农田土壤N2O的来源和AMD灌区土壤的潜在生态风险, 为日后的治理修复工作提供了科学依据。
1 材料与方法 1.1 研究区概况研究区位于广东省北部翁源县(113.7°~113.9°E, 24.4°~24.6°N), 属于亚热带季风气候, 年平均气温20.3 ℃, 年均降水量1 782.7 mm, 其上游15 km处的大宝山是一座以铁铜为主的大型多金属矿山。选矿产生的尾砂、废石主要堆放在由两个尾砂坝拦截形成的大型尾矿库内。长期以来库内汇集的AMD排入横石河, AMD具有重金属浓度高、pH低、盐度高等特征, 严重危害了以横石河作为灌溉水源的沿岸农业生产和居民用水。研究区的农田分布在河流阶地上, 其中上坝村曾经长期利用横石河灌溉, 而连心村则取自于没有受AMD影响的太平河灌溉。其中横石河作为农业用水的主要水源, 河水中重金属Cu、Zn、Pb、Cd最大含量超过国家农田灌溉水质标准(GB 5084—92)的3.94倍、11.63倍、4.1倍和18倍。而太平河水Cu、Zn、Pb、Cd总量均符合国家农田灌溉水质标准。
1.2 样品采集与处理为了研究AMD灌溉对农田土壤N2O产生及转换的影响, 分别在AMD灌溉区(上坝村)及天然来水灌溉区(连心村)选取了SG(上坝村甘蔗田)、SS(上坝村水稻田)、LG(连心村甘蔗田)、LS(连心村水稻田)4个采样地, 分别采集不同深度的N2O土壤气体及土壤样品。为了采集水稻田的土壤气体, 采样时间选取水稻田排水期。
现场将获取的非扰动土柱(深度80 cm), 按10 cm间隔进行连续切分, 分别用聚乙烯自封袋盛装带回实验室, 经自然风干后过筛备用。同时, 在每个采样点以10 cm为间隔, 将GVP土壤气体采样套装(AMS, USA)探头顺次击打入所需深度的土壤中, 通过连接探头的聚氟管用60 mL注射器采集土壤气体。在采集气体样品时, 为了避免前次取样存留的气体影响, 弃掉第一次抽取的60 mL土壤气体, 将随后抽取的120 mL土壤空气样品注入已抽真空的顶空瓶与真空袋中。每个样地随机布设5个样点重复上述土壤和气体采集过程, 然后将对应深度的土样和气体样品分别进行等量混合。
1.3 测定项目与方法土壤粒径、重量含水率(以下简称含水率)、pH、土壤阳离子交换量(CEC)、全碳(TC)、全氮(TN)、碳氮比(C/N)、硝酸根(NO3-)及铵根(NH4+)的测定方法均参照《土壤农化分析》(第3版)[19]。土壤重金属含量测定采用HF-HNO3-HClO4法消解土壤样品, 待测液用ICP-OES(5300DV, Perkin-Elmer, USA)测定土壤中Cu、Zn、Pb、Cd、Cr等金属元素。为了确保分析结果的可靠与准确, 每批消解的样品均含有空白样, 土壤标样(GSD-12)及3个平行土样, 所选试剂均为优级纯。标样的重金属回收率均高于90%, 平行样间的标准偏差均在误差允许范围内。
土壤气体N2O浓度及其同位素特征值测定方法分别参照Yamamoto等[20]与Toyoda等[21], N2O浓度利用装备有电子俘获检测器(ECD)气相色谱GC-2014(Shimadzu, JPN)测定。δ15Nbulk、δ15Nα、δ18O同位素特征值利用TraceGas专用取样瓶, 使用ISOPRIME公司生产的TraceGas-IRMS气体样品浓缩系统结合连接的Isoprime-100质谱仪进行测定分析。标准物质主要来自美国地质调查局(USGS32、34、35), 采用国际上通用的两点校正方法对所测定样品进行校正。
1.4 计算方法 1.4.1 N2O同位素特征值计算N2O分子式为Nβ=Nα=O, 这种不对称的直线型结构导致N2O中两个氮原子所处的能量状态不同, 一般用α和β分别表示与氧原子和不与氧原子相连接的氮原子[22]。在同位素分析中, 15N所处位置(α位或β位)不同, 其测量值也不同, 这种直线型结构线性分子N2O内15N的择优占位称为位嗜值(site preference, 简称SP)[23]。由下式分别计算N2O同位素特征值及位嗜值SP。
| $ \delta {}_{}^{15}{{\rm{N}}^i} = {}_{}^{15}R_{{\rm{sample}}}^i/{}_{}^{15}R_{{\rm{standard}}}^i - 1~~~\left( {i = {\rm{bulk}}, \alpha } \right) $ | (1) |
| $ \delta {}_{}^{18}{\rm{O}} = {}_{}^{18}{R_{{\rm{sample}}}}/{}_{}^{18}{R_{{\rm{standard}}}} - 1 $ | (2) |
| $ \delta {}_{}^{15}{{\rm{N}}^{{\rm{bulk}}}} = (\delta {}_{}^{15}{{\rm{N}}^{\rm{ \mathsf{ α} }}} + {\rm{ \mathsf{ δ} }}{}_{}^{15}{{\rm{N}}^{\rm{ \mathsf{ β} }}})/2 $ | (3) |
| $ {\rm{SP}} = \delta {}_{}^{15}{{\rm{N}}^{\rm{ \mathsf{ α} }}} - \delta {}_{}^{15}{{\rm{N}}^{\rm{ \mathsf{ β} }}} $ | (4) |
式中: 15R=15N/14N, 18R=18O/16O; 下标sample和standard分别表示样品和标准样品。δ15Nbulk表示N2O氮稳定同位素比值。
1.4.2 二元混合模型评估N2O来源贡献比为了定量评估N2O各个来源的贡献比通常利用同位素二元混合模型, 较为常用的为SP-δ15Nbulk和SP-δ18O两种混合模型。其中通过“映射方法”将同位素的分馏及混合过程同步量化, 甄别并确定在被还原成N2前, N2O分别来自硝化与反硝化作用的占比。该方法基于纯细菌培养及土培试验所得到的混合线(mixing line)与还原线(reduction line)的斜率定量计算[24-32]。通过两种同位素模型方法分析N2O来源途径, 并计算相关的贡献比。
| $ \delta {\rm{o}} = x \times {\delta _{{\rm{nit}}}} + \left( {1 - x} \right) \times {\delta _{{\rm{denit}}}} $ | (5) |
式中: δo表示N2O还原前的SP值, 下标nit、denit分别表示硝化作用、反硝化作用过程; 而x、1-x分别表示上述2种过程的相应贡献比。
N2O还原为N2的过程发生同位素分馏, 根据同位素分馏方程, 应用封闭系统瑞利模型[22], 则:
| $ \frac{{1 + {\delta _{\rm{r}}}}}{{1 + {\delta _{\rm{o}}}}} = {({r_{{{\rm{N}}_2}{\rm{O}}}})^{{\eta _{{\rm{red}}}}}} $ | (6) |
可近似于:
| $ {\delta _{\rm{r}}} \approx {\delta _{\rm{o}}} + {\eta _{{\rm{red}}}} \times \ln {r_{{{\rm{N}}_2}{\rm{O}}}} $ | (7) |
| $ {F_{\rm{r}}} = 1 - {r_{{{\rm{N}}_2}{\rm{O}}}} $ | (8) |
式中:
δr表示N2O还原后的SP值;
供试土壤含水率、基本化学性质及重金属含量如表 1所示。AMD灌溉区农田土壤含水率明显低于天然来水区农田土壤, 其中甘蔗田表层土壤(0~30 cm)含水率低于水稻田。天然来水区农田土壤pH均值为5.64, 而受到AMD灌溉影响的农田土壤pH最低达3.84。AMD灌溉区农田土壤CEC也明显低于天然来水区农田土壤。土壤(SG、SS、LG、LS)全碳含量都随深度增加而减小, 其中AMD灌溉区农田中下层土壤(30~80 cm)全碳含量低于天然来水区农田土壤。土壤全氮、硝态氮和氨态氮含量垂向分布特征与全碳含量变化趋势相似。AMD灌溉区农田土壤各层Cu、Zn、Pb、Cd含量明显高于连心村, 且均超过国家土壤环境质量二级标准。
| 表 1 供试土壤含水率、化学性质及其重金属含量 Table 1 Moisture contents, chemical characters and contents of heavy metals in the tested soils |
研究区农田土壤包气带N2O浓度垂向分布如图 2所示。不同作物类型的农田土壤剖面N2O浓度分布存在显著性差异(P < 0.05)。甘蔗田土壤N2O浓度高于水稻田, 在30~50 cm土层出现峰值, AMD灌区农田和天然来水区分别为4.73 μmol·mol-1与4.25 μmol·mol-1; 而水稻田土壤N2O浓度随深度的变化不明显, 平均值分别为0.51 μmol·mol-1、0.43 μmol·mol-1。对于同种作物土壤N2O浓度而言, AMD灌溉区有别于天然河水灌溉区, 两者水稻田N2O浓度存在显著差异(P < 0.05), 表明AMD灌溉具有增加土壤N2O浓度的趋势。

|
图 2 酸性矿山废水灌区、天然来水区不同作物田土壤包气带N2O浓度垂向分布特征 Fig. 2 Vertical distribution of N2O concentrations in different crop fields irrigated with acid mine drainage and natural water SG:酸性矿山废水灌溉区甘蔗田; SS:酸性矿山废水灌溉区水稻田; LG:天然来水灌溉区甘蔗田; LS:天然来水灌溉区水稻田。 SG: sugarcane field in acid mine drainage irrigated area; SS: paddy field in acid mine drainage irrigated area; LG: sugarcane field in natural water irrigated area; LS: paddy field in natural water irrigated area. |
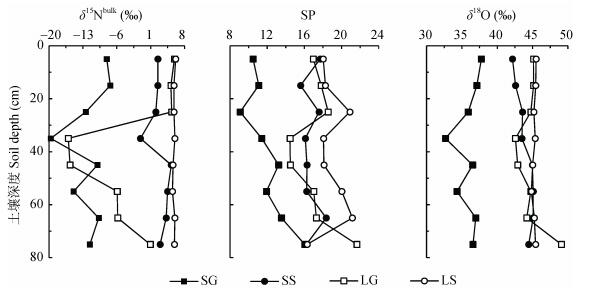
由图 3可知, AMD灌区甘蔗田(SG)的SP值随深度增加逐渐增加, 在地表附近为10.48‰, 在80 cm深处达到16.04‰。天然来水灌溉区甘蔗田(LG)的SP值也随深度增加缓慢增加。而水稻田的SP值随深度增加变化不大, AMD灌区水稻田(SS)和天然来水灌溉区水稻田(LS)平均值分别为16.75‰和18.85‰, 两采样点在80 cm深处仅为16.30‰。
|
图 3 酸性矿山废水灌区、天然来水区不同作物田包气带土壤N2O同位素特征值垂向分布特征 Fig. 3 Vertical distribution of isotope characteristic values of N2O in the aeration zones of different crop fields irrigated with acid mine drainage and natural water SG:酸性矿山废水灌溉区甘蔗田; SS:酸性矿山废水灌溉区水稻田; LG:天然来水灌溉区甘蔗田; LS:天然来水灌溉区水稻田。SP: 15N的位嗜值。 SG: sugarcane field in acid mine drainage irrigated area; SS: paddy field in acid mine drainage irrigated area; LG: sugarcane field in natural water irrigated area; LS: paddy field in natural water irrigated area. SP: site preference of 15N. |
各采样点位包气带剖面N2O同位素特征值(δ15Nbulk、δ18O)垂向变化趋势相似, 其中甘蔗田δ15Nbulk与δ18O在30~50 cm土层出现最小极值, 揭示发生同位素δ15Nbulk与δ18O贫化。水稻田N2O同位素特征值随深度变化较小。同一深度范围, 不同作物土壤δ15Nbulk与δ18O也有所差异, 甘蔗田SG、LG深层土壤(50~70 cm)N2O的δ15Nbulk与δ18O比水稻田SS、LS深层土壤贫化。此外, AMD灌区(SG、SS)表层土壤(0~30 cm)N2O的δ15Nbulk与δ18O比天然来水灌溉区农田(LG、LS)表层土壤贫化。而4个采样点中, AMD灌区甘蔗田(SG)土壤剖面的N2O的3种同位素丰度值均最贫化。
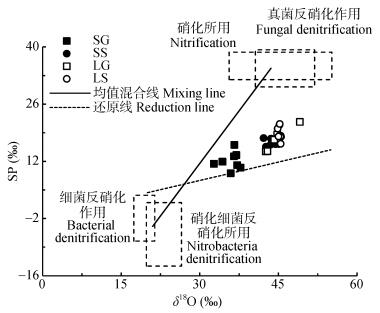
2.4 硝化/反硝化作用对土壤气体N2O的贡献比本文采用SP-δ18O模型对微生物硝化作用、反硝化作用和N2O还原过程的贡献进行定量评估。根据前人研究数据可以综合确定各个微生物过程的SP范围(图 4)。其中微生物硝化作用SP值范围为32.0‰~38.7‰[24-26], δ18O范围为35.6‰~55.2‰[24-26]; 真菌反硝化作用SP值范围为30.2‰~39.3‰[27-29], δ18O范围为40.6‰~51.9‰[27-29]; 细菌反硝化作用SP值范围为-7.5‰~3.7‰[26, 30], δ18O范围为17.4‰~ 21.4‰[31-32]; 硝化细菌反硝化作用SP值范围为-13.6‰~1.9‰[24, 26], δ18O范围为19.8‰~26.5‰[24, 26]。
|
图 4 酸性矿山废水灌区、天然来水区不同作物田土壤SP-δ18O模型分析的N2O产生和消耗途径 Fig. 4 N2O production and consumption pathways analyzed by the model of SP-δ18O of soils of different crop fields irrigated with acid mine drainage and natural water SG:酸性矿山废水灌溉区甘蔗田; SS:酸性矿山废水灌溉区水稻田; LG:天然来水灌溉区甘蔗田; LS:天然来水灌溉区水稻田。SP: 15N的位嗜值。均值混合线:由端元值(SP=-3.90, δ18O=21.00)、(SP=34.80, δ18O=43.60)确定; 还原线:斜率为0.35。 SG: sugarcane field in acid mine drainage irrigated area; SS: paddy field in acid mine drainage irrigated area; LG: sugarcane field in natural water irrigated area; LS: paddy field in natural water irrigated area. Mixing line is determined by the end-member value (SP=-3.90, δ18O=21.00), (SP=34.80, δ18O=43.60). Reduction line is with slope of 0.35. SP: site preference of 15N. |
在确定混合线的斜率时, 各微生物过程SP范围值均有重叠部分(细菌反硝化作用与硝化细菌反硝化作用、硝化作用与真菌反硝化作用, 图 4)。根据大量纯细菌培养及土培试验结果, 利用端元值(SP=-3.90, δ18O=21.00)、(SP=34.80, δ18O=43.60)能合理确定均值混合线(mixing line)[33]。鉴于各微生物过程SP值范围是确定的, 由此可知, 具有最大及最小斜率的混合线分别为SP=5.75×δ18O-165.9与SP=0.75×δ18O-9.33。
N2O被还原为N2前, 各点位不同深度土壤硝化和反硝化作用对N2O生成的贡献比范围如图 5所示。研究区水稻田土壤反硝化作用生成N2O的比率随深度变化不大, 均略大于硝化作用。而甘蔗田硝化与反硝化作用生成N2O的比率随深度变化明显(P < 0.05)。其中AMD灌溉区甘蔗田(SG)表层土壤(0~30 cm) 71.29%的N2O由反硝化作用产生。随着深度增加, 硝化作用对N2O的贡献比有所增加。由此可见, 研究区水稻田和甘蔗田表层土壤产生的N2O大多来自于反硝化作用, 这与Park等[8]在2011年农田表层土壤的研究结果一致。

|
图 5 酸性矿山废水灌区、天然来水区不同作物田土壤硝化/反硝化作用对土壤气体N2O的贡献比范围 Fig. 5 Contribution ratio ranges of nitrification/denitrification to N2O in soils of different crop fields irrigated with acid mine drainage and natural water SG:酸性矿山废水灌溉区甘蔗田; SS:酸性矿山废水灌溉区水稻田; LG:天然来水灌溉区甘蔗田; LS:天然来水灌溉区水稻田。Nit:硝化作用; Denit:反硝化作用。 SG: sugarcane field in acid mine drainage irrigated area; SS: paddy field in acid mine drainage irrigated area; LG: sugarcane field in natural water irrigated area; LS: paddy field in natural water irrigated area. Nit: nitrification; Denit: denitrification. |
假设硝化作用与反硝化作用产生的N2O是先混合后还原, SP-δ18O同位素二元混合模型采用平均斜率值0.35作为农田土壤SP和δ18O还原线(reduction line)的斜率[34], 通过公式(6)、(7)、(8)可以得出微生物N2O还原成N2的比例范围(N2O-reduction ratio)(图 6a)。AMD灌溉区甘蔗田土壤N2O还原成N2的比例随深度逐渐减小, 最小值(15.54%)出现在30~40 cm深度土壤层(图 6b), 而该深度土壤的N2O浓度最大且15N和18O比其他深度贫化(图 2-图 3)。由此可见, 该深度土壤较弱的N2O还原能力致使高浓度的N2O还保留在土壤中。而其他3种土壤剖面中N2O还原成N2的比例随深度变化较小。

|
图 6 酸性矿山废水灌区、天然来水区不同作物田土壤N2O还原成N2的比例范围(a)和均值混合线上各点N2O还原成N2的比例(b) Fig. 6 N2O-reduction ratio range (a) and N2O-reduction ratio in the mixing line (b) of soils of different crop fields irrigated with acid mine drainage and natural water SG:酸性矿山废水灌溉区甘蔗田; SS:酸性矿山废水灌溉区水稻田; LG:天然来水灌溉区甘蔗田; LS:天然来水灌溉区水稻田。 SG: sugarcane field in acid mine drainage irrigated area; SS: paddy field in acid mine drainage irrigated area; LG: sugarcane field in natural water irrigated area; LS: paddy field in natural water irrigated area. |
一般认为, δ15Nbulk与δ18O能够提供关于控制N2O产生和消耗过程的信息[6, 35-36]。由于同位素分馏效应, 无论硝化作用还是反硝化作用生成的N2O中的15N都会贫化, 而部分N2O在反硝化过程中又被进一步还原成N2时, 15N会在剩余的N2O中富集[37]。在人为干扰情况下, 肥料充足的农田土壤所产生和转换的N2O同位素特征值δ15Nbulk平均值为-34‰±12.4‰[8]。本研究区供试土壤N2O同位素特征值δ15Nbulk相对富集, 其范围为-19.62‰~6.15‰, 平均值为-1.57‰。通过对比发现, 供试土壤的硝态氮和氨态氮含量都较低, 微生物活动受到氮源的限制, 促使N2O进一步还原成N2, 从而引起15N在剩余N2O富集。长期淹水造成水稻田表层土壤含水率较高, 也阻碍了N2O向大气的扩散以及大气中氧气向下层土壤的输送, 从而在土壤中形成厌氧条件, 有足够的时间进行N2O还原。
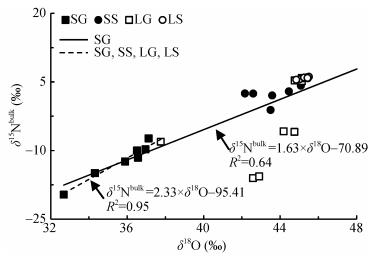
相关研究亦表明, 农田土壤相比森林土壤δ15Nbulk与δ18O之间的相关性更具有统计学意义[8]。这是因为农田土壤频繁受到诸如土地耕作、氮肥施用、降水等人为因素的干扰, 使产生的N2O很快扩散进入大气, 减少N2O还原成为N2。而森林土壤属于非人为干扰的自然状态, 土壤剖面不同微生物过程产生的N2O处于稳定状态, 短时间内不可能发生显著的扩散, 进而被还原成为N2导致同位素分馏, 使δ15Nbulk与δ18O相关性较差。研究区土壤N2O同位素特征值δ15Nbulk与δ18O相关性具有统计学意义(图 7, R2=0.64, P < 0.000 1, n=32)。其中SG土壤剖面拟合结果更好(R2=0.95, P < 0.000 1, n=8)。利用SP值和δ18O定量计算所得到的N2O还原比结果与δ15Nbulk与δ18O之间相关性的定性分析结果一致性良好。
|
图 7 酸性矿山废水灌区、天然来水区不同作物田不同深度土壤气体N2O同位素特征值δ15Nbulk与δ18O线性回归分析 Fig. 7 Linear regressions for δ15Nbulk and δ18O of N2O in soil air in different depths of different crop fields irrigated with acid mine drainage and natural water SG:酸性矿山废水灌溉区甘蔗田; SS:酸性矿山废水灌溉区水稻田; LG:天然来水灌溉区甘蔗田; LS:天然来水灌溉区水稻田。 SG: sugarcane field in acid mine drainage irrigated area; SS: paddy field in acid mine drainage irrigated area; LG: sugarcane field in natural water irrigated area; LS: paddy field in natural water irrigated area. |
此外, 种植作物与耕作方式不同对同位素的分布也有影响。研究区甘蔗田(SG、LG)土壤N2O的15N和18O分别比水稻田SS、LS同一深度土壤贫化, 且N2O的反硝化作用贡献比高于SS、LS。
3.2 AMD灌溉对农田土壤N2O产生和释放的影响土壤产生N2O是一个复杂的微生物过程, 其产生和释放量主要取决于土壤微生物的硝化和反硝化作用的反应速率、N2O在反应产物中的比例以及N2O扩散到大气前在土壤中扩散和被还原程度。这一过程受多种因素的影响, 包括土壤水分、通气条件、可利用氮、温度、pH等[38]。
土壤剖面不同深度N2O浓度与土壤孔隙含水率、施肥状况均有关[7, 39-41]。研究区甘蔗田(SG、LG)地表以下30~50 cm深度范围, 土壤孔隙含水率存在峰值, 分别高达69.94%、89.15%。已知该深度范围内, N2O浓度最大。因此, 包气带含水率大的深度范围N2O浓度也高。丁军军等[42]研究也表明, 70%土壤孔隙含水率(WFPS)的水分条件下N2O的排放较高。但是, 70%WFPS并不代表就是最佳土壤孔隙含水率。Bouwman等[43]认为, 土壤性质决定了N2O排放所需的最佳土壤孔隙含水率。N2O还原比与土壤含水率呈正相关关系(表 2), 表明农田土壤含水率是控制N2O还原比的关键因素之一。在同等施氮条件下有机肥比无机肥(尿素)更能促进反硝化作用, 能明显减少土壤N2O排放, 而不影响作物产量[38]。因此, 在实际农业生产过程中合理控制土壤含水率及施肥状况, 有助于减少温室气体N2O排放及提高肥料利用效率。
| 表 2 土壤反硝化作用贡献比(Denit)、还原比(Fr)及N2O浓度(cN2O)与理化性质及重金属浓度的相关性分析 Table 2 Correlation coefficients of contribution ratio of denitrification to N2O (Denit), N2O-reducation ratio (Fr), N2O concentration (cN2O) with heavy metal and physio-chemical properties of soil |
结合土壤气体中N2O浓度与同位素特征值分析可知, 同一深度范围AMD灌区(SG、SS)土壤剖面N2O的15N和18O比天然来水区(LG、LS)同一深度土壤贫化, N2O浓度也较高, 且SG、SS土壤N2O的来源反硝化作用贡献比高于LG、LS。这表明受到AMD灌溉影响的上坝村甘蔗田与水稻田土壤剖面各深度反硝化作用增强, 产生15N显著贫化的气体N2O。由表 2可知, N2O浓度与pH呈负相关, 表明土壤pH越低, 反硝化作用对N2O生成的贡献比越高。这与之前的研究结果一致, 即较低的pH可抑制硝化作用的发生[44]。N2O的浓度与反硝化作用贡献比呈正相关, 与还原比呈负相关, 表明土壤中的N2O主要来源于反硝化作用, 而且高浓度的N2O将会抑制还原过程(N2O→N2)。反硝化作用贡献比与Cu、Zn、Pb均存在正相关, 表明AMD灌溉下, 较高的重金属浓度对反硝化作用产生N2O有促进作用。以往试验研究结果也有相同结果[12], 土壤As、Pb、Cu、Zn含量分别为466 mg·kg-1、187 mg·kg-1、344 mg·kg-1、326 mg·kg-1时, 利用乙炔抑制法在只进行反硝化作用时N2O排放通量为0.237 μg·kg-1·d1, 远高于空白样品0.095 μg·kg-1·d-1。Holtan-Hartwig等[45]通过将提取的微生物细胞暴露于重金属环境下进行厌氧培养也发现, 重金属所产生的即刻效应导致反硝化速率降低, 而且N2O还原率减小程度远远大于N2O产生率的减小程度, N2O产生率在试验进行8 d后已经部分恢复, 而N2O还原率2个月后仍未完全恢复。本研究中N2O还原比与Zn、Pb、Cd也均呈负相关, 说明重金属可能对反硝化作用中的N2O还原酶产生抑制作用。由此可见, AMD灌溉通过改变农田土壤的pH、重金属含量、含水率从而改变了其土壤对N2O的来源途径及还原能力, 而AMD灌溉对水稻田土壤N2O的还原能力的影响小于对甘蔗田的影响。因此, 酸性矿山废水灌溉的影响下, 土壤气体中N2O产生和释放也与土壤作物类型、种植方式有关。
4 结论本研究利用N2O的3种同位素特征值(δ15Nbulk、δ18O、SP)对华南红壤区受AMD灌溉影响的农田土壤N2O的微生物产生途径和转换机制进行了探究。AMD灌区农田土壤N2O浓度均稍高于利用天然河流灌溉的同类作物农田土壤N2O浓度。AMD灌区甘蔗田土壤N2O产生主要来源于反硝化作用, 于此同时N2O还原比例随深度增加而逐渐减小。N2O浓度峰值、反硝化作用贡献比峰值以及N2O还原比极小值出现的土壤层是一致的, 这说明了该深度范围较弱的土壤N2O还原能力导致较高浓度的N2O残留。其他3种土壤N2O还原比例随深度增加变化较小, 且均大于40%。通过分析各理化性质与供试土壤反硝化作用贡献比、还原比以及N2O浓度相关性结果可知, AMD灌溉通过改变农田土壤的pH、重金属含量、含水率, 从而改变了其土壤对N2O的来源途径及还原能力, 其次土壤中N2O的产生和消耗也与作物类型、种植方式有关。而利用SP值和δ18O定量计算的土壤N2O还原比与利用δ15Nbulk与δ18O之间相关性所得的定性结果具有良好一致性, 为定量分析土壤N2O产生和转化机制打下了科学基础。
| [1] |
RAVISHANKARA A R, DANIEL J S, PORTMANN R W. Nitrous oxide (N2O):The dominant ozone-depleting substance emitted in the 21st Century[J]. Science, 2009, 326(5949): 123-125. DOI:10.1126/science.1176985 |
| [2] |
STOCKER T F, QIN D, PLATTNER G K, et al. Climate Change 2013:The Physical Science Basis. Contribution of Working Group Ⅰ to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change[M]. Cambridge: Cambridge University Press, 2013.
|
| [3] |
AKIYAMA H, YAN X Y, YAGI K. Estimations of emission factors for fertilizer-induced direct N2O emissions from agricultural soils in Japan:Summary of available data[J]. Soil Science and Plant Nutrition, 2006, 52(6): 774-787. DOI:10.1111/j.1747-0765.2006.00097.x |
| [4] |
ROCHETTE P. No-till only increases N2O emissions in poorly-aerated soils[J]. Soil and Tillage Research, 2008, 101(1/2): 97-100. |
| [5] |
BASCHE A D, MIGUEZ F E, KASPAR T C, et al. Do cover crops increase or decrease nitrous oxide emissions? A meta-analysis[J]. Journal of Soil and Water Conservation, 2014, 69(6): 471-482. DOI:10.2489/jswc.69.6.471 |
| [6] |
BAGGS E M. A review of stable isotope techniques for N2O source partitioning in soils:Recent progress, remaining challenges and future considerations[J]. Rapid Communications in Mass Spectrometry, 2008, 22(11): 1664-1672. DOI:10.1002/(ISSN)1097-0231 |
| [7] |
CAI Y J, DING W X, ZHANG X L, et al. Contribution of heterotrophic nitrification to nitrous oxide production in a long-term N-fertilized arable black soil[J]. Communications in Soil Science and Plant Analysis, 2010, 41(19): 2264-2278. DOI:10.1080/00103624.2010.507833 |
| [8] |
PARK S, PÉREZ T, BOERING K A, et al. Can N2O stable isotopes and isotopomers be useful tools to characterize sources and microbial pathways of N2O production and consumption in tropical soils?[J]. Global Biogeochemical Cycles, 2011, 25(1): GB1001. |
| [9] |
TOYODA S, YANO M, NISHIMURA S I, et al. Characterization and production and consumption processes of N2O emitted from temperate agricultural soils determined via isotopomer ratio analysis[J]. Global Biogeochemical Cycles, 2011, 25(2): GB2008. |
| [10] |
ZOU Y, HIRONO Y, YANAI Y, et al. Isotopomer analysis of nitrous oxide accumulated in soil cultivated with tea (Camellia sinensis) in Shizuoka, central Japan[J]. Soil Biology and Biochemistry, 2014, 77: 276-291. DOI:10.1016/j.soilbio.2014.06.016 |
| [11] |
BÅÅTH E. Effects of heavy metals in soil on microbial processes and populations (a review)[J]. Water, Air, and Soil Pollution, 1989, 47(3/4): 335-379. |
| [12] |
VÁSQUEZ-MURRIETA M S, CRUZ-MONDRAGÓN C, TRUJILLO-TAPIA N, et al. Nitrous oxide production of heavy metal contaminated soil[J]. Soil Biology and Biochemistry, 2006, 38(5): 931-940. DOI:10.1016/j.soilbio.2005.08.007 |
| [13] |
Cole J J, Caraco N F. Emissions of nitrous oxide (N2O) from a tidal, freshwater river, the Hudson River, New York[J]. Environmental Science & Technology, 2001, 35(6): 991-996. |
| [14] |
张素玲. pH变化对土壤中N2O释放的影响[D].扬州: 扬州大学, 2001 Zhang S L. Effect of pH change on N2O release in soil[D]. Yangzhou: Yangzhou University, 2001 |
| [15] |
刘庆.大宝山矿周边污染土壤重金属与微生物剖面分布的研究[D].广州: 华南农业大学, 2008 LIU Q. Study on the profile distribution of heavy metals and microbial biomass in contaminated soils near Dabaoshan Area[D]. Guangzhou: South China Agricultural University, 2008 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1277581 |
| [16] |
LIU Y, LIU Y Z, DING Y J, et al. Abundance, composition and activity of ammonia oxidizer and denitrifier communities in metal polluted rice paddies from South China[J]. PLoS One, 2014, 9(7): e102000. DOI:10.1371/journal.pone.0102000 |
| [17] |
ZHOU T, PAN G X, LI L Q, et al. Changes in greenhouse gas evolution in heavy metal polluted paddy soils with rice straw return:A laboratory incubation study[J]. European Journal of Soil Biology, 2014, 63: 1-6. DOI:10.1016/j.ejsobi.2014.03.008 |
| [18] |
李爽, 李晓敏, 李芳柏. Fe(Ⅱ)对反硝化过程及其功能微生物群落的影响[J]. 中国环境科学, 2018, 38(1): 263-274. LI S, LI X M, LI F B. Effect of Fe(Ⅱ) on denitrification and associated functional microbial communities[J]. China Environmental Science, 2018, 38(1): 263-274. DOI:10.3969/j.issn.1000-6923.2018.01.030 |
| [19] |
鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2000. BAO S D. Soil and Agricultural Chemistry Analysis[M]. 3rd ed. Beijing: China Agricultural Press, 2000. |
| [20] |
YAMAMOTO A, AKIYAMA H, NAKAJIMA Y, et al. Estimate of bacterial and fungal N2O production processes after crop residue input and fertilizer application to an agricultural field by 15N isotopomer analysis[J]. Soil Biology and Biochemistry, 2017, 108: 9-16. DOI:10.1016/j.soilbio.2017.01.015 |
| [21] |
TOYODA S, YOSHIDA N. Determination of nitrogen isotopomers of nitrous oxide on a modified isotope ratio mass spectrometer[J]. Analytical Chemistry, 1999, 71(20): 4711-4718. DOI:10.1021/ac9904563 |
| [22] |
MARIOTTI A, GERMON J C, HUBERT P, et al. Experimental determination of nitrogen kinetic isotope fractionation:Some principles; illustration for the denitrification and nitrification processes[J]. Plant and Soil, 1981, 62(3): 413-430. DOI:10.1007/BF02374138 |
| [23] |
YUNG Y L, MILLER C E. Isotopic fractionation of stratospheric nitrous oxide[J]. Science, 1997, 278(5344): 1778-1780. DOI:10.1126/science.278.5344.1778 |
| [24] |
FRAME C H, CASCIOTTI K L. Biogeochemical controls and isotopic signatures of nitrous oxide production by a marine ammonia-oxidizing bacterium[J]. Biogeosciences, 2010, 7(9): 2695-2709. DOI:10.5194/bg-7-2695-2010 |
| [25] |
HEIL J, WOLF B, BRÜGGEMANN N, et al. Site-specific 15N isotopic signatures of abiotically produced N2O[J]. Geochimica et Cosmochimica Acta, 2014, 139: 72-82. DOI:10.1016/j.gca.2014.04.037 |
| [26] |
SUTKA R L, OSTROM N E, OSTROM P H, et al. Distinguishing nitrous oxide production from nitrification and denitrification on the basis of isotopomer abundances[J]. Applied and Environmental Microbiology, 2006, 72(1): 638-644. DOI:10.1128/AEM.72.1.638-644.2006 |
| [27] |
MAEDA K, SPOR A, EDEL-HERMANN V, et al. N2O production, a widespread trait in fungi[J]. Scientific Reports, 2015, 5: 9697. DOI:10.1038/srep09697 |
| [28] |
ROHE L, ANDERSON T H, BRAKER G, et al. Dual isotope and isotopomer signatures of nitrous oxide from fungal denitrification-A pure culture study[J]. Rapid Communications in Mass Spectrometry, 2014, 28(17): 1893-1903. DOI:10.1002/rcm.6975 |
| [29] |
SUTKA R L, ADAMS G C, OSTROM N E, et al. Isotopologue fractionation during N2O production by fungal denitrification[J]. Rapid Communications in Mass Spectrometry, 2008, 22(24): 3989-3996. DOI:10.1002/rcm.v22:24 |
| [30] |
TOYODA S, MUTOBE H, YAMAGISHI H, et al. Fractionation of N2O isotopomers during production by denitrifier[J]. Soil Biology and Biochemistry, 2005, 37(8): 1535-1545. DOI:10.1016/j.soilbio.2005.01.009 |
| [31] |
LEWICKA-SZCZEBAK D, DYCKMANS J, KAISER J, et al. Oxygen isotope fractionation during N2O production by soil denitrification[J]. Biogeosciences, 2016, 13(4): 1129-1144. DOI:10.5194/bg-13-1129-2016 |
| [32] |
LEWICKA-SZCZEBAK D, WELL R, KÖSTER J R, et al. Experimental determinations of isotopic fractionation factors associated with N2O production and reduction during denitrification in soils[J]. Geochimica et Cosmochimica Acta, 2014, 134: 55-73. DOI:10.1016/j.gca.2014.03.010 |
| [33] |
LEWICKA-SZCZEBAK D, AUGUSTIN J, GIESEMANN A, et al. Quantifying N2O reduction to N2 based on N2O isotopocules-validation with independent methods (helium incubation and 15N gas flux method)[J]. Biogeosciences, 2017, 14(3): 711-732. DOI:10.5194/bg-14-711-2017 |
| [34] |
DEPPE M, WELL R, GIESEMANN A, et al. Soil N2O fluxes and related processes in laboratory incubations simulating ammonium fertilizer depots[J]. Soil Biology and Biochemistry, 2017, 104: 68-80. DOI:10.1016/j.soilbio.2016.10.005 |
| [35] |
BOL R, TOYODA S, YAMULKI S, et al. Dual isotope and isotopomer ratios of N2O emitted from a temperate grassland soil after fertiliser application[J]. Rapid Communications in Mass Spectrometry, 2003, 17(22): 2550-2556. DOI:10.1002/(ISSN)1097-0231 |
| [36] |
HOLTGRIEVE G W, JEWETT P K, MATSON P A. Variations in soil N cycling and trace gas emissions in wet tropical forests[J]. Oecologia, 2006, 146(4): 584-594. DOI:10.1007/s00442-005-0222-1 |
| [37] |
MENYAILO O V, HUNGATE B A. Stable isotope discrimination during soil denitrification:Production and consumption of nitrous oxide[J]. Global Biogeochemical Cycles, 2006, 20(3): GB3025. |
| [38] |
林伟, 张薇, 李玉中, 等. 有机肥与无机肥配施对菜地土壤N2O排放及其来源的影响[J]. 农业工程学报, 2016, 32(19): 148-153. LIN W, ZHANG W, LI Y Z, et al. Effects of combined application of manure and inorganic fertilizer on N2O emissions and sources in vegetable soils[J]. Transactions of the CSAE, 2016, 32(19): 148-153. DOI:10.11975/j.issn.1002-6819.2016.19.021 |
| [39] |
DIJKSTRA F A, AUGUSTINE D J, BREWER P, et al. Nitrogen cycling and water pulses in semiarid grasslands:Are microbial and plant processes temporally asynchronous?[J]. Oecologia, 2012, 170(3): 799-808. DOI:10.1007/s00442-012-2336-6 |
| [40] |
HARRISON-KIRK T, BEARE M H, MEENKEN E D, et al. Soil organic matter and texture affect responses to dry/wet cycles:Effects on carbon dioxide and nitrous oxide emissions[J]. Soil Biology and Biochemistry, 2013, 57: 43-55. DOI:10.1016/j.soilbio.2012.10.008 |
| [41] |
LIU X C, QI Y C, DONG Y S, et al. Response of soil N2O emissions to precipitation pulses under different nitrogen availabilities in a semiarid temperate steppe of Inner Mongolia, China[J]. Journal of Arid Land, 2014, 6(4): 410-422. DOI:10.1007/s40333-013-0211-x |
| [42] |
丁军军, 张薇, 李玉中, 等. 不同灌溉量对华北平原菜地N2O排放及其来源的影响[J]. 应用生态学报, 2017, 28(7): 2269-2276. DING J J, ZHANG W, LI Y Z, et al. Effects of soil water condition on N2O emission and its sources in vegetable farmland of North China Plain[J]. Chinese Journal of Applied Ecology, 2017, 28(7): 2269-2276. |
| [43] |
BOUWMAN A F, DERWENT R G, DENTENER F J. Towards reliable global bottom-up estimates of temporal and spatial patterns of emissions of trace gases and aerosols from land-use related and natural sources[J]. Developments in Atmospheric Science, 1999, 24: 3-26. DOI:10.1016/S0167-5117(98)80022-0 |
| [44] |
HAYNES R J. Uptake and assimilation of mineral nitrogen by plants[M]//HAYNES R J. Mineral Nitrogen in the Plant-Soil System. Amsterdam: Elsevier Inc., 1986: 303-378
|
| [45] |
HOLTAN-HARTWIG L, BECHMANN M, HØYÅS T R, et al. Heavy metals tolerance of soil denitrifying communities:N2O dynamics[J]. Soil Biology and Biochemistry, 2002, 34(8): 1181-1190. DOI:10.1016/S0038-0717(02)00055-X |
 2019, Vol. 27
2019, Vol. 27