2. 中国农业大学农学院 北京 100193
2. College of Agronomy, China Agricultural University, Beijing 100193, China
土壤线虫是土壤微生态环境中最丰富而敏感的生物类群之一, 每平方米土壤中可达数百万条[1]。从土壤中将线虫分离出来较容易, 分离效率可达97%~99%, 线虫生活于土壤间隙水中, 与环境直接接触, 移动速度缓慢, 可反映小尺度土壤微生境的变化[2-3]。线虫世代周期较短, 一般为数天或几个月, 可在短时间内对环境变化做出响应。因此, 线虫作为土壤健康指示生物受到广泛重视[4-5]。甘薯茎线虫(Ditylenchus destructor)是一种国际检疫植物寄生线虫, 甘薯茎线虫病已成为制约我国甘薯(Dioscorea esculenta)生产的严重病害之一, 在山东、河北、北京、河南、江苏等省市均有分布, 一般发病田块减产20%~50%, 重病田块基本上绝产无收, 造成了巨大的经济损失[6-8]。目前我国甘薯产区仍然以化学防治为主要手段[9-10], 但连年施用杀线剂破坏生态环境, 污染水体, 还会使茎线虫产生抗药性[11-13]。轮作是防治植物寄生线虫病害的重要措施, 小麦(Triticum aestivum)与茄子(Solanum melongena)、冬瓜(Benincasa hispida)等作物轮作可以降低土壤中燕麦孢囊线虫(Heterodera avenae)种群密度[14], 轮作系统还能降低大豆胞囊线虫(Heterodera glycines)病害的发生[15]。金凤柱等[16]研究表明甘薯与玉米(Zea mays)、黑麦(Secale cereale)轮作可减少甘薯茎线虫数量, 提高甘薯产量。土壤线虫优势营养类群和优势属种可以有效地指示农业土壤健康状况和线虫病害的发生程度[17-19]。因此研究轮作种植下甘薯根际土壤线虫群落结构, 对探索轮作防治甘薯茎线虫病和甘薯生产有理论指导意义。目前, 以土壤线虫群落为对象的研究多以形态学鉴定方法为主[20-22], 也有少数应用分子生物学技术[23]。变性梯度凝胶电泳(denaturing gradient gel electrophoresis, DGGE)作为土壤微生物群落多样性分析的重要技术[24], 在检测线虫群落方面也有报道[25-26]。Foucher等[27]用DGGE和形态学方法比较检测土样中线虫的丰度, 发现两种方法并无直接相关。Wang等[28]研究铜污染的土壤中线虫的多样性, 发现以形态学方法鉴定对照与处理无区别, 但用DGGE鉴别重污染土壤线虫多样性显著低于对照。DGGE也常被用于食细菌线虫群落的研究中[29-30]。但至今国内外鲜有将DGGE应用于甘薯土壤线虫群落的研究上。
本研究利用PCR-DGGE技术, 研究不同种植方式下甘薯根际土壤线虫群落的变化, 结合甘薯产量、病情指数, 揭示轮作措施防治甘薯茎线虫病的效果及对甘薯产量的影响, 明确DGGE技术在土壤线虫群落研究上应用的可行性, 为通过构建合理种植制度来控制和预防甘薯茎线虫病的发生提供理论依据。
1 材料与方法 1.1 试验处理试验地位于河北省卢龙县(39°48';N, 119°20';E), 试验田为甘薯连作7年的耕地, 土壤为典型的褐土, 耕层土壤有机质22.19 g·kg-1、全氮1.1 g·kg-1、碱解氮48.28 mg·kg-1、有效磷11.91 mg·kg-1、有效钾59.2 mg·kg-1, 土壤pH为7.2。试验于2014年5月到2015年10月进行。设置6个处理, 分别为休闲→甘薯(A1)、玉米—冬闲→甘薯(A2)、玉米—黑麦→甘薯(A3)、大豆—冬闲→甘薯(A4)、大豆—黑麦→甘薯(A5)、甘薯连作(CK), 每个处理3次重复, 18个小区随机区组分布, 小区面积为4 m×5 m。甘薯品种为当地的主栽品种‘一窝红’, 其他作物取用当地推广种植的品种, 玉米为‘中地77号’, 黑麦为‘托亚’, 大豆(Glycine max)为‘壮元青’。轮作作物玉米和大豆2014年5月1日播种, 10月1日收获, 当日播种黑麦, 2015年4月28日收获。甘薯于2015年5月1日栽植, 9月25日收获。
1.2 取样方法与线虫分离分别于2015年5月、7月、9月, 采集甘薯根际土壤(根系附着的土壤), 每小区随机取3个点, 过筛混匀称取30 g土样。采用改良的贝尔曼漏斗法[31]分离线虫。收集线虫于1.5 mL离心管中, 去离子水反复清洗3次后, 保留50 μL水, 破碎虫体, 加入40 μL的10×PCR buffer和10 μL 1 mg·mL-1蛋白酶K, 95 ℃加热15 min后, 65 ℃水浴1.5 h, 线虫总DNA保存在-20 ℃待用。
1.3 线虫总DNA提取与PCR-DGGEPCR扩增区间为线虫的ITS1区, 引物为ITS-F(5′-TTGATTACGTCCCTGCCCTTT-3′)、ITS-R (5′-ACGAGCCGAGTGATCCACCG-3′)[32]。50 μL扩增反应体系中包含: 5 μL 10×Buffer, 2 μL dNTP (25 mmol·L-1), 2 μL引物(10 μmol·L-1), 模板1.5 μL, Taq DNA聚合酶2.5 U, 无菌ddH2O补加到50 μL。PCR反应程序:预变性94 ℃ 3 min, 变性94 ℃ 30 s, 退火58 ℃ 45 min, 延伸72 ℃ 1 min, 40个循环, 延伸72 ℃ 10 min。PCR产物经检测纯化进行变性凝胶电泳分析, 采用Bio-Rad公司DcodTM的DCode Univeral Detection System Instrument对PCR产物进行分离。本试验采用单梯度法, 聚丙烯酰胺凝胶的浓度是6%;变性剂浓度范围20%~60%, 在0.5×TAE缓冲液(DGGE专用)中75 V电压电泳10 h, 温度61 ℃。凝胶采用SYBR Green Ⅰ染色30 min, 用凝胶影像分析仪AIphaImager 2200观测, 并回收特征条带测序。
1.4 甘薯产量和病情指数测定收获时, 测定每小区甘薯产量, 并随机选择10株进行甘薯病情指数调查, 只有病情指数为0级和1级的甘薯计入产量, 其他没有食用价值不计入产量。薯块病情分级标准为[33]:
0级:薯块无症状; 1级:薯块症状面积在1/4以下; 2级:薯块症状面积在1/4~1/2; 3级:薯块症状面积在1/2~3/4; 4级:薯块症状面积在3/4以上, 无食用价值。
| $ 病情指数=[∑(薯块级别×该级薯块数)/(调查总薯块数×最高级别)]×100 $ | (1) |
PCR-DGGE图谱采用Bio-Rad公司的Quantity One软件分析, SAS 9.0进行方差分析, Mega 5软件对测序结果进行序列并比对后, 在NCBI上利用Blast搜索GenBank上的所有序列, 获取同源性高的序列信息。
通过DGGE凝胶图谱分析条带的数量和相对强度并计算Shannon指数(H)、丰富度(S)来评价样品中线虫的多样性[34]:
| $ H = - \sum\limits_{i = 1}^s {({p_i})(\ln {p_i})} $ | (2) |
式中: pi是第i种在总体中的个体比例。
2 结果与分析 2.1 轮作方式对土壤线虫群落影响的分析甘薯根际土壤线虫群落DGGE图谱(图 1)显示, 不同泳道的优势条带各异, 也存在一些共同的优势条带。说明不同种植方式对于土壤线虫群落结构有明显影响, 不同处理土壤具有不同的优势种群, 也有部分种群普遍存在于各处理土壤中, 但其种群丰度各有不同。

|
图 1 不同轮作方式下甘薯根际土壤线虫ITS区扩增片段的DGGE图谱(泳道编号见表 1, B1-B15示条带) Fig. 1 DGGE profiles of ITS gene fragments obtained from nematodes communities gDNA in sweet potatoes rhizosphere soil of different rotation patterns (Numbers 1-16 are shown in Table 1, B1-B15 are codes of the bands) |
| 表 1 不同轮作方式下甘薯根际土壤线虫群落多样性和丰富度指数 Table 1 Shannon diversity and richness indexes of soil nematode community in sweet potatoes rhizosphere soil of different rotation patterns |
依据3次重复的PCR-DGGE凝胶分析, 得到各处理的Shannon指数和丰富度, 结果如表 1所示。A5处理3个时期的线虫群落多样性指数显著高于其他处理, 而CK的9月和A1的5月显著低于其他处理; A1中7月群落多样性最高; A2和A4随采样时间推移而升高; A3和A5 3个时期各自群落多样性无显著差异。CK的丰富度也显著低于其他处理(前期工作发现CK 3个时期的图谱无差异, 多样性极低, 因此这里只列出9月份的CK作为代表)。
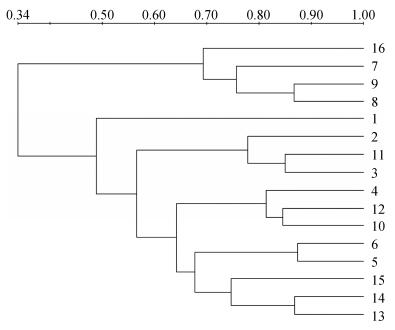
使用Bio-Rad公司Quantity One图像分析软件绘制不同土壤之间的遗传簇关系(图 2)。通过各泳道所代表遗传簇的异同, 表示各处理土壤中线虫群落之间的基因多样性及亲缘关系。聚类分析(UPGMA)显示, 不同种植方式的3个时期大体相近, 而A3却与CK相近。
|
图 2 不同轮作方式下甘薯根际线虫群落的聚类图谱(编号见表 1) Fig. 2 Cluster analysis of soil nematode community in sweet potatoes rhizosphere soil of different rotation patterns (Numbers 1-16 are shown in Table 1) |
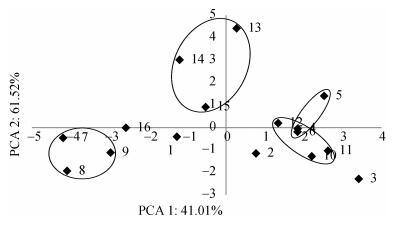
用SAS. V8软件insight模块对DGGE检测到的所有线虫群落做主成分分析, 图 3所示是前两个主成分的平面坐标, 这两个主成分可以反映全部信息的102.53%, A2和A4两处理的3个时期都非常相近, A3和A5各时期也各自相近, 而A1各时期则相距较远。
|
图 3 不同轮作方式下甘薯根际线虫群落的主成分分析(编号见表 1) Fig. 3 Principal component analysis of soil nematode community in sweet potatoes rhizosphere soil of different planting patterns (Numbers 1-16 are shown in Table 1) |
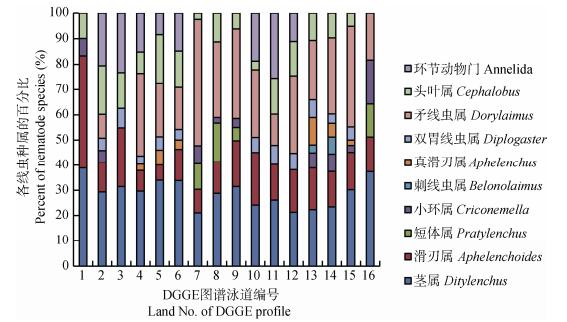
从DGGE凝胶上分离了15条优势或特征条带, 测得序列导入Genbank比对。检测到的线虫属于以下10个种属, B1、B8、B11属于矛线虫属(Dorylaimus), B2茎线虫属(Ditylenchus), B3滑刃线虫属(Aphelenchoides), B4、B12头叶线虫属(Cephalobus), B5短体线虫属(Pratylenchus), B6小环线虫属(Criconemella), B7刺线虫属(Belonolaimus), B9真滑刃线虫属(Aphelenchus), B10双胃线虫属(Diplogaster), B13、B14和B15属环节动物门(Annelida), 如表 2。
| 表 2 不同轮作方式下甘薯根际线虫群落DGGE图谱优势特征条带的ITS序列(条带标号见图 1) Table 2 ITS sequences of dominant and special bands from DGGE gel of soil nematode community in sweet potatoes rhizosphere soil of different rotation patterns (band codes are shown in Fig. 1) |
根据这些优势特征条带在DGGE凝胶图谱上的相对强度, 评估得出其所属种属在不同种植方式的土壤中线虫群落中所占比例。如图 4所示, 不同处理中的优势种群各有不同, 而茎线虫属在各处理中均为优势种群; 矛线虫属在各轮作处理中所占比例与茎线虫属相当, 在休闲和连作处理中比例较小; 头叶线虫属存在于各轮作及休闲处理的各时期, 在连作中并未检测到; 真滑刃线虫仅在A2和A5处理中检测到; 刺线虫属仅在A5中检测到。短体线虫仅在A3和CK处理中发现。
|
图 4 不同轮作方式甘薯根际土壤优势线虫群落的比例分布图(编号见表 1) Fig. 4 Diagram of dominant nematode genus in sweet potatoes rhizosphere soil of different rotation patterns (Numbers 1-16 are shown in Table 1) |
如表 3所示, 不同轮作处理均能显著提高甘薯产量, 降低病情指数, 各轮作处理间无显著差异。与甘薯连作相比, 各轮作处理的甘薯产量提高42.08%~55.83%, 病情指数降低22.72%~30.79%。
| 表 3 不同轮作方式下甘薯的产量及病情指数 Table 3 Yields and disease indexes of sweet potatoes in different rotation patterns |
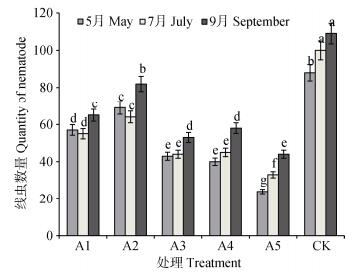
如图 5所示, A1、A2、A3和A4茎线虫数量在5月和7月差异不显著, 9月显著高于前两个时期; A5和CK茎线虫随生育期推移呈显著上升趋势, 且连作CK下的茎线虫数量显著多于其他种植方式。说明随着薯块的成熟, 尤其到收获期, 甘薯茎线虫数量明显增加, 而连作甘薯土壤中茎线虫始终保持较高数量。
|
图 5 不同轮作方式的甘薯茎线虫数量变化 Fig. 5 Quantities of Ditylenchus destructor of sweet potato soil in different rotation patterns 不同字母表示不同处理不同时期差异显著。 Different lowercase letters show significant differences among different treatments at different periods at 0.05 level. |
不同种植方式的甘薯产量、病情指数与甘薯3个生育期根际土壤茎线虫数量的Pearson相关性分析显示(表 4), 茎线虫数量与甘薯产量多数呈负相关, 其中A5和CK连作9月的茎线虫数量与各自的产量呈显著负相关, 说明大部分样品中茎线虫数量越多, 甘薯产量就越低, A5和CK尤其如此; 茎线虫数量与病情指数多呈正相关, A1和CK 9月茎线虫数量与病情指数显著正相关, 说明大多样品茎线虫数量越高, 病情指数也就越高, 且A1和CK处理9月茎线虫的数量显著影响到病情指数。
| 表 4 不同轮作方式的甘薯产量及病情指数与茎线虫数量的相关关系 Table 4 Correlation between yield, disease index of sweet potatoes and quantities of Ditylenchus destructor in different rotation patterns |
本研究所设6种种植方式中, 甘薯连作的线虫群落多样性显著低于5种轮作方式, 大豆—黑麦→甘薯模式最高; 4种轮作方式中, 玉米—冬闲→甘薯和大豆—冬闲→甘薯线虫群落多样性随甘薯生育进程而升高; 玉米—黑麦→甘薯和大豆—黑麦→甘薯5月、7月和9月3个时期没有显著差异。表明轮作方式能够显著提高甘薯根际土壤线虫群落的多样性, 其中大豆—黑麦→甘薯轮作模式效果最好, 冬季轮作黑麦后使得甘薯根际土壤线虫群落结构更加稳定, 随时间变化差异小。聚类分析和主成分分析结果表明, 同一种植方式不同时期甘薯根际线虫群落聚类相似, 说明土壤线虫群落虽然在不同生育期有所变化, 但轮作方式对其群落结构的影响比生育期更大。在农业生产过程中, 任何影响土壤环境的因素, 诸如耕作措施、栽培方式、土地利用方式、化肥和农药使用等, 都能对土壤线虫群落结构产生一定的影响[35-37]。轮作措施对线虫病害防治的报道有很多, 如:在长期轮作的农田系统中, 随着轮作的进行大豆胞囊线虫的数量缓慢减少, 轮作12季度后, 胞囊线虫数量达到平衡[15]; 水旱轮作可以有效防止蔬菜根结线虫[37]; 与蔬菜轮作后使水稻潜根线虫(Hirschmanniella oryzae)数量下降88.1%, 水稻增产34.1%[38]。但是, 关于轮作方式对线虫群落结构的影响报道较少, 多是通过形态学鉴定以Shannon多样性指数、SR丰富度指数和J均匀度指数分析土壤线虫群落的营养结构, 如海棠等[39]发现不同耕作制度使甘薯地土壤线虫营养类群发生变化, 轮作可减少植物寄生线虫种类和数量, 增加食细菌和食真菌线虫的数量。而本研究应用DGGE技术直观展示了土壤线虫群落种类的多样性。
海棠等[40]用形态学方法鉴定出连作甘薯地极优势属为茎线虫属, 轮作、休闲模式下极优势属为头叶线虫属、真头叶线虫属(Eucephalobus)、滑刃线虫属和真滑刃线虫属。在本研究中, 应用PCR-DGGE检测到的甘薯根际线虫优势种属有茎线虫属、矛线虫属、滑刃线虫属、头叶线虫属、短体线虫属、小环线虫属、刺线虫属、真滑刃线虫属、双胃线虫属。其中茎线虫在所有处理中比例均很高, 因为试验土壤已连作甘薯多年, 轮作1年并没有改变茎线虫属的优势地位, 今后需要进一步研究多年轮作是否能改变其种群丰度; 矛线虫是杂食捕食类线虫, 在轮作种植方式下与茎线虫属比例相当; 在连作和玉米—黑麦→甘薯土壤中发现的短体线虫(Pratylenchus hippeastri)也是一种植物寄生线虫, 取食根部, 多危害玉米[41]。在轮作种植方式中检测到更多的线虫种属, 比如头叶线虫属、真滑刃线虫属、双胃线虫属, 在大豆—黑麦→甘薯轮作模式中发现了其他模式中未检测到的刺线虫属。可见应用PCR-DGGE检测到的线虫种类与形态学方法得出结果相似。虽然DGGE技术检测土壤线虫群落多样性没有传统形态学方法鉴定到的种属多, 但是形态学鉴定通常多用于线虫食性分类[35-22], 如要准确鉴定到种属水平则耗时耗力, 且要求较高的线虫形态学相关知识和技术, 不易实现, 而DGGE却可以简单直观地展现线虫群落结构, 是土壤微生态研究者了解线虫群落的有效工具。
很多研究表明轮作方式是提高作物产量、防治病虫害的重要措施, 轮作玉米和大豆对棉花(Gossypium spp.)的肾形线虫(Rotylenchulus reniformis)有抑制作用[42]; 种植黑麦草(Lolium perenne)可以显著降低根结线虫的繁殖率[43]; 休闲与轮作还可以有效降低燕麦孢囊线虫密度[14]; 轮作影响大豆胞囊线虫的报道也很多[44-45]。金凤柱等[16]研究表明, 轮作+覆盖+抗病品种可使甘薯产量增幅达161.73%, 茎线虫属数量下降54.33%;乔月静等[46]发现玉米—黑麦→甘薯轮作模式使甘薯产量增幅108.24%, 茎线虫属降低44.51%。本研究结果显示, 各种轮作方式和休闲都可显著提高甘薯产量, 降低病情指数, 而各轮作处理之间的产量和病情没有显著差异, 其中玉米—黑麦→甘薯稍好, 大豆—黑麦→甘薯次之。轮作种植对茎线虫数量的防治效果说明各轮作方式根际土壤茎线虫数量都得到了有效控制, 其中大豆—黑麦→甘薯整体茎线虫数量最低。甘薯3个生育期根际土壤茎线虫数量与各自的甘薯产量、病情指数的Pearson相关性分析显示, 大部分样品中茎线虫数量越多, 甘薯产量就越低, 大豆—黑麦→甘薯和连作对照尤其如此; 相反的, 大部分样品茎线虫数量越多, 甘薯病情指数也就越高, 且9月收获期茎线虫的数量与甘薯产量和病情指数显著相关。综合来看, 大豆—黑麦→甘薯处理下, 土壤线虫群落多样性和甘薯产量高, 茎线虫数量和病情指数低, 是经济效益和生态效益都较好的一种轮作措施。
4 结论研究证明, 轮作能显著提高甘薯根际土壤线虫群落多样性(P < 0.05);冬季轮作黑麦可使甘薯根际土壤线虫群落结构更加稳定, 随时间变化幅度小; 根据PCR-DGGE检测到的甘薯根际线虫种属有茎线虫属、矛线虫属、滑刃线虫属、头叶线虫属、短体线虫属、小环线虫属、刺线虫属、真滑刃线虫属、双胃线虫属, 其中茎线虫属在各种种植方式中均是极优势种属, 其次为矛线虫属、滑刃线虫属和头叶线虫属。与甘薯连作相比, 轮作方式提高甘薯产量42.08%~55.83%, 降低病情指数22.72%~30.79%, 并显著降低根际土壤茎线虫数量(P < 0.05);收获期甘薯茎线虫的数量与甘薯产量和病情指数显著相关。大豆—黑麦→甘薯是经济效益和生态效益较好的轮作措施。
| [1] |
BONGERS T, BONGERS M. Functional diversity of nematodes[J]. Applied Soil Ecology, 1998, 10(3): 239-251. DOI:10.1016/S0929-1393(98)00123-1 |
| [2] |
NEHER D A. Nematode communities in organically and conventionally managed agricultural soils[J]. Journal of Nematology, 1999, 31(2): 142-154. |
| [3] |
YEATES G W. Nematodes as soil indicators:Functional and biodiversity aspects[J]. Biology & Fertility of Soils, 2003, 37(4): 199-210. |
| [4] |
BONGERS T, FERRIS H. Nematode community structure as a bioindicator in environmental monitoring[J]. Trends in Ecology & Evolution, 1999, 14(6): 224-228. |
| [5] |
NEHER D A. Role of nematodes in soil health and their use as indicators[J]. Journal of Nematology, 2001, 33(4): 161-168. |
| [6] |
卢肖平. 我国甘薯与马铃薯的生产发展、科研成就及其展望[J]. 中国农学通报, 1996, 12(1): 7-9. LU X P. Production development, scientific research achievements and prospects of sweet potato and potato in our country[J]. Chinese Agricultural Science Bulletin, 1996, 12(1): 7-9. |
| [7] |
谢逸萍, 孙厚俊, 邢继英. 中国各大薯区甘薯病虫害分布及危害程度研究[J]. 江西农业学报, 2009, 21(8): 121-122. XIE Y P, SUN H J, XING J Y. Study on potato distribution and the damage of the sweet potato plant diseases in China[J]. Acta Agriculturae Jiangxi, 2009, 21(8): 121-122. DOI:10.3969/j.issn.1001-8581.2009.08.042 |
| [8] |
周忠, 马代夫. 甘薯茎线虫病的研究现状和展望[J]. 杂粮作物, 2003, 23(5): 288-290. ZHOU Z, MA D F. The research status of sweet potato stem nematode and prospected[J]. Rain Fed Crops, 2003, 23(5): 288-290. DOI:10.3969/j.issn.2095-0896.2003.05.014 |
| [9] |
高德良, 于伟丽, 苗建强, 等. 几种替代杀线剂对甘薯茎线虫的毒力与活性[J]. 应用生态学报, 2011, 22(11): 3026-3032. GAO D L, YU W L, MIAO J Q, et al. Toxicity and bioactivity of several alternative nematocides against Ditylenchus destructor[J]. Chinese Journal of Applied Ecology, 2011, 22(11): 3026-3032. |
| [10] |
李旭. 不同药剂防治甘薯茎线虫病试验初报[J]. 安徽农学通报, 2016, 22(7): 67, 78. LI X. Different drugs for controlling sweet potato stem nematode disease[J]. Anhui Agricultural Science Bulletin, 2016, 22(7): 67, 78. |
| [11] |
孔德洋, 朱忠林, 石利利, 等. 中国北方甘薯地农药使用对地下水水质的影响[J]. 农业环境科学学报, 2004, 13(5): 1017-1020. KONG D Y, ZHU Z L, SHI L L, et al. Effect of pesticides on groundwater under sweet-potato-based cropping systems in northern China[J]. Journal of Agro-Environment Science, 2004, 13(5): 1017-1020. DOI:10.3321/j.issn:1672-2043.2004.05.040 |
| [12] |
杨文兰, 刘贺昌, 张卫青, 等. 克线丹颗粒剂对甘薯茎线虫病的防治效果[J]. 河北科技师范学院学报, 2006, 20(1): 25-28. YANG W L, LIU H C, ZHANG W Q, et al. Effect of rugby granular on sweet potato stem nematode[J]. Journal of Hebei Normal University of Science & Technology, 2006, 20(1): 25-28. DOI:10.3969/j.issn.1672-7983.2006.01.007 |
| [13] |
朱育菁, 肖荣凤, 林抗美, 等. 维线克对甘薯茎线虫的田间防治效果[J]. 福建农业学报, 2005, 20(3): 139-141. ZHU Y J, XIAO R F, LIN K M, et al. Control efficiency of Weixianke to sweet potato stem nematode[J]. Fujian Journal of Agricultural Sciences, 2005, 20(3): 139-141. DOI:10.3969/j.issn.1008-0384.2005.03.003 |
| [14] |
李秀花, 高波, 马娟, 等. 休闲与轮作对燕麦孢囊线虫种群动态的影响[J]. 麦类作物学报, 2013, 33(5): 1048-1053. LI X H, GAO B, MA J, et al. Effect of fallow and rotation on the population dynamics of Heterodera avenae[J]. Journal of Triticeae Crops, 2013, 33(5): 1048-1053. |
| [15] |
靳学慧, 辛惠普, 郑雯, 等. 长期轮作和连作对土壤中大豆胞囊线虫数量的影响[J]. 中国油料作物学报, 2006, 28(2): 189-193. JIN X H, XIN H P, ZHENG W, et al. The influence of soil on the long-term rotation and continuous cultivation on soybean cyst nematode[J]. Chinese Journal of Oil Crop Sciences, 2006, 28(2): 189-193. DOI:10.3321/j.issn:1007-9084.2006.02.017 |
| [16] |
金凤柱, 海棠, 武宝悦, 等. 几种不同农艺措施对土壤甘薯茎线虫种群动态的影响[J]. 中国生态农业学报, 2008, 16(4): 921-924. JIN F Z, HAI T, WU B Y, et al. Effect of agronomic measures on population dynamics of sweet potato stem nematode (Ditylenchus destructor)[J]. Chinese Journal of Eco-Agriculture, 2008, 16(4): 921-924. |
| [17] |
陈立杰, 朱艳, 刘彬, 等. 连作和轮作对大豆胞囊线虫群体数量及土壤线虫群落结构的影响[J]. 植物保护学报, 2007, 34(4): 347-352. CHEN L J, ZHU Y, LIU B, et al. Influence of continuous cropping and rotation on soybean cyst nematode and soil nematode community structure[J]. Acta Phytophylacica Sinica, 2007, 34(4): 347-352. DOI:10.3321/j.issn:0577-7518.2007.04.003 |
| [18] |
刘方明, 孟维韧. 土壤线虫作为生态系统恢复指示生物的研究进展[J]. 安徽农业科学, 2008, 36(7): 2913-2915. LIU F M, MENG W R. Study advance of soil nematodes as bioindicator of ecosystem restoration[J]. Journal of Anhui Agricultural Sciences, 2008, 36(7): 2913-2915. DOI:10.3969/j.issn.0517-6611.2008.07.128 |
| [19] |
宋敏, 刘银占, 井水水. 土壤线虫对气候变化的响应研究进展[J]. 生态学报, 2015, 35(20): 6857-6867. SONG M, LIU Y Z, JING S S. Response of soil nematodes to climate change:a review[J]. Acta Ecologica Sinica, 2015, 35(20): 6857-6867. |
| [20] |
GRABAU Z J, CHEN S Y. Influence of long-term corn-soybean crop sequences on soil ecology as indicated by the nematode community[J]. Applied Soil Ecology, 2016, 100: 172-185. DOI:10.1016/j.apsoil.2015.12.016 |
| [21] |
王明伟, 刘雨迪, 陈小云, 等. 旱地红壤线虫群落对不同耕作年限的响应及指示意义[J]. 土壤学报, 2016, 53(2): 510-522. WANG M W, LIU Y D, CHEN X Y, et al. Response of soil nematode community to cultivation in upland red soil relative to cultivation history and its signifi cance as indicator[J]. Acta Pedologica Sinica, 2016, 53(2): 510-522. |
| [22] |
张伟东, 吕莹, 肖莹, 等. 线虫群落对抚顺煤矸石山周边土壤可溶性盐污染的响应[J]. 生态学报, 2012, 32(8): 2439-2446. ZHANG W D, LYU Y, XIAO Y, et al. Responses of soil nematode communities to soluble salt contamination around Gangue hill in Fushun[J]. Acta Ecologica Sinica, 2012, 32(8): 2439-2446. |
| [23] |
王进闯, 王敬国. 大豆连作土壤线虫群落结构的影响[J]. 植物营养与肥料学报, 2015, 21(4): 1022-1031. WANG J C, WANG J G. Effects of continuous soybean monoculture on soil nematode community[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(4): 1022-1031. |
| [24] |
QIAO Y J, LI Z Z, WANG X, et al. Effect of legume-cereal mixtures on the diversity of bacterial communities in the rhizosphere[J]. Plant, Soil & Environment, 2012, 58(4): 174-180. |
| [25] |
MATSUSHITA Y, YAMAMURA K, MORIMOTO S, et al. Analysis of variations in band positions for normalization in across-gel denaturing gradient gel electrophoresis[J]. Journal of Microbiological Methods, 2015, 112: 11-20. DOI:10.1016/j.mimet.2015.02.011 |
| [26] |
WAITE I S, O'DONNELL A G, HARRISON A, et al. Design and evaluation of nematode 18S rDNA primers for PCR and denaturing gradient gel electrophoresis (DGGE) of soil community DNA[J]. Soil Biology and Biochemistry, 2003, 35(9): 1165-1173. DOI:10.1016/S0038-0717(03)00177-9 |
| [27] |
FOUCHER A, WILSON M. Development of a polymerase chain reaction-based denaturing gradient gel electrophoresis technique to study nematode species biodiversity using the 18S rDNA gene[J]. Molecular Ecology Notes, 2002, 2(1): 45-48. DOI:10.1046/j.1471-8286.2002.00141.x |
| [28] |
WANG S B, LI Q, LIANG W J, et al. PCR-DGGE analysis of nematode diversity in Cu-contaminated soil[J]. Pedosphere, 2008, 18(5): 621-627. DOI:10.1016/S1002-0160(08)60056-9 |
| [29] |
DJIGAL D, BRAUMAN A, DIOP T A, et al. Influence of bacterial-feeding nematodes (Cephalobidae) on soil microbial communities during maize growth[J]. Soil Biology and Biochemistry, 2004, 36(2): 323-331. DOI:10.1016/j.soilbio.2003.10.007 |
| [30] |
ZHOU J H, SUN X W, JIAO J G, et al. Dynamic changes of bacterial community under the influence of bacterial-feeding nematodes grazing in prometryne contaminated soil[J]. Applied Soil Ecology, 2013, 64: 70-76. DOI:10.1016/j.apsoil.2012.11.005 |
| [31] |
毛小芳, 李辉信, 陈小云, 等. 土壤线虫三种分离方法效率比较[J]. 生态学杂志, 2004, 23(3): 149-151. MAO X F, LI H X, CHEN X Y, et al. Extraction efficiency of soil nematodes by different methods[J]. Chinese Journal of Ecology, 2004, 23(3): 149-151. |
| [32] |
FERRIS V R, FERRIS J M, FAGHIHI J. Variation in spacer ribosomal DNA in some cyst-forming species of plant parasitic nematodes[J]. Fundamental & Applied Nematology, 1993, 16(2): 177-184. |
| [33] |
王明祖. 中国植物线虫研究[M]. 武汉: 湖北科学技术出版社, 1998. WANG M Z. Chinese Plant Nematode Research[M]. Wuhan: Hubei Science and Technology Press, 1998. |
| [34] |
SHANNON C E, WEAVER W. The Mathematical Theory of Communication[M]. Urbana: The University of Illinois Press, 1949.
|
| [35] |
ZHONG S, ZENG H C, JIN Z Q. Responses of soil nematode abundance and diversity to long-term crop rotations in tropical China[J]. Pedosphere, 2015, 25(6): 844-852. DOI:10.1016/S1002-0160(15)30065-5 |
| [36] |
洪毅, 张伟东, 王雪峰, 等. 庄河口湿地不同土地利用方式下土壤线虫群落特征[J]. 生态环境学报, 2014, 23(10): 1616-1621. HONG Y, ZHANG W D, WANG X F, et al. The characteristic of soil nematodes communities under different vegetation types in Zhuanghe estuary wetland[J]. Ecology and Environmental Sciences, 2014, 23(10): 1616-1621. DOI:10.3969/j.issn.1674-5906.2014.10.008 |
| [37] |
王会芳, 肖彤斌, 芮凯, 等. 不同技术措施对蔬菜根结线虫种群的影响[J]. 植物保护, 2010, 36(2): 161-164. WANG H F, XIAO T B, RUI K, et al. Effects of different technical measures on populations of the root-knot nematodes on vegetables[J]. Plant Protection, 2010, 36(2): 161-164. DOI:10.3969/j.issn.0529-1542.2010.02.040 |
| [38] |
高学彪, 周慧娟, 冯志新. 几种农业措施对水稻潜根线虫病的防治作用及机理的研究[J]. 华中农业大学学报, 1998, 17(4): 331-334. GAO X B, ZHOU H J, FENG Z X. Efficacy and mechanism of cultivation measures on Hirschmanniella oryzae[J]. Journal of Huazhong Agricultural University, 1998, 17(4): 331-334. DOI:10.3321/j.issn:1000-2421.1998.04.006 |
| [39] |
海棠, 彭德良, 曾昭海, 等. 轮作对甘薯地线虫群落组成及多样性的影响[J]. 中国农学通报, 2006, 22(11): 295-298. HAI T, PENG D L, ZENG Z H, et al. Effect of rotate on nematode community composition and diversity in sweet potato field[J]. Chinese Agricultural Science Bulletin, 2006, 22(11): 295-298. DOI:10.3969/j.issn.1000-6850.2006.11.070 |
| [40] |
海棠, 彭德良, 曾昭海, 等. 耕作制度对甘薯地土壤线虫群落结构的影响[J]. 中国农业科学, 2008, 41(6): 1851-1857. HAI T, PENG D L, ZENG Z H, et al. Effect of cropping systems on nematode community structure in sweet potato field[J]. Scientia Agricultura Sinica, 2008, 41(6): 1851-1857. DOI:10.3864/j.issn.0578-1752.2008.06.037 |
| [41] |
CROW W T. Amaryllis lesion nematode, Pratylenchus hippeastri[Z]. EENY-546. University of Florida IFAS, 2012
|
| [42] |
DAVIS R F, KOENNING S R, KEMERAIT R C, et al. Rotylenchulus reniformis management in cotton with crop rotation[J]. Journal of Nematology, 2003, 35(1): 58-64. |
| [43] |
KORTHALS G W, NIJBOER H, MOLENDIJK L P G. Meloidogyne chitwoodi:Host plant suitability of field crops and cover crops[J]. PAV Bulletin Akkerbouw, 2000, 1-3. |
| [44] |
刘淑霞, 潘冬梅, 魏国江, 等. 轮作防治大豆胞囊线虫病的研究现状[J]. 黑龙江科学, 2011, 2(1): 35-36. LIU S X, PAN D M, WEI G J, et al. Current research on controlling soybean cyst nematode by crop rotation[J]. Heilongjiang Science, 2011, 2(1): 35-36. |
| [45] |
孙玉秋, 许艳丽, 李春杰, 等. 作物轮作系统对大豆胞囊线虫二龄幼虫寄生真菌的影响[J]. 大豆科学, 2011, 30(2): 277-280. SUN Y Q, XU Y L, LI C J, et al. Effects of crop rotation system on the parasitic fungi associated with soybean cyst nematode second-stage juvenile[J]. Soybean Science, 2011, 30(2): 277-280. |
| [46] |
乔月静, 王雪娇, 武宝悦, 等. 不同种植模式对甘薯产量及甘薯根际茎线虫数量的影响[J]. 农业现代化研究, 2014, 35(6): 800-803. QIAO Y J, WANG X J, WU B Y. Effect of different planting patterns on yield of sweet potato and the number of nematodes in rhizosphere[J]. Research of Agricultural Modernization, 2014, 35(6): 800-803. |
 2019, Vol. 27
2019, Vol. 27



