Cd污染是最普遍且危害最大的环境污染之一, 来源主要有工业废物、废渣、城市垃圾及污水灌溉和大气沉降排放等[1]。排放到环境中的Cd污染土壤及水体, 转移并在其他生物体内富集, 危害其生长发育, 对生态系统造成了较大的破坏[2-4]。
土壤中的Cd通过根部的吸收进入植物体内, 在蒸腾作用下, 沿着木质部通过共质体和质外体运输途径转移到地上部[5], 还会继续沿着食物链转移到植食性昆虫及更高营养级[6-7]。自然条件下, 多种因素都会影响到植物对Cd的吸收, 如土壤Cd含量、水含量、pH、有机质及矿物质含量、阳离子交换能力(CEC)等[8-15]。
随着全球气候变暖, 干旱胁迫成为越来越严重的问题, 并成为农业生产的主要威胁之一[16-17]。干旱胁迫会影响到植物的蒸腾作用、光合作用以及呼吸作用, 还有体内的激素调节及氮代谢等[18]。
有关干旱对蚜虫的影响和重金属对蚜虫的影响已经多有报道。但蚜虫在自然环境中往往受多重胁迫, 如重金属和干旱双重胁迫, 甚至于农药等更多重胁迫。多重胁迫对蚜虫影响如何、对蚜虫的生态调节有何作用鲜有研究。
麦长管蚜[Sitobion avenae (Fabricius)]是小麦(Triticum aestivum L.)上常见的一种害虫, 它取食小麦汁液, 传播小麦黄矮病毒等病害, 对农业生产造成了一定的危害[19-20]。同时, 其作为一种刺吸式口器的植食性昆虫, Cd经其取食从小麦中进入其体内并累积, 对其生长发育、取食行为、种群生态学参数等必定造成影响[21-22]。
本研究以土壤、小麦、麦长管蚜为研究对象, 通过用不同浓度的土壤重金属Cd及不同程度的干旱胁迫处理, 然后分别测定土壤、小麦根茎叶及蚜虫体内的重金属Cd含量, 从而揭示在干旱和Cd双重胁迫下, Cd在土壤-根-茎-蚜虫体系上的转移规律, 以期为小麦蚜虫的生态调节提供理论依据。
1 材料与方法 1.1 主要材料小麦‘矮抗58’由西北农林科技大学农学院育种中心提供。
麦长管蚜由西北农林科技大学昆虫生态与有害生物综合治理实验室提供, 所有蚜虫均在温度为(20±0.5)℃、相对湿度为60%±10%、光周期为L16 h:D8 h的养虫室内饲养。
1.2 Cd与干旱胁迫处理采用盆栽, 每个花盆(9 cm×9 cm×10 cm)内装400 g土(土壤:基质:细沙=3:1:1, Cd含量为0.72 mgkg−1), 每盆种植15株小麦。待小麦刚种植后浇灌不同浓度的Cd溶液, 使每个处理的土壤Cd含量分别为200 mgkg−1、100 mgkg−1。种植7 d后开始干旱胁迫处理, 设3个干旱胁迫处理:根据Hsiao[18]的方法, 按照土壤相对水分含量设置70%~80%(正常)、55%~65%(中度干旱胁迫)和35%~45%(重度干旱胁迫)。通过称重补水法将试验用土的相对水分含量控制在以上3个水平。每个处理重复3次。小麦双重胁迫7 d时开始接蚜虫, 每盆用毛笔接100头一龄若蚜, 于温度为(20±0.5) ℃、相对湿度为60%±10%、光周期为L16 h:D8 h的养虫室内饲养。接上蚜虫后两周, 用毛笔将成虫挑取至2 mL离心管, 同时将小麦从花盆中整株取出, 进行土壤、植株和蚜虫Cd含量测定。
1.3 Cd含量测定 1.3.1 小麦植株将收集到的小麦分根、茎、叶3部分, 用超纯水洗净后烘干至恒重, 用研钵研磨成粉末, 过1 mm孔筛后, 每个重复分别称取0.2 g放入消解管内, 加入5 mL优级纯硝酸和2 mL双氧水, 然后在微波消解仪内消解, 待消解完全后, 取出消解管, 加超纯水使管内溶液定容至50 mL, 过滤后取10 mL用于Cd含量测定。用原子吸收分光光度计测定Cd含量。
1.3.2 麦长管蚜将收集到的麦长管蚜用超纯水洗干净后烘干至恒重, 每个重复称取10 mg放入消解管内加入5 mL优级纯硝酸和2 mL双氧水, 然后在微波消解仪内消解, 待消解完全后将管内溶液放到赶酸仪继续赶酸浓缩, 待溶液大约剩1 mL时, 将其倒出并定容至10 mL用于Cd含量测定。用原子吸收分光光度计测定Cd含量。
1.4 数据处理Cd转移系数(transfer coefficient)的计算方式参照Wang等[6]和Dar等[23]的方法, 为后一部分试验材料的Cd含量与前一部分试验材料的Cd含量之比(如:土壤-根转移系数=根部Cd含量/土壤Cd含量)。
利用SPSS对土壤Cd含量与干旱胁迫程度2个因素进行双因素方差分析(Two-way ANOVA); 通过双因素方差分析中的主体间效应检验验证两因素间的交互作用, 用Tukey’s检验比较相同干旱胁迫条件下不同土壤Cd含量处理间的差异。单因素方差分析(One-way ANOVA)采用Student-Newman-Keuls (SNK)多重比较检验法对相同土壤Cd含量处理下不同干旱胁迫处理的差异进行多重比较。各处理间的显著性差异均设为P < 0.05的水平。使用Origin Pro 2017对分析结果进行作图。
2 结果与分析 2.1 双重胁迫下小麦及蚜虫体内的Cd变化在Cd与干旱双重胁迫下小麦根、茎、叶及蚜虫体内的Cd含量变化见图 1。从图 1A可以看出, 当土壤Cd含量为100 mgkg−1和200 mgkg−1时, 随干旱程度加剧, 根部Cd含量逐渐降低, 且无干旱胁迫的小麦根部Cd含量显著高于重度干旱胁迫(P < 0.05)。同一干旱胁迫程度下, 土壤Cd含量为200 mgkg−1处理的小麦根部Cd含量显著高于土壤Cd含量为100 mgkg−1的处理(P < 0.05)。
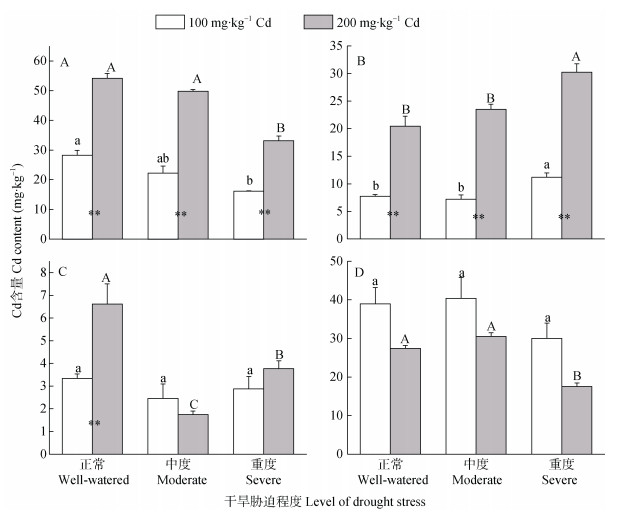
|
图 1 Cd与干旱双重胁迫下小麦根(A)、茎(B)、叶(C)及蚜虫体内(D)Cd含量 Fig. 1 Cd contents in root (A), stem (B), leaf (C) of wheat and aphid (D) under the dual stress of Cd and drought 不同小写字母和大写字母分别表示土壤Cd含量为100 mgkg−1和200 mgkg−1时不同干旱胁迫处理间差异显著(P < 0.05)。**表示同一干旱胁迫处理下不同土壤Cd含量处理间差异显著(P < 0.05)。Different lowercase letters and capital letters indicate significant differences among different drought stress treatments in the 100 mgkg−1 and 200 mgkg−1 soil Cd contents, respectively (P < 0.05). ** indicate significant difference between two Cd concentrations under the same drought stress (P < 0.05). |
从图 1B可知, 无干旱胁迫与中度干旱胁迫程度下, 小麦茎部Cd含量无显著差别; 而重度干旱胁迫下, 茎部Cd含量显著高于无干旱胁迫与中度干旱胁迫(P < 0.05)。同一干旱胁迫程度下, 土壤Cd含量为200 mgkg−1的小麦茎部Cd含量显著高于土壤Cd含量100 mgkg−1处理(P < 0.05)。
从图 1C可知, 同一土壤Cd含量下, 随干旱胁迫程度加重, 叶部Cd含量呈现先降低后升高显著变化趋势(P < 0.05)。只有正常水分条件下, 土壤Cd含量为200 mgkg−1处理的叶片Cd含量高于土壤Cd含量为100 mgkg−1的处理; 中度和重度干旱胁迫下两个Cd处理差异不显著, 且中度干旱胁迫下, 土壤Cd含量为100 mgkg−1处理的叶片Cd含量高于土壤Cd含量为200 mgkg−1的处理。
从图 1D可知, 同一土壤Cd含量下, 随干旱胁迫程度加重, 蚜虫体内Cd含量呈现先上升后下降趋势, 但在土壤Cd含量100 mgkg−1时差异不显著。而同一干旱胁迫程度下, 土壤Cd含量100 mgkg−1时, 蚜虫体内Cd含量高于土壤Cd含量为200 mgkg−1的处理, 但两者之间均无显著差异。
2.2 干旱胁迫下Cd在土壤-根-茎-叶-蚜虫系统上的转移规律干旱胁迫下Cd在土壤-根-茎-叶-蚜虫系统的转移系数见表 1。由表 1可以看出, 在同一土壤Cd含量下, 随干旱胁迫程度加重, 土壤-根的Cd转移系数逐渐降低, 而根-茎的Cd转移系数逐渐升高, 说明干旱胁迫抑制了根部对于Cd的吸收, 而促进了Cd从根部向茎部的转移。
| 表 1 干旱与Cd双重胁迫下Cd在土壤-根-茎-叶-蚜虫系统上的转移系数 Table 1 Transfer coefficients of Cd between the soil-root-stem-leaf-aphid system under the dual stress of Cd and drought |
在相同干旱程度下, 土壤Cd含量为200 mgkg−1的处理根-茎的Cd转移系数到大于土壤Cd含量为100 mgkg−1的处理。土壤Cd含量为200 mgkg−1时, 重度干旱胁迫下, 根-茎转移系数达0.91。
随着干旱程度的加重, 土壤Cd含量为100 mgkg−1和200 mgkg−1的处理中, 茎-叶Cd转移系数分别呈现逐渐降低和先降低再升高的趋势, 且土壤Cd含量为100 mgkg−1的转移系数高于土壤Cd含量为200 mgkg−1处理, 说明低浓度的Cd促进了Cd从茎到叶的转移。在土壤Cd含量为200 mgkg−1且为中度干旱胁迫下, 茎-叶转移系数出现最小值0.07。
叶-蚜虫的Cd转移系数明显大于其他转移系数, 且随着干旱胁迫程度加重, 呈现先升高后降低的趋势。在无干旱胁迫以及重度干旱胁迫下, 土壤Cd含量为100 mgkg−1的转移系数高于土壤Cd含量为200 mgkg−1处理, 而在中度干旱胁迫时, 土壤Cd含量为200 mgkg−1处理的转移系数高于100 mgkg−1处理。
2.3 干旱胁迫下小麦根茎叶及蚜虫体内Cd含量主体间效应检验对小麦根茎叶及麦长管蚜体内Cd含量进行双因素方差分析, 其主体间效应检验结果表明(表 2), 土壤Cd含量、干旱胁迫都对小麦根茎叶Cd含量有显著影响, 且两者间存在显著的交互作用。由各偏差平方和在总偏差平方和中所占的比例可以看出, 在小麦根与茎中, 土壤Cd含量对积累量的作用大于干旱胁迫; 而小麦叶片中, 干旱胁迫对积累量的作用大于土壤Cd含量。在麦长管蚜中, 土壤Cd含量与干旱胁迫之间的交互作用不显著, 且土壤Cd含量对其体内Cd含量的影响大于干旱胁迫。
| 表 2 干旱与Cd双重胁迫下小麦根茎叶及蚜虫体内Cd含量主体间效应检验 Table 2 Tests of between-subjects effect on the Cd contents of root, stem, leaf of wheat and aphid under the dual stress of Cd and drought stress |
本研究中小麦体内的Cd含量为根 > 茎 > 叶, 这是由于根部的“隔离”作用[24-25], 植物根部吸收的Cd会大于地上部分。张丙春等[26]、李江遐等[27]、何勇强等[28]的研究也得到了相同的结果。而在转移系数中, 叶片-麦长管蚜的转移系数明显高于根-茎、茎-叶和叶-蚜虫的3个转移系数, 且大于1, Dar等[23]也得到了类似的结果, 表明存在着生物富集现象。推测其原因为, Cd进入蚜虫体内后, 与蚜虫体内的可溶性蛋白(包括金属硫蛋白)发生了络合反应, 使其不容易被蚜虫代谢排出体外, 从而累积在蚜虫体内。
植物干旱会影响到植物的蒸腾作用、光合作用以及呼吸作用, 及体内的激素调节及氮代谢等[18], 这些都可能影响到植物对Cd的吸收、转运及积累。Liu等[29]研究表明, 美国商陆(Phytolacca americana L.)茎Cd含量与叶片的蒸腾作用密切相关, 水分胁迫减少了叶片的蒸腾作用, 从而降低了茎的Cd含量。此外, 干旱还会影响到植物根的形态特征, 从而影响植物对Cd的吸收。Shi等[30]研究表明, 蓖麻(Ricinus communis L.)在干旱条件下, 根部生长受到抑制, 且形态发生变化, 最终使其减少Cd的积累。本试验中, 同一土壤Cd含量下, 小麦Cd总含量(根茎叶Cd含量之和)随干旱胁迫程度增大而减少, 这与Shi等[30]的研究结论相一致; 但茎部及叶部的Cd含量变化规律与前人[29-30]的研究结果不同, 推测原因可能是试验材料及处理条件的差异。
Cd及干旱胁迫都会影响到麦长管蚜取食。武晶晶等[22]的研究表明, 当土壤中重金属含量大于40 mgkg−1时, 重金属含量越高, 麦长管蚜取食行为受影响的程度越大, 包括np波(非刺探电位)的增多, 首次出现取食行为的时间延长等。张丽等[1]的研究表明, 低剂量的Zn2+促进麦长管蚜对小麦的取食, 而高剂量Zn2+则对其有抑制作用。适度的干旱胁迫会增加植物韧皮部汁液中的必需氨基酸含量, 有利于蚜虫及其他刺吸式昆虫取食, 而过度的干旱胁迫会使韧皮部汁液中的糖浓度升高, 增加了其渗透压, 会降低其取食率[31-33]。戴鹏[34]在研究麦长管蚜对缺水胁迫的响应时发现, 重度干旱胁迫显著缩短了麦长管蚜在小麦上的被动取食时间。重金属主要通过麦长管蚜取食进入其体内, 所以干旱胁迫最终导致了麦长管蚜体内重金属含量的变化。
本研究中, 土壤Cd含量为100 mgkg−1时麦长管蚜体内Cd含量反而低于200 mgkg−1处理, 这与宋亚茜[35]的研究结果相似, 其研究表明, 在Cd含量大于40 mgkg−1时, 随Cd浓度升高, 麦长管蚜体内累积Cd反而减少。推测造成此现象的原因是:过高的Cd浓度致使麦长管蚜取食量减少, 而麦长管蚜会通过排泄作用排出体内的重金属, 且取食的Cd浓度越高, 蜜露中的Cd含量越高[23, 36]。
本研究仅探究了重金属Cd与干旱双重胁迫下, Cd在小麦及蚜虫系统中的转移规律, 但各部分Cd含量及转移系数的差异的原因还需更多后续试验进一步阐明。同时自然界中还有其他重金属如Zn、Cu、Al等, 此外还有化学农药等, 这些会对蚜虫造成更多重的胁迫, 这些研究更为复杂和具有现实意义, 有待于进一步探索与研究。
4 结论干旱胁迫影响了Cd在土壤-小麦-蚜虫系统上的转移与积累。其中干旱胁迫对小麦不同部位Cd积累的影响不同, 其抑制了小麦根部Cd的积累而促进了茎部Cd的积累。对于蚜虫, 中度干旱胁迫更有利于Cd在其体内的积累。在高浓度Cd处理下, 小麦Cd积累高于低浓度Cd处理。而在蚜虫体内, 高浓度Cd处理下的Cd积累反而低于低浓度的Cd处理。
| [1] |
张丽, 宋亚茜, 高欢欢, 等. 重金属Zn2+胁迫下麦长管蚜的取食行为[J]. 生态学报, 2016, 36(9): 2537-2543. ZHANG L, SONG Y X, GAO H H, et al. The effects of long-time exposure of Zn2+ on the feeding behavior of English green aphid[J]. Acta Ecologica Sinica, 2016, 36(9): 2537-2543. |
| [2] |
王秀丽, 徐建民, 姚槐应, 等. 重金属铜、锌、镉、铅复合污染对土壤环境微生物群落的影响[J]. 环境科学学报, 2003, 23(1): 22-27. WANG X L, XU J M, YAO H Y, et al. Effects of Cu, Zn, Cd and Pb compound contamination on soil microbial community[J]. Acta Scientiae Circumstantiae, 2003, 23(1): 22-27. DOI:10.3321/j.issn:0253-2468.2003.01.005 |
| [3] |
T PPERWIEN S, XUE H, BEHRA R, et al. Cadmium accumulation in Scenedesmus vacuolatus under freshwater conditions[J]. Environmental Science and Technology, 2007, 41(15): 5383-5388. DOI:10.1021/es070657l |
| [4] |
王宏镔, 束文圣, 蓝崇钰. 重金属污染生态学研究现状与展望[J]. 生态学报, 2005, 25(3): 596-605. WANG H B, SHU W S, LAN C Y. Ecology for heavy metal pollution:recent advances and future prospects[J]. Acta Ecologica Sinica, 2005, 25(3): 596-605. DOI:10.3321/j.issn:1000-0933.2005.03.029 |
| [5] |
SHAHID M, DUMAT C, KHALID S, et al. Cadmium bioavailability, uptake, toxicity and detoxification in soil-plant system[M]. Cham: Springer International Publishing, 2016: 73-137.
|
| [6] |
WANG X M, ZHANG C, QIU B L, et al. Biotransfer of Cd along a soil-plant-mealybug-ladybird food chain:A comparison with host plants[J]. Chemosphere, 2017, 168: 699-706. DOI:10.1016/j.chemosphere.2016.11.005 |
| [7] |
ZHUANG P, ZOU H L, SHU W S. Biotransfer of heavy metals along a soil-plant-insect-chicken food chain:Field study[J]. Journal of Environmental Sciences, 2009, 21(6): 849-853. DOI:10.1016/S1001-0742(08)62351-7 |
| [8] |
RAN X F, LIU R, XU S, et al. Assessment of growth rate, chlorophyll a fluorescence, lipid peroxidation and antioxidant enzyme activity in Aphanizomenon flos-aquae, Pediastrum simplex and Synedra acus exposed to cadmium[J]. Ecotoxicology, 2015, 24(2): 468-477. DOI:10.1007/s10646-014-1395-3 |
| [9] |
燕江伟, 李昌晓, 崔振, 等. 干旱胁迫下镉处理对互叶醉鱼草幼苗生长、镉积累及光合生理的影响[J]. 生态学报, 2017, 37(21): 7242-7250. YAN J W, LI C X, CUI Z, et al. Effects of cadmium on growth, cadmium accumulation, and photosynthetic physiology of Buddleja alternifolia Maxim. seedlings under drought stress[J]. Acta Ecologica Sinica, 2017, 37(21): 7242-7250. |
| [10] |
DEGRYSE F, BUEKERS J, SMOLDERS E. Radio-labile cadmium and zinc in soils as affected by pH and source of contamination[J]. European Journal of Soil Science, 2004, 55(1): 113-122. |
| [11] |
BARANČ KOV G, MADAMS M, RYB R O. Crop contamination by selected trace elements[J]. Journal of Soils and Sediments, 2004, 4(1): 37-42. DOI:10.1007/BF02990827 |
| [12] |
MENON M, HERMLE S, ABBASPOUR K C, et al. Water regime of metal-contaminated soil under juvenile forest vegetation[J]. Plant and Soil, 2005, 271(1/2): 227-241. |
| [13] |
GUSIATIN Z M, KLIMIUK E. Metal (Cu, Cd and Zn) removal and stabilization during multiple soil washing by saponin[J]. Chemosphere, 2012, 86(4): 383-391. DOI:10.1016/j.chemosphere.2011.10.027 |
| [14] |
JALLOH M A, CHEN J H, ZHEN F R, et al. Effect of different N fertilizer forms on antioxidant capacity and grain yield of rice growing under Cd stress[J]. Journal of Hazardous Materials, 2009, 162(2/3): 1081-1085. DOI:10.1016/j.jhazmat.2008.05.146 |
| [15] |
HONG K, TOKUNAGA S, KAJIUCHI T. Evaluation of remediation process with plant-derived biosurfactant for recovery of heavy metals from contaminated soils[J]. Chemosphere, 2002, 49(4): 379-387. DOI:10.1016/S0045-6535(02)00321-1 |
| [16] |
DAI A G. Drought under global warming:a review[J]. Wiley Interdisciplinary Reviews:Climate Change, 2011, 2(1): 45-65. DOI:10.1002/wcc.81 |
| [17] |
MISHRA A K, SINGH V P. A review of drought concepts[J]. Journal of Hydrology, 2010, 391(1/2): 202-216. |
| [18] |
HSIAO T C. Plant responses to water stress[J]. Annual Review of Plant Physiology, 1973, 24(1): 519-570. DOI:10.1146/annurev.pp.24.060173.002511 |
| [19] |
FIEBIG M, POEHLING H M, BORGEMEISTER C. Barley yellow dwarf virus, wheat, and Sitobion avenae:a case of trilateral interactions[J]. Entomologia Experimentalis et Applicata, 2004, 110(1): 11-21. DOI:10.1111/j.0013-8703.2004.00115.x |
| [20] |
GALLEY D J. Aphids on the world's crops:An identification and information guide[J]. Crop Protection, 1985, 4(3): 403. DOI:10.1080/00305316.2001.10417292 |
| [21] |
GAO H H, ZHAO H Y, DU C, et al. Life table evaluation of survival and reproduction of the aphid, Sitobion avenae, exposed to cadmium[J]. Journal of Insect Science, 2012, 12(44): 1-9. DOI:10.1673/031.012.4401 |
| [22] |
武晶晶, 高欢欢, 白小惠, 等. 镉胁迫对麦长管蚜取食行为的影响[J]. 西北农业学报, 2012, 21(12): 198-201. WU J J, GAO H H, BAI X H, et al. Effect of Cd2+ stress on feeding behavior of the aphid Sitobion avenae (Fabricius)[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2012, 21(12): 198-201. DOI:10.7606/j.issn.1004-1389.2012.12.039 |
| [23] |
DAR M I, GREEN I D, NAIKOO M I, et al. Assessment of biotransfer and bioaccumulation of cadmium, lead and zinc from fly ash amended soil in mustard-aphid-beetle food chain[J]. Science of the Total Environment, 2017, 584/585: 1221-1229. DOI:10.1016/j.scitotenv.2017.01.186 |
| [24] |
NISHIZONO H, ICHIKAWA H, SUZIKI S, et al. The role of the root cell wall in the heavy metal tolerance of Athyrium yokoscense[J]. Plant and Soil, 1987, 101(1): 15-20. DOI:10.1007/BF02371025 |
| [25] |
AHMAD P, NABI G, ASHRAF M. Cadmium-induced oxidative damage in mustard[Brassica juncea (L.) Czern. & Coss.] plants can be alleviated by salicylic acid[J]. South African Journal of Botany, 2011, 77(1): 36-44. DOI:10.1016/j.sajb.2010.05.003 |
| [26] |
张丙春, 王磊, 孟立红, 等. 镉胁迫下春小麦中镉的分布、富集及转移规律[J]. 生态学杂志, 2010, 29(12): 2521-2524. ZHANG B C, WANG L, MENG L H, et al. Distribution, enrichment, and transfer of cadmium in spring wheat under cadmium stress[J]. Chinese Journal of Ecology, 2010, 29(12): 2521-2524. |
| [27] |
李江遐, 张军, 马友华, 等. 不同水稻品种对镉的吸收转运及其非蛋白巯基含量的变化[J]. 生态环境学报, 2017, 26(12): 2140-2145. LI J X, ZHANG J, MA Y H, et al. Uptake and translocation of cadmium and content of non-protein thiols in different rice cultivars[J]. Ecology and Environmental Sciences, 2017, 26(12): 2140-2145. |
| [28] |
何勇强, 陶勤南, 小畑仁, 等. 镉胁迫下大豆中镉的分布状况及其籽粒品质[J]. 环境科学学报, 2000, 20(4): 510-512. HE Y Q, TAO Q N, OBATA H, et al. Distribution of cadmium in soybean and quality of soybean seed under cadmium stress[J]. Acta Scientiae Circumstantiae, 2000, 20(4): 510-512. DOI:10.3321/j.issn:0253-2468.2000.04.026 |
| [29] |
LIU X Q, PENG K J, WANG A G, et al. Cadmium accumulation and distribution in populations of Phytolacca americana L. and the role of transpiration[J]. Chemosphere, 2010, 78(9): 1136-1141. DOI:10.1016/j.chemosphere.2009.12.030 |
| [30] |
SHI G R, XIA S L, YE J, et al. PEG-simulated drought stress decreases cadmium accumulation in Castor bean by altering root morphology[J]. Environmental and Experimental Botany, 2015, 111: 127-134. DOI:10.1016/j.envexpbot.2014.11.008 |
| [31] |
HALE B K, BALE J S, PRITCHARD J, et al. Effects of host plant drought stress on the performance of the bird cherry-oat aphid, Rhopalosiphum padi (L.):a mechanistic analysis[J]. Ecological Entomology, 2003, 28(6): 666-677. DOI:10.1111/j.1365-2311.2003.00563.x |
| [32] |
ISAACS R, BYRNE D N, HENDRIX D L. Feeding rates and carbohydrate metabolism by Bemisia tabaci (Homoptera:Aleyrodidae) on different quality phloem saps[J]. Physiological Entomology, 1998, 23(3): 241-248. DOI:10.1046/j.1365-3032.1998.233080.x |
| [33] |
AN NGUYEN T T, MICHAUD D, CLOUTIER C. Proteomic profiling of aphid Macrosiphum euphorbiae responses to host-plant-mediated stress induced by defoliation and water deficit[J]. Journal of Insect Physiology, 2007, 53(6): 601-611. DOI:10.1016/j.jinsphys.2007.02.018 |
| [34] |
戴鹏.不同干旱地区麦长管蚜对缺水胁迫的响应及其遗传基础[D].杨凌: 西北农林科技大学, 2016: 41-42 DAI P. Responses of Sitobion avenae (Fabricius) to water-deficit stress and the underlying genetic basis[D]. Yangling: Northwest A & F University, 2016: 41-42 |
| [35] |
宋亚茜. Cd与Zn长期共同胁迫对麦长管蚜种群生态系统影响的研究[D].杨凌: 西北农林科技大学, 2016 SONG Y X. The effect of long-term combined stress of cadmium and zinc on the population ecosystem of Sitobion avenae (Hemiptera: Aphididae)[D]. Yangling: Northwest A & F University, 2016 |
| [36] |
CRAWFORD L A, HODKINSON I D, LEPP N W. The effects of elevated host-plant cadmium and copper on the performance of the aphid Aphis fabae (Homoptera:Aphididae)[J]. The Journal of Applied Ecology, 1995, 32(3): 528. DOI:10.2307/2404650 |
 2019, Vol. 27
2019, Vol. 27



