土壤盐渍化是全世界农业面临的严重问题[1], 土壤耕作层盐分的积累主要来自于含有微量氯化钠的灌溉水和海水[2]。我国盐碱地面积大、分布广、类型丰富, 主要分布在东北、西北、华北及滨海地区[3], 盐荒地约0.2亿hm2, 其中盐碱耕地达670万hm2, 约占全国耕地面积的1/4[4-5]。在耕地盐渍化加剧与水资源稀缺的双重压力下, 选育耐盐碱的农作物品种以开发利用盐碱地及沿海滩涂来保障粮食安全和严守耕地红线成为需迫切化解的农业难题。而耐盐碱水稻(俗称海水稻, sea rice)作为沿海滩涂和盐碱地开发利用的先锋作物, 成为盐碱地修复与利用的有效措施, 为解决粮食安全问题提供了新途径[6]。
探究盐胁迫下耐盐水稻的生理生化代谢活动与耐受机制, 是耐盐碱水稻选育的基础, 近两年海水稻的耐盐碱机制成为了研究热点, 目前有关海水稻的耐盐生理和耐盐种质选育已取得阶段性成果。1939年首次在斯里兰卡繁殖了强耐盐水稻品种‘Pokkali’[7], 并获得大面积推广种植。EI-Shabrawi等[8]和Kabir等[9]研究发现NaCl胁迫下耐盐品种‘Pokkali’通过保持较高的甲基二乙醛解毒系统关键酶(乙二醛酶Ⅰ和Ⅱ)活性, 降低抗坏血酸盐/脱氢抗坏血酸的比率, 提高抗氧化酶活性增加其耐盐性。耐盐水稻品种‘FL478’受盐胁迫早期通过抑制有机酸(OA)代谢以抑制其生长来适应盐胁迫, 生长后期自身积累大量的可溶性糖和氨基酸等小分子渗透调节物质缓解渗透胁迫, 提高自身的抗逆性[10-11]。Prusty等[12]对在高盐度(240 mmol∙L-1 NaCl)下22个野生稻品种以及海水稻‘Pokkali’ ‘Nona Bokra’和‘FL478’, 并以盐敏感品种‘IR29’为对照进行耐盐评价, 发现野生耐受植株和海水稻较感盐品种根系Na+浓度较低, 叶片组织耐盐性高, 芽中丙二醛含量低, 幼叶叶绿素积累量较高。Domingo等[13]通过伽玛射线诱导120 mmol∙L-1 NaCl浓度下的盐敏感水稻种子, 并成功获得3份耐盐突变体, 发现盐胁迫下编码茉莉酸-甲基转移酶的基因下调, 产生的茉莉酮酸参与耐盐反应, 提高抗性。海水稻新品种‘海稻86’是栽培稻的野生近源种, 通过体内积累较多的脯氨酸与可溶性糖降低渗透压, 维持渗透平衡, 中度盐胁迫下膜脂过氧化物质丙二醛、活性氧积累较少, 因此具有较高的强耐盐碱特性[14-15]。虽然对耐盐水稻耐盐生理特性的研究已有较多报导, 但是强耐盐碱水稻种质资源的缺乏是限制水稻耐盐生理调控机制研究和耐盐种质创新的瓶颈[15], 海水稻的选育为水稻抗盐生理生化特性的深入研究和揭示其耐盐机制提供了机遇。
本研究选取海水稻品种‘Pokkali’ ‘FL478’ ‘JX99’和盐敏感水稻品种‘IR29’为材料, 设置6个盐胁迫梯度, 采用盆栽试验, 测定孕穗期8个生理生化指标, 探索渗透调节物质、相关性酶与水稻耐盐性的关系, 以揭示海水稻的脯氨酸合成与调节的响应机制, 为耐盐基因的发掘和耐盐品种的选育提供理论依据。
1 材料与方法 1.1 试验材料供试水稻品种为‘IR29’ ‘JX99’‘FL478’和‘Pokkali’。其中, ‘FL478’是矮杆且感光性钝感型、耐盐碱性海水稻; ‘JX99’是矮杆且感光性钝感型、强耐盐碱性海水稻; ‘Pokkali’是强耐盐碱性海水稻; ‘IR29’是盐敏感型水稻品种, 作为对照材料。4份水稻材料均由广东海洋大学农学院提供。
本试验在广东海洋大学农业生物技术研究所(110°29′E, 21°15′N)试验区进行。选取广东海洋大学农学院试验田耕作层(0~20 cm)水稻土作为盆栽基土, 土壤有机质含量32.86 g·kg-1, 全磷0.46 g·kg-1, 速效磷65.00 mg·kg-1, 全钾22.41 g·kg-1, 速效钾117.21 mg·kg-1, 水溶性总盐0.85 g·kg-1, 碱解氮177.45 mg·kg-1, pH 6.47。土样风干碾碎后过1号筛(筛孔尺寸: 2.00 mm; 标准目数: 10目), 充分混匀, 添加不同质量的NaCl混合均匀后装桶(内径30 cm, 高35 cm, 无渗漏), 每桶装15 kg。
1.2 水稻幼苗的培养2016年7月12日, 人工精选各水稻品种的饱满籽粒, 先用蒸馏水浸泡5 min后, 去除不实籽粒。用3%的H2O2浸泡20 min, 用去离子水冲洗干净并均匀平铺于无菌培养皿中, 放置30 ℃种子培养箱下催芽48 h, 期间换水6次并保持培养皿湿润, 待种子露白后种植于广东海洋大学农学院水稻试验田中进行幼苗培育。
1.3 盐胁迫处理2016年7月27日, 取过筛后的风干土, 按照土壤含盐量(土壤含盐量=NaCl添加量/土壤量)计算, 添加不同量的NaCl(AR分析纯), 依次形成5个NaCl处理梯度, 分别为1 g·kg-1、2 g·kg-1、3 g·kg-1、4 g·kg-1和5 g·kg-1, 以不添加NaCl为对照。每桶施4 g水稻专用复合肥(含氮18%、磷12%、钾16%, ‘洋丰正好’牌水稻专用肥, 2016年5月产)作为基肥, 随机区组试验设计, 6个处理, 每个处理组合12桶, 共72桶。
秧苗移栽前多次搅拌桶内土壤, 将土壤和盐充分搅拌均匀。2016年8月6日, 待水稻长至3叶1心, 选取长势均匀的秧苗, 移栽到试验桶中, 每桶6棵。将试验桶放在广东海洋大学农业生物技术研究所防雨大棚内, 每天通过称重加水, 每桶插入相同刻度的标尺保持2 cm水层。生长期间每天早、晚观察水稻的生长状况, 并拍照记录, 使用土壤含盐量测试仪(台湾衡欣Az8371型)每天监测桶内耕作层土壤含盐量、电导率, 以保证整个生育期水稻耕作层(0~20 cm)土壤平均含盐量及电导率相对稳定(表 1)。
| 表 1 盆栽试验中不同处理的水稻耕作层(0~20 cm)土壤含盐量 Table 1 Salt contents of topsoil (0-20 cm) of rice cultivation in pot experiment under different treatments |
2016年9月22日(水稻孕穗期)采样, 每桶选取3株长势一致的整株, 根系清洗干净, 并拍照记录。
叶绿素含量测定采用浸提法[16]。脯氨酸含量采用磺基水杨酸法进行测定[17]。可溶性糖含量的测定参照蒽酮比色法[18]进行测定。叶片细胞膜透性的测定按照李合生[19]的方法, 使用电导率仪(DDS-307型电导率仪, 雷磁-上海仪电科学仪器股份有限公司生产)测定叶片电导率。丙二醛含量采用硫代巴比妥酸显色法[20]进行测定。Δ1-吡咯啉-5-羧酸合成酶(delta-1-pyrroline- 5-carboxylate synthase, P5CS)活性测定参照Hayzer等[21]与韩晓玲[22]的盐酸羟胺比色法测定, 酶活力单位: U·g-1·min-1, 一个酶活单位(1U)定义为每分钟生成1 μmol γ-谷氨酰胺(湿样)所需要的酶量。鸟氨酸-δ-氨基转移酶(ornithine-δ-aminotransferase, δ-OAT)活性的测定按照Hu等[23]与Kim等[24]的方法测定, 一个酶活性单位(1 U)定义为1 h生成1 mmol Δ1-吡咯啉-5-羧酸(湿样)所需要的酶量, 单位为U·g-1·h-1。超氧化物歧化酶(SOD)活性的测定采用总SOD活性检测试剂盒(产品货号: A001-1羟胺法, 南京建成生物工程研究所2016年8月生产)测定, 操作按照总SOD活性检测说明书进行。
1.5 数据分析运用SPSS 19.0软件对数据进行双因素方差分析[25]和相关性分析[26-27]。作图通过Microsoft Excel 2010软件完成。
2 结果与分析 2.1 盐胁迫对海水稻叶绿素含量与可溶性糖含量的影响随着土壤含盐量的增加, 4个水稻品种叶绿素含量呈明显下降趋势(图 1)。不同品种对不同盐浓度的响应也不同。同一盐胁迫下, 3个海水稻品种间的叶绿素含量差异不显著, 而在0~4 g·kg-1土壤含盐量下‘FL478’和‘Pokkali’的叶绿素含量显著高于盐敏感品种‘IR29’。在0 g·kg-1、2 g·kg-1、5 g·kg-1土壤含盐量下, 海水稻品种‘JX99’与‘FL478’的叶绿素含量差异显著, 而海水稻品种‘Pokkali’的叶绿素含量差异不显著。说明盐胁迫对海水稻品种叶绿素的合成与积累影响较小, 而对盐敏感品种‘IR29’的影响较大。
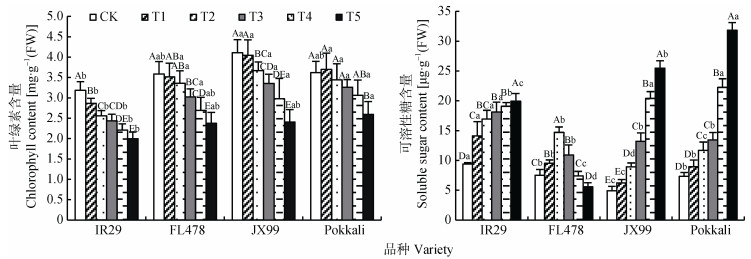
|
图 1 盐胁迫对海水稻叶绿素、可溶性糖含量的影响 Fig. 1 Contents of chlorophyll and soluble sugar of sea-rice under different salt stresses ‘FL478’ ‘JX99’和‘Pokkali’为耐盐水稻品种; ‘IR29’是盐敏感型水稻品种, 作为对照。处理CK、T1、T2、T3、T4和T5分别在土壤中添加0 g·kg-1、1 g·kg-1、2 g·kg-1、3 g·kg-1、4 g·kg-1和5 g·kg-1的NaCl。不同大写字母表示同一水稻品种不同盐浓度之间差异显著(Duncan法, P < 0.05);不同小写字母表示同一盐浓度不同水稻品种间差异显著(Duncan法, P < 0.05)。‘FL478' ‘JX99' and ‘Pokkali' are sea-rice cultivars, ‘IR29' is salt-sensitive rice cultivar. In treatments CK, T1, T2, T3, T4, and T5, 0 g·kg-1, 1 g·kg-1, 2 g·kg-1, 3 g·kg-1, 4 g·kg-1 and 5 g·kg-1 NaCl are added to base soil, respectively. Different capital letters indicate significant differences among different salt contents for the same rice cultivar (Duncan method, P < 0.05). Different lowercase letters indicate significant differences among rice cultivars at the same salt content (Duncan method, P < 0.05). |
随土壤含盐量的增加, 4个水稻品种可溶性糖含量变化有差异:盐敏感品种‘IR29’、海水稻品种‘Pokkali’和‘JX99’的可溶性糖含量逐渐升高, ‘FL478’的可溶性糖含量却呈先升后降的趋势。0~3 g·kg-1盐胁迫下, 盐敏感水稻‘IR29’叶绿素含量差异显著高于海水稻品种。海水稻品种‘JX99’、‘FL478’和‘Pokkali’的可溶性糖积累量分别在3~5 g·kg-1土壤含盐量间差异显著。土壤含盐量为4~5 g·kg-1时, 海水稻品种‘JX99’和‘Pokkali’的可溶性糖含量显著高于盐敏感品种‘IR29’。说明盐胁迫促进海水稻植株可溶性糖的合成与积累, 随着土壤含盐量的增加, 海水稻在抵抗盐胁迫伤害时积累较多的可溶性糖以缓解盐胁迫伤害, 表现出较强的耐盐能力。
2.2 盐胁迫对海水稻脯氨酸含量、脯氨酸代谢关键酶活性的影响脯氨酸是植物细胞质中小分子游离氨基酸, 作为优质的渗透调节剂, 可缓解盐胁迫逆境、维持细胞结构的完整性, 可作为耐盐筛选的指标[28-29]。不同盐处理下的海水稻叶片脯氨酸含量均明显高于对照(图 2)。同一盐处理下, 海水稻品种‘Pokkali’和‘JX99’与盐敏感水稻品种‘IR29’间的脯氨酸积累量呈显著差异。4个水稻品种在不同盐处理间水稻叶片脯氨酸积累量存在显著差异, 且均高于CK处理。土壤含盐量在2 g·kg-1下‘IR29’的游离脯氨酸积累量达到峰值, 而海水稻在3 g·kg-1达到峰值, 而土壤含盐量为3~5 g·kg-1时, ‘Pokkali’和‘JX99’游离脯氨酸含量仍保持较高水平。说明盐胁迫促进水稻脯氨酸的积累, 海水稻‘Pokkali’和‘JX99’合成较多的游离脯氨酸, 增强了海水稻的耐盐性。
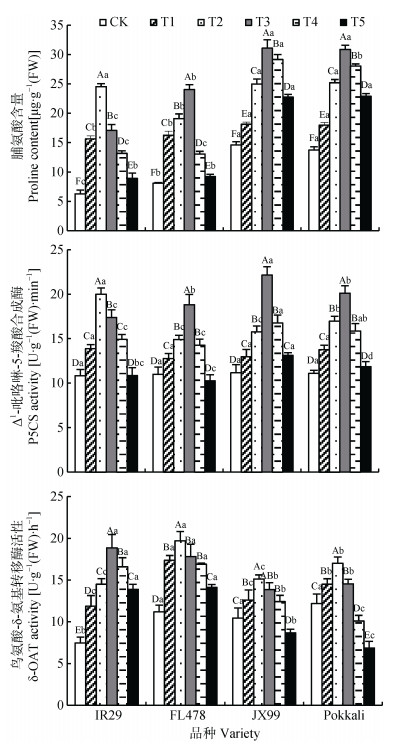
|
图 2 盐胁迫对海水稻脯氨酸含量、脯氨酸代谢关键酶活性的影响 Fig. 2 Content of proline and activities of key enzymes (delta-1-pyrroline-5-carboxylate synthase, P5CS; ornithine -δ-aminotransferase, δ-OAT) involved in proline metabolism of sea-rice under different salt stresses ‘FL478’ ‘JX99’和‘Pokkali’为耐盐水稻品种; ‘IR29’是盐敏感型水稻品种, 作为对照。处理CK、T1、T2、T3、T4和T5分别在土壤中添加0 g·kg-1、1 g·kg-1、2 g·kg-1、3 g·kg-1、4 g·kg-1和5 g·kg-1的NaCl。不同大写字母表示同一水稻品种不同盐浓度之间差异显著(Duncan法, P < 0.05);不同小写字母表示同一盐浓度不同水稻品种间差异显著(Duncan法, P < 0.05)。‘FL478' ‘JX99' and ‘Pokkali' are sea-rice cultivars, ‘IR29' is salt-sensitive rice cultivar. In treatments CK, T1, T2, T3, T4, and T5, 0 g·kg-1, 1 g·kg-1, 2 g·kg-1, 3 g·kg-1, 4 g·kg-1 and 5 g·kg-1 NaCl are added to base soil, respectively. Different capital letters indicate significant differences among different salt contents for the same rice cultivar (Duncan method, P < 0.05). Different lowercase letters indicate significant differences among rice cultivars at the same salt content (Duncan method, P < 0.05). |
逆境胁迫下, 植物脯氨酸的合成与积累有2条途径:谷氨酸途径中P5CS是关键酶, 鸟氨酸途径中δ-OAT是调节脯氨酸合成的主要调控酶[30-31]。4个水稻品种的P5CS、δ-OAT活性在盐胁迫处理后呈先升高后降低的趋势, 其中P5CS活性和δ-OAT活性变化与脯氨酸含量的变化趋势具有同步一致性(图 2)。Duncan方差分析发现土壤含盐量为3 g·kg-1时, 海水稻的P5CS活性增幅较大, 其δ-OAT活性在2 g·kg-1盐浓度下增幅较大, 而盐敏感水稻‘IR29’的P5CS、δ-OAT活性呈相反的结果。水稻品种在不同土壤盐浓度间的P5CS活性差异显著。土壤含盐量在0~1 g·kg-1下4个水稻品种间P5CS活性差异不明显, 而3~4 g·kg-1土壤盐浓度下海水稻与盐敏感品种‘IR29’间差异显著。在2 g·kg-1土壤盐浓度下海水稻品种的δ-OAT活性达到峰值, 均显著高于盐敏感品种‘IR29’, 而盐敏感水稻的δ-OAT活性在3 g·kg-1土壤盐浓度下达到峰值, 保持较高水平。在1~4 g·kg-1土壤盐浓度下海水稻品种间的δ-OAT活性差异显著, 3~5 g·kg-1的盐浓度下盐敏感品种‘IR29’与‘FL478’间的δ-OAT活性差异不显著, 而显著高于‘Pokkali’和‘JX99’。说明水稻遭受盐胁迫时, 其P5CS、δ-OAT酶协同促进脯氨酸合成与积累, 而3~5 g·kg-1盐胁迫海水稻P5CS活性代谢活跃高于对照, 以生成较多的游离脯氨酸缓解盐胁迫伤害, 抗盐能力较强, 表现出较强的耐盐性, 与上述研究结果一致。
2.3 盐胁迫对海水稻丙二醛含量、膜透性的影响植物在逆境下遭受伤害, 往往发生膜脂过氧化作用, 丙二醛(MDA)是膜脂过氧化的最终分解产物, 其含量可以反映植物遭受逆境伤害的程度[32]。随着盐胁迫程度加剧, 4个水稻品种的叶片MDA含量逐渐升高, 且变化趋势一致, 均在5 g·kg-1盐浓度下达到最大值(图 3)。盐浓度0~1 g·kg-1下, 4个水稻品种间MDA的积累量无显著差异, 而2~5 g·kg-1盐浓度下3个海水稻品种的MDA积累量显著低于盐敏感水稻‘IR29’。同一个水稻品种的MDA积累量在盐浓度为0~1 g·kg-1间差异不显著, 而在3~5 g·kg-1胁迫下差异显著。结果表明盐胁迫加剧迫使MDA积累量增加, 海水稻品种较盐敏感品种IR29积累较少的MDA, 细胞膜脂过氧化伤害较小, 表现出强耐盐性。
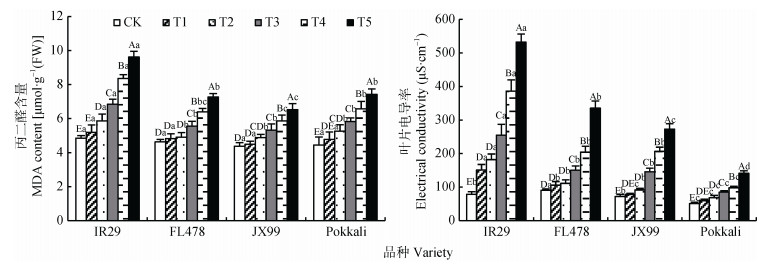
|
图 3 盐胁迫对海水稻丙二醛含量、膜透性的影响 Fig. 3 Content of malondialdehyde (MDA) and cell membrane permeability of sea-rice under different salt stresses ‘FL478’ ‘JX99’和‘Pokkali’为耐盐水稻品种; ‘IR29’是盐敏感型水稻品种, 作为对照。处理CK、T1、T2、T3、T4和T5分别在土壤中添加0 g·kg-1、1 g·kg-1、2 g·kg-1、3 g·kg-1、4 g·kg-1和5 g·kg-1的NaCl。不同大写字母表示同一水稻品种不同盐浓度之间差异显著(Duncan法, P < 0.05);不同小写字母表示同一盐浓度不同水稻品种间差异显著(Duncan法, P < 0.05)。‘FL478' ‘JX99' and ‘Pokkali' are sea-rice cultivars, ‘IR29' is salt-sensitive rice cultivar. In treatments CK, T1, T2, T3, T4, and T5, 0 g·kg-1, 1 g·kg-1, 2 g·kg-1, 3 g·kg-1, 4 g·kg-1 and 5 g·kg-1 NaCl are added to base soil, respectively. Different capital letters indicate significant differences among different salt contents for the same rice cultivar (Duncan method, P < 0.05). Different lowercase letters indicate significant differences among rice cultivars at the same salt content (Duncan method, P < 0.05). |
水稻细胞膜是最先感知逆境胁迫的细胞器, 逆境因子最先破坏细胞膜的结构和功能, 导致电解质外渗, 细胞内电导率增加, 直接反映水稻细胞膜受损程度[33-34]。随土壤含盐量的增加, 4个水稻品种叶片电导率逐渐增大, 在5 g·kg-1浓度下水稻叶片的电导率达到最大值(图 3)。同一盐胁迫下, 海水稻品种间差异不显著, 而与盐敏感品种间显著差异, 其中盐敏感品种‘IR29’的电导率增幅明显, 显著高于海水稻品种。同一水稻品种在0~2 g·kg-1盐浓度间的电导率无显著差异, 而3~5 g·kg-1间的水稻叶片电导率达显著差异。整个盐胁迫下, 叶片电导率的大小排列为: ‘IR29’ > ‘FL478’ > ‘JX99’ > ‘Pokkali’。说明盐胁迫破坏了细胞膜的完整性, 土壤含盐量越高, 细胞膜受损越大, 其中盐敏感品种细胞膜受损严重, 而海水稻的细胞膜受损程度较小, 表现出较强的抗盐性。
2.4 盐胁迫对海水稻抗氧化酶活性的影响盐渍环境下, 超氧化物歧化酶(SOD)作为抗氧化系统主要酶, 能清除植物体内活性氧, 减轻对植物的毒害作用[35]。随着土壤含盐量的增加, 4个水稻种质的SOD活性均呈先升高后降低的趋势, 而盐胁迫下4个水稻品种的SOD活性均显著高于非盐胁迫对照(图 4)。在2 g·kg-1盐浓度盐敏感品种‘IR29’的SOD活性达到峰值, 而海水稻品种均在3 g·kg-1达最大值, 海水稻‘JX99’和‘Pokkali’的SOD活性均显著低于盐敏感品种‘IR29’。说明盐胁迫促进水稻SOD活性增加, 其中盐敏感品种‘IR29’的SOD活性较高, 而3~5 g·kg-1盐浓度, 水稻SOD活性逐渐受到抑制。

|
图 4 盐胁迫对海水稻超氧化物歧化酶活性的影响 Fig. 4 Effect of salt stress on superoxide dismutase (SOD) activity of sea-rice ‘FL478’ ‘JX99’和‘Pokkali’为耐盐水稻品种; ‘IR29’是盐敏感型水稻品种, 作为对照。处理CK、T1、T2、T3、T4和T5分别在土壤中添加0 g·kg-1、1 g·kg-1、2 g·kg-1、3 g·kg-1、4 g·kg-1和5 g·kg-1的NaCl。不同大写字母表示同一水稻品种不同盐浓度之间差异显著(Duncan法, P < 0.05);不同小写字母表示同一盐浓度不同水稻品种间差异显著(Duncan法, P < 0.05)。‘FL478' ‘JX99' and ‘Pokkali' are sea-rice cultivars, ‘IR29' is salt-sensitive rice cultivar. In treatments CK, T1, T2, T3, T4, and T5, 0 g·kg-1, 1 g·kg-1, 2 g·kg-1, 3 g·kg-1, 4 g·kg-1 and 5 g·kg-1 NaCl are added to base soil, respectively. Different capital letters indicate significant differences among different salt contents for the same rice cultivar (Duncan method, P < 0.05). Different lowercase letters indicate significant differences among rice cultivars at the same salt content (Duncan method, P < 0.05). |
本研究中, 盐胁迫下海水稻各生理指标不是独立起作用的, 而是各指标间存在相关性(表 2)。通过简单和偏相关综合分析发现, 脯氨酸与可溶性糖含量、P5CS活性之间达到极显著正相关(P < 0.01), 简单相关系数分别是0.547和0.815, 而偏相关系数分别为0.626、0.888。说明盐胁迫下, 海水稻各生理指标对脯氨酸的合成影响较大, 为消除各变量间的综合影响, 偏相关分析发现可溶性糖、P5CS活性均与脯氨酸含量净相关关系较紧密, 起正效应。MDA含量与细胞膜透性、可溶性糖含量呈正的简单相关和偏相关性, 均达极显著水平, 但是MDA含量与叶绿素含量、δ-OAT活性之间达到极显著水平的负简单相关和偏相关性, MDA含量与SOD活性间的正简单相关无显著性, 两个指标间却达到极显著的正偏相关性, 说明受盐胁迫海水稻体内MDA的积累与细胞膜透性关系紧密, 起正效应, 而δ-OAT活性、叶绿素含量与MDA含量之间相关关系和直接关系较密切, 却起负效应, 表明盐胁迫促进海水稻体内MDA的积累加剧了细胞膜透性增大, 降低了叶绿素含量, 而δ-OAT活性的增加却直接参与MDA的清除。SOD与P5CS、δ-OAT活性呈正简单相关性, 且达极显著水平, 与偏相关分析结果一致, 表明盐胁迫下海水稻抗逆酶SOD与P5CS、δ-OAT活性之间具有正向协同作用, 且关系密切。P5CS与δ-OAT活性呈简单负相关性, 且达到极显著水平, 而偏相关性却不显著, 说明盐胁迫下P5CS与δ-OAT通过与其他指标相互作用, 提高其活性, 来增加海水稻的抗逆性。
| 表 2 盐胁迫下海水稻抗逆生理指标间的相关性系数矩阵 Table 2 Correlation matrix among physiology indexes of stress resistance of sea-rice under salt stress |
水稻是沿海滩涂和盐碱地开发利用的首选粮食作物, 但是水稻对土壤中的盐分尤其是NaCl特别敏感[36-37]。水稻的耐盐性是复杂的生理生化过程, 涉及诸多性状基因、蛋白和多种耐盐机制的协调作用[38], 水稻不同耐盐性品种也存在耐盐性差异[39]。通过分析盐胁迫下海水稻抗盐生理反应, 以了解海水稻具体的耐盐性反应机制, 对解析耐盐生理生化机制和挖掘耐海水稻种质资源具有重要意义。
3.1 盐胁迫下海水稻的叶绿素合成与降解效应叶绿素含量是体现叶片衰老程度的指标之一, 盐胁迫促使叶片细胞Na+的积累, 提高叶绿素酶活性, 加速叶绿素的降解[40-41]。本研究结果表明, 土壤含盐量的增加,加速水稻叶绿素的降解, 同时叶绿素合成受阻, 但海水稻品种间对盐胁迫的响应基本相同, 叶绿素含量差异不显著, 但均显著高于盐敏感品种‘IR29’, 说明海水稻抗盐能力强, 表现出叶片衰老减缓, 具有较强的叶绿素合成及抗降解能力。
3.2 盐胁迫下海水稻的渗透调节物质合成与积累效应水稻在逆境下脯氨酸、可溶性糖作为有机渗透调节物质以及营养物质, 对生物膜及其蛋白质起到保护作用[42-43], Ghoulam等[44]和Li等[45]研究发现盐胁迫下水稻体内积累大量的游离脯氨酸和可溶性糖。本研究结果表明, 盐胁迫下水稻叶片的脯氨酸和可溶性糖逐渐积累, 其中海水稻叶片的脯氨酸的积累量显著高于盐敏感对照, 而在土壤含盐量0~3 g·kg-1胁迫下, 盐敏感叶片的可溶性糖含量显著高于海水稻, 土壤含盐量4~5 g·kg-1时, 海水稻叶片的可溶性糖积累量显著高于对照。说明盐胁迫促进海水稻植株可溶性糖和脯氨酸的合成与积累, 作为有机渗透调节物质共同调节渗透胁迫, 其中海水稻合成的可溶性糖一部分作为渗透调节物质缓解渗透胁迫, 另外一部分用于植株生长所需的营养原料, 同时也反映出海水稻具有较强的抗盐能力。
在渗透胁迫条件下, 植物体内P5CS、δ-OAT活性增加促进脯氨酸的合成与积累直接参与渗透调节[31, 46]。盐胁迫下海水稻植株的脯氨酸合成关键酶P5CS、δ-OAT及植物体内抗氧化酶SOD的活性与脯氨酸含量的变化趋势同步:随着盐胁迫增加均呈先升后降趋势, 这3个酶的活性均在3 g·kg-1盐胁迫下达到峰值, 其中3~5 g·kg-1盐胁迫海水稻P5CS活性明显高于盐敏感品种‘IR29’, 而此浓度胁迫下的海水稻δ-OAT活性却低于盐敏感对照。说明水稻遭受盐胁迫时, 0~3 g·kg-1的盐浓度胁迫激发P5CS、δ-OAT酶协同促进脯氨酸合成与积累, 而在3~5 g·kg-1的土壤含盐量胁迫下P5CS主要参与海水稻脯氨酸的合成。土壤含盐量超过3 g·kg-1, 随土壤盐浓度的增加抗逆相关的酶P5CS、δ-OAT、SOD活性降低, 但海水稻的脯氨酸含量仍保持较高水平, 说明海水稻具有较强的脯氨酸合成与积累能力、抗渗透胁迫能力和清除氧化作用能力, 海水稻吸收适量Na+, 可激发脯氨酸合成与积累的相关酶的活性而促进脯氨酸的合成与积累, 然而土壤含盐量超过3 g·kg-1, 海水稻叶片积累过多Na+导致海水稻体内离子不平衡, 引发生理生化代谢的紊乱, 致使植物细胞中叶绿体和线粒体电子传递的泄漏, 引起活性氧的大量积累, 对细胞内的酶类和膜系统造成伤害[47-48], 从而降低了植株脯氨酸的合成与积累。
3.3 盐胁迫下海水稻的氧化作用产物MDA积累与质膜透性效应MDA作为耐盐的生理指标之一, 是细胞内的不饱和脂肪酸氧化形成的产物, 大量积累会造成膜脂过氧化, 细胞膜透性增大[49]。细胞膜透性直接反映了植物叶片细胞膜的完整性及其受到伤害的程度, 在正常的生长条件下, 植物的质膜透性均较小[50]。本试验发现, 4个水稻品种受盐胁迫伤害时, 盐害特征差异明显, 盐胁迫下盐敏感水稻品种‘IR29’体内积累大量的膜脂过氧化产物MDA, 造成细胞膜大量的电解质外渗, 细胞膜的完整性破坏严重。海水稻品种体内MDA积累量较少, 其细胞膜脂过氧化伤害较小。说明盐胁迫下海水稻品种抗氧化能力较强, 其体内MDA积累量较少, 细胞抗氧化能力较强, 受盐害较小, 表现出强耐盐性。
3.4 耐盐海水稻的生理生化指标相关性通过对盐胁迫下海水稻抗逆指标间的互作关系进行相关性分析发现, 盐胁迫下可溶性糖、P5CS活性与脯氨酸含量简单相关和偏相关有极显著的正相关, 偏相关系数大于简单相关性系数, 说明盐胁迫使海水稻植株可溶性糖、P5CS直接参与脯氨酸的合成, 其中海水稻的可溶性糖可为脯氨酸的合成提供碳骨架原料和能量来源, 这与前人的研究结果一致[51-52]。MDA与细胞膜透性之间简单相关和偏相关系数达极显著正相关, 而与叶绿素含量呈显著负相关, 与SOD活性的直接关系达到正的极显著水平, 说明盐胁迫促进海水稻体内MDA的大量积累, 迫使细胞膜透性增大, 细胞膜结构破坏加剧, 叶绿素合成降低, 而受盐胁迫下的海水稻抗氧化酶SOD参与了MDA的清除, 降低膜脂过氧化伤害。盐胁迫促进海水稻SOD与P5CS、δ-OAT活性增加, 3个抗逆酶之间均达到极显著正相关和偏相关, 表明盐胁迫下海水稻抗逆酶SOD与P5CS、δ-OAT活性之间具有正向协同作用, 提高其活性, 共同直接参与海水稻抗逆生理反应, 以增加海水稻的抗逆性。
4 结论盐胁迫对海水稻的盐害程度较小, 随土壤含盐量增加, 海水稻MDA积累量较少, 对其细胞膜脂过氧化伤害较小,细胞膜的完整性较好, 表现出强耐盐性。海水稻为抵抗盐胁迫在体内大量积累可溶性糖, 其中一部分用于自身生长所需和为脯氨酸合成提供碳骨架原料和能量来源, 另外一部分与脯氨酸一起共同作为渗透调节物, 参与缓解渗透胁迫, 降低渗透压, 使海水稻细胞膜受盐害程度减少, 提高海水稻耐盐能力。土壤含盐量3 g·kg-1是海水稻正常生长的耐盐阈值, 该盐胁迫下海水稻抗逆相关酶P5CS、δ-OAT和SOD正向协同作用, 活性达到最大值, 共同调节脯氨酸的合成与积累, 土壤含盐量4~5 g·kg-1水平, 海水稻叶片积累过多Na+导致海水稻体内MDA大量积累, 细胞膜透性增大, 而P5CS直接参与脯氨酸合成。因此海水稻作为特有遗传材料将为水稻耐盐碱性的提高和耐盐水稻种质资源创新提供宝贵理论依据和耐盐碱基因资源。
| [1] |
LIANG W J, MA X L, WAN P, et al. Plant salt-tolerance mechanism:A review[J]. Biochemical and Biophysical Research Communications, 2017, 495(1): 286-291. |
| [2] |
TESTER M, DAVENPORT R. Na+ tolerance and Na+ transport in higher plants[J]. Annals of Botany, 2003, 91(5): 503-527. DOI:10.1093/aob/mcg058 |
| [3] |
许芳芳, 袁立敏, 邵玉芳, 等. 肠杆菌FYP1101对盐胁迫下小麦幼苗的促生效应[J]. 微生物学通报, 2018, 45(1): 102-110. XU F F, YUAN L M, SHAO Y F, et al. Effect of Enterobacter sp. FYP1101 on wheat seedling growth under salt stress[J]. Microbiology China, 2018, 45(1): 102-110. |
| [4] |
WANG R J. Salt-tolerance evaluation of Brassica napus germplasm in the bud and seeding and establishment of the two-dimensional electrophoresis system[J]. Nanjing:Nanjing Agricultural University, 2010. |
| [5] |
靳继凯.转多基因水稻耐盐株系鉴定与评价[D].银川: 宁夏大学, 2014 JIN J K. Identification and analysis of salt tolerance of multiple transgenic hybrid paddy rice[D]. Yinchuan: Ningxia University, 2014 http://cdmd.cnki.com.cn/article/cdmd-10749-1014224949.htm |
| [6] |
陈雨生, 王平, 王克响, 等. 我国海水稻产业发展的战略选择[J]. 中国海洋大学学报:社会科学版, 2018(1): 50-54. CHEN Y S, WANG P, WANG K X, et al. The strategic choice of sea rice industry development in China[J]. Journal of Ocean University of China:Social Sciences, 2018(1): 50-54. |
| [7] |
杨福, 梁正伟, 王志春. 水稻耐盐碱鉴定标准评价及建议与展望[J]. 植物遗传资源学报, 2011, 12(4): 625-628. YANG F, LIANG Z W, WANG Z C. Evaluation, suggestion and prospect on identification standards of saline-alkali tolerance in rice[J]. Journal of Plant Genetic Resources, 2011, 12(4): 625-628. |
| [8] |
EI-SHABRAWI H, KUMAR B, KAUL T, et al. Redox homeostasis, antioxidant defense, and methylglyoxal detoxification as markers for salt tolerance in pokkali rice[J]. Protoplasma, 2010, 245(1/4): 85-96. |
| [9] |
KABIR A H, ZAMAN R, BEGUM M C, et al. Upregulation of, OsNAS1, OsPCS1, and DREB1A transcripts along with anti- oxidative defense confers salt tolerance in rice (Oryza sativa L. cv Pokkali)[J]. Archives of Agronomy and Soil Science, 2016, 62(10): 1381-1395. DOI:10.1080/03650340.2016.1149817 |
| [10] |
SHOBBAR M S, AZHARI O, SHOBBAR Z S, et al. Comparative analysis of some physiological responses of rice seedlings to cold, salt, and drought stress[J]. Journal of Plant Nutrition, 2012, 35(7): 1037-1052. DOI:10.1080/01904167.2012.671407 |
| [11] |
ZHAO X Q, WANG W S, ZHANG F, et al. Comparative metabolite profiling of two rice genotypes with contrasting salt stress tolerance at the seedling stage[J]. PLoS One, 2014, 9(9): e108020. DOI:10.1371/journal.pone.0108020 |
| [12] |
PRUSTY M R, KIM S R, VINARAO R, et al. Newly identified wild rice accessions conferring high salt tolerance might use a tissue tolerance mechanism in leaf[J]. Frontiers in Plant Science, 2018, 9: 417. DOI:10.3389/fpls.2018.00417 |
| [13] |
DOMINGO C, LALANNE E, CATALÁ M M, et al. Physiological basis and transcriptional profiling of three salt-tolerant mutant lines of rice[J]. Frontiers in Plant Science, 2016, 7: 1462. |
| [14] |
CHEN R S, CHENG Y F, HAN SY, et al. Whole genome sequencing and comparative transcriptome analysis of a novel seawater adapted, salt-resistant rice cultivar-sea rice 86[J]. BMC Genomics, 2017, 18(1): 655. DOI:10.1186/s12864-017-4037-3 |
| [15] |
祝一文, 赵方贵, 成云峰, 等. '海稻86'耐盐碱胁迫生理机制的初步研究[J]. 青岛农业大学学报:自然科学版, 2018, 35(1): 32-39. ZHU Y W, ZHAO F G, CHENG Y F, et al. The preliminary study on alkali-salt tolerance of 'Sea Rice 86' and physiological mechanisms[J]. Journal of Qingdao Agricultural University:Natural Science, 2018, 35(1): 32-39. |
| [16] |
王素平, 郭世荣, 胡晓辉, 等. 盐胁迫对黄瓜幼苗叶片光合色素含量的影响[J]. 江西农业大学学报, 2006, 28(1): 32-38. WANG S P, GUO S R, HU X H, et al. Effects of NaCl stress on the content of photosynthetic pigments in the leaves of cucumber (Cucumis sativus L.) seedlings[J]. Acta Agriculturae Universitatis Jiangxiensis, 2006, 28(1): 32-38. DOI:10.3969/j.issn.1000-2286.2006.01.007 |
| [17] |
施海涛. 植物逆境生理学实验指导[M]. 北京: 科学出版社, 2016. SHI H T. Experimental Instruction of Plant Stress Physiology[M]. Beijing: Science Press, 2016. |
| [18] |
黄顶, 王堃. 典型草原常见牧草春季萌动期可溶性糖及内源激素动态研究[J]. 应用生态学报, 2006, 17(2): 210-214. HUANG D, WANG K. Dynamics of soluble sugar and endogenous hormone contents in several steppe grass species during their germination period in spring[J]. Chinese Journal of Applied Ecology, 2006, 17(2): 210-214. DOI:10.3321/j.issn:1001-9332.2006.02.010 |
| [19] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 167-169, 258-261. LI H S. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 167-169, 258-261. |
| [20] |
YANG C Y, LING H E. Neuroprotective effects of sinapine on PC12 cells apoptosis induced by sodium dithionite[J]. Chinese Journal of Natural Medicines, 2008, 6(3): 205-209. |
| [21] |
HAYZER D J, LEISINGER T. The gene-enzyme relationships of proline biosynthesis in Escherichia coli[J]. Journal of General Microbiology, 1980, 118(2): 287-293. |
| [22] |
韩晓玲.小冠花抗L-羟基脯氨酸(Hyp)变异系离体筛选及其耐盐性研究[D].西安: 西北大学, 2006 HAN X L. In vitro selection of L-hydroxyproline resistant variants of Coronilla varia L. and studies on their salt tolerance[D]. Xi'an: Northwest University, 2006 http://cdmd.cnki.com.cn/article/cdmd-10697-2006090170.htm |
| [23] |
HU C A, DELAUNEY A J, VERMA D P. A bifunctional enzyme (delta 1-pyrroline-5-carboxylate synthetase) catalyzes the first two steps in proline biosynthesis in plants[J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(19): 9354-9358. DOI:10.1073/pnas.89.19.9354 |
| [24] |
KIM H R, RHO H W, PARK J W, et al. Assay of ornithine aminotransferase with ninhydrin[J]. Analytical Biochemistry, 1994, 223(2): 205-207. |
| [25] |
叶红卫, 朱蓝辉. 应用SPSS进行双因子方差分析[J]. 河北北方学院学报:自然科学版, 2008, 24(2): 63-65. YE H W, ZHU L H. Using SPSS to make double factor variance analysis[J]. Journal of Hebei North University:Natural Science Edition, 2008, 24(2): 63-65. |
| [26] |
宋小园, 朱仲元, 刘艳伟, 等. 通径分析在SPSS逐步线性回归中的实现[J]. 干旱区研究, 2016, 33(1): 108-113. SONG X Y, ZHU Z Y, LIU Y W, et al. Application of path analysis in stepwise linear regression SPSS[J]. Arid Zone Research, 2016, 33(1): 108-113. |
| [27] |
王旭明, 赵夏夏, 陈景阳, 等. 低盐胁迫对5个海水稻种质若干生理生化指标的影响[J]. 热带农业科学, 2018, 38(8): 24-29. WANG X M, ZHAO X X, CHEN J Y, et al. Effect of low salt stress on several physiological and biochemical indicators of five accessions of sea rice[J]. Chinese Journal of Tropical Agriculture, 2018, 38(8): 24-29. |
| [28] |
赵勇, 马雅琴, 翁跃进. 盐胁迫下小麦甜菜碱和脯氨酸含量变化[J]. 植物生理与分子生物学学报, 2005, 31(1): 103-106. ZHAO Y, MA Y Q, WENG Y J. Variation of betaine and proline contents in wheat seedlings under salt stress[J]. Journal of Plant Physiology and Molecular Biology, 2005, 31(1): 103-106. |
| [29] |
徐宇, 肖化云, 郑能建, 等. 植物组织中游离氨基酸在盐胁迫下响应的研究进展[J]. 环境科学与技术, 2016, 39(7): 40-47. XU Y, XIAO H Y, ZHENG N J, et al. Progress on responding of free amino acid in plants to salt stress[J]. Environmental Science and Technology, 2016, 39(7): 40-47. |
| [30] |
ZHOU H, QIAN J, ZHAO M D, et al. Cloning and sequence analysis of the Δ1-pyrroline-5-carboxylate synthase gene (MP5CS) from mulberry (Morus alba) and patterns of MP5CS gene expression under abiotic stress conditions[J]. Journal of Horticultural Science and Biotechnology, 2016, 91(1): 100-108. DOI:10.1080/14620316.2015.1110999 |
| [31] |
YOU J, HU H H, XIONG L Z. An ornithine δ-aminotransferase gene OsOAT confers drought and oxidative stress tolerance in rice[J]. Plant Science, 2012, 197: 59-69. DOI:10.1016/j.plantsci.2012.09.002 |
| [32] |
MIRZAEE M, MOIENI A, GHANATI F. Effects of drought stress on the lipid peroxidation and antioxidant enzyme activities in two canola (Brassica napus L.) cultivars[J]. Journal of Agricultural Science and Technology, 2013, 15(3): 593-602. |
| [33] |
LOS D A, MURATA N. Membrane fluidity and its roles in the perception of environmental signals[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2004, 1666(1/2): 142-157. |
| [34] |
王鑫月.盐胁迫和铝胁迫对水稻膜脂组分和含量的影响[D].西安: 中国科学院研究生院(教育部水土保持与生态环境研究中心), 2016 WANG X Y. Effect of salt stress and aluminum stress on the composition and content of membrane lipids in rice[D]. Xi'an: Graduate School of Chinese Academy of Sciences (Research Center for Soil and Water Conservation and Ecological Environment, Ministry of Education), 2016 http://cdmd.cnki.com.cn/Article/CDMD-80129-1016758117.htm |
| [35] |
冯坤, 郑青松, 俞佳虹, 等. 超氧化物歧化酶的遗传特征及其在植物抗逆性中的研究进展[J]. 分子植物育种, 2017, 15(11): 4498-4505. FENG K, ZHENG Q S, YU J H, et al. The characteristics of superoxide dismutase (SOD) in evolutions and its research in plant resistance[J]. Molecular Plant Breeding, 2017, 15(11): 4498-4505. |
| [36] |
KRISHNAMURTHY P, RANATHUNGE K, FRANKE R, et al. The role of root apoplastic transport barriersin salt tolerance of rice (Oryza sativa L.)[J]. Planta, 2009, 230(1): 119-134. |
| [37] |
高继平.水稻耐盐数量性状基因SKC1的作用机理及OsHKT基因的表达模式分析[D].上海: 中国科学院研究生院(上海生命科学研究院), 2007 GAO J P. Mechanism of SKC1, a rice quantitative trait locus for salt tolerance, and analysis of expression pattern of OsHKT genes[D]. Shanghai: Graduate School of Chinese Academy of Sciences (Shanghai Institute of Nutrition and Health, Chinese Academy of Sciences), 2007 http://cdmd.cnki.com.cn/Article/CDMD-80100-2007110151.htm |
| [38] |
罗秋香, 管清杰, 金淑梅, 等. 植物耐盐性分子生物学研究进展[J]. 分子植物育种, 2006, 4(S2): 57-64. LUO Q X, GUAN Q J, JIN S M, et al. Advances on application of molecular biology on plant salt tolerance research[J]. Molecular Plant Breeding, 2006, 4(S2): 57-64. |
| [39] |
王旭明, 赵夏夏, 黄露莎, 等. 盐胁迫下4个不同耐盐基因型水稻Na+、K+积累效应[J]. 热带作物学报, 2018, 39(11): 2140-2146. WANG X M, ZHAO X X, HUANG L S, et al. The Na+ and K+ accumulative effect of four different salt tolerance genotypes in rice under salt stress[J]. Chinese Journal of Tropical Crops, 2018, 39(11): 2140-2146. DOI:10.3969/j.issn.1000-2561.2018.11.005 |
| [40] |
卢霖, 董志强, 董学瑞, 等. 乙矮合剂对不同密度夏玉米花粒期不同部位叶片衰老特性的影响[J]. 作物学报, 2016, 42(4): 561-573. LU L, DONG Z Q, DONG X R, et al. Effects of ethylene-chlormequat-potassium on characteristics of leaf senescence at different plant positions after anthesis under different planting densities[J]. Acta Agronomica Sinica, 2016, 42(4): 561-573. |
| [41] |
RAO G G, RAO G R. Pigment composition and chlorophyllase activity in pigeon pea (Cajanus indicus Spreng) and Gingelley (Sesamum indicum L.) under NaCl salinity[J]. Indian Journal of Experimental Biology, 1981, 19(8): 768-770. |
| [42] |
GUO Y Y, YU H Y, YANG M M, et al. Effect of drought stress on lipid peroxidation, osmotic adjustment and antioxidant enzyme activity of leaves and roots of Lycium ruthenicum Murr. seedling[J]. Russian Journal of Plant Physiology, 2018, 65(2): 244-250. DOI:10.1134/S1021443718020127 |
| [43] |
YILDIZTUGAY E, OZFIDAN-KONAKCI C, KUCUKODUK M, et al. Variations in osmotic adjustment and water relations of Sphaerophysa kotschyana:Glycine betaine, proline and choline accumulation in response to salinity[J]. Botanical Studies, 2014, 55: 6. DOI:10.1186/1999-3110-55-6 |
| [44] |
GHOULAM C, FOURSY A, FARES K. Effects of salt stress on growth, inorganic ions and proline accumulation in relation to osmotic adjustment in five sugar beet cultivars[J]. Environmental and Experimental Botany, 2002, 47(1): 39-50. DOI:10.1016/S0098-8472(01)00109-5 |
| [45] |
LI Q, YANG A, ZHANG W H. Comparative studies on tolerance of rice genotypes differing in their tolerance to moderate salt stress[J]. BMC Plant Biology, 2017, 17(1): 141. DOI:10.1186/s12870-017-1089-0 |
| [46] |
BAGDI D L, SHAW B P, SAHU B B, et al. Real time PCR expression analysis of gene encoding p5cs enzyme and proline metabolism under NaCl salinity in rice[J]. Journal of Environmental Biology, 2015, 36(4): 955-961. |
| [47] |
BASU S, GANGOPADHYAY G, MUKHERJEE B B. Salt tolerance in rice in vitro:Implication of accumulation of Na+, K+ and proline[J]. Plant Cell, Tissue and Organ Culture, 2002, 69(1): 55-64. |
| [48] |
ZHANG H, LIU X L, ZHANG R X, et al. Root damage under alkaline stress is associated with reactive oxygen species accumulation in rice (Oryza sativa L.)[J]. Frontiers in Plant Science, 2017, 8: 1580. DOI:10.3389/fpls.2017.01580 |
| [49] |
赵曼利, 杜启兰, 焦健, 等. 盐胁迫对不同品种油橄榄抗盐性生理指标的影响[J]. 福建农林大学学报:自然科学版, 2016, 45(1): 19-25. ZHAO M L, DU Q L, JIAO J, et al. Physiological response and salt resistance evaluation of six varieties of Olea europaea under salt stress[J]. Journal of Fujian Agriculture and Forestry University:Natural Science Edition, 2016, 45(1): 19-25. |
| [50] |
李倩, 刘景辉, 武俊英, 等. 盐胁迫对燕麦质膜透性及Na+、K+吸收的影响[J]. 华北农学报, 2009, 24(6): 88-92. LI Q, LIU J H, WU J Y, et al. Effect of salt stress on membrane permeability and Na+、K+ absorption of oat[J]. Acta Agriculturae Boreali-Sinica, 2009, 24(6): 88-92. |
| [51] |
PARIDA A K, JHA B. Salt tolerance mechanisms in mangroves:A review[J]. Trees, 2010, 24(2): 199-217. DOI:10.1007/s00468-010-0417-x |
| [52] |
MITTLER R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410. DOI:10.1016/S1360-1385(02)02312-9 |
 2019, Vol. 27
2019, Vol. 27



