气孔是高等植物与外界进行CO2和水汽传输的主要通道和调节器官, 调节着植物的碳同化和水分散失的平衡关系。Hetherington等[1]指出, 气孔孔隙面积虽只占叶片表面积的5%左右, 但从气孔蒸发的水分高达70%。影响气孔活动的环境因素包括光照、CO2浓度、空气湿度以及土壤水分状况等[2]。在非生物胁迫中, 干旱胁迫对植物的危害较大, 气孔调节是植物抵御干旱胁迫和适应环境的机制之一[3]。植物通过控制气孔的开闭程度和数目调节叶片的蒸腾速率。不同种类植物气孔在应对不同程度干旱时表现不同。中度土壤干旱条件下, 玉米叶片气孔密度增大, 气孔长度和宽度都变小, 且宽度的变幅大于气孔长度的变幅[4]。燕麦(Avena sativa L.)在轻度干旱下(土壤相对含水量60%)气孔开启程度比正常水分条件大, 证明燕麦具有典型耐旱作物结构特征[5]。除了引起气孔形态和运动变化外, 干旱会导致气孔导度下降, 进入叶片内部的CO2浓度降低, 进而带来光合速率降低[6-7]。叶绿素荧光参数已被广泛用于胁迫生理中, 但干旱下植物叶片荧光参数的表现不同。干旱降低了棉花叶片PS Ⅱ最大光化学效率(Fv/Fm)、光化学量子效率(ϕPSⅡ), 非光化学猝灭系数(NPQ)升高[8], 但也有试验证明干旱不会降低ETR和ϕPSⅡ[9-10]。
棉花(Gossypium hirsutum L.)是中国乃至全世界最为重要的经济作物, 其产区多为干旱或半干旱地区, 水分供应不足是棉花生产的主要障碍因素之一。关于土壤干旱下棉花光合生理特性的研究已有较多报道[11-12], 但关于模拟短期干旱下棉花气孔形态和运动表现及其光合特征研究并不多见。本研究采用PEG-6000模拟短期干旱, 研究不同胁迫天数、干旱程度下棉花叶片气孔形态和密度、光合参数和叶绿素荧光参数等指标变化, 以进一步明确棉花气孔对干旱的响应特征, 了解气孔调节的真实行为, 为提高水分利用效率奠定基础。
1 材料和方法 1.1 试验设计试验为室内培养试验, 在河北农业大学西校区农学院智能温室(保定)内进行。温室温光条件为, 白天25 ℃(照光), 夜间20 ℃(不照光)。供试棉花品种为转基因抗虫棉‘国欣9号’。种子用75%的酒精消毒灭菌后用蒸馏水浸种, 25 ℃催芽至露白, 选取露白一致的种子先种在蛭石中, 待棉花幼苗长至2叶一心时(播种后21 d), 挑选生长一致健壮的幼苗移至1/4 Hoagland营养液中, 3 d更换一次营养液, 长至3叶一心(播种后31 d)时使用1/2 Hoagland营养液进行培养, 4叶一心时(播种后35 d)使用全Hoagland营养液进行培养, 待5叶一心时(播种后51 d)开始模拟干旱胁迫处理。根据预试验结果, 在营养液中加入PEG-6000的浓度分别为: 0(对照)、1.5%、3.0%和4.5%。每处理60株。
1.2 测定项目及方法 1.2.1 叶片水势测定采用Model 600型植物压力室(美国PMS公司), 选取倒3叶进行测定, 每次重复5株。
1.2.2 气孔大小和密度利用BX53数码显微摄像系统(日本Olympus公司), 待光合参数和荧光参数测定完成后1 h进行。采用指甲油涂抹和透明胶带相结合的方法, 测定叶位为倒4叶。先将指甲油均匀涂抹在叶片背面的取材部位, 使其在室温自然晾干5~10 min(视光照、风等因素确定), 将透明塑料胶带拉开3~4 cm, 胶面朝下, 粘取指甲油层, 用手指抹平胶带, 使胶带与指甲油层之间充分接触, 没有气泡; 撕取粘有指甲油层的胶带, 将其粘贴在载玻片上, 不另加盖玻片, 每个叶片随机选取5个视野, 在40倍目镜下观察测定气孔密度和气孔形态特征。1)气孔长度和宽度(μm):每个视野随机选取5个气孔, 测定哑铃形保卫细胞长度即为气孔长度, 垂直于哑铃形保卫细胞的最宽值即为气孔宽度。2)气孔开度(μm):每个视野随机选取5个气孔, 测定气孔孔径的宽度用来表示气孔的开张度。3)气孔密度:测量出视野面积, 计算每幅图片上的气孔个数, 取平均值, 除以图片面积, 得到每个视野的平均气孔密度(个∙μm-2)。
1.2.3 叶片气体交换参数采用LI-6400光合仪(美国LI-COR公司), 设置内置红蓝光源光强为600 μmol∙m-2∙s-1, CO2浓度为400 μmol∙mol-1, 选取倒4叶中部进行测定, 获取净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci)。每次测定重复5株。本研究所有测定项目均分别在处理后的1 d、3 d、5 d和7 d进行。
1.2.4 叶绿素荧光动力学参数采用PAM-2500 (德国Walz公司)叶绿素荧光仪, 先测定光下叶片实际光化学量子产量Yield, 接着暗适应20 min, 获取最大光化学效率Fv/Fm, 计算非光化学淬灭系数NPQ。测定叶片为光合测定叶, 每次重复5株。
1.3 数据处理数据处理在Microsoft Excel 2010中进行, 采用SPSS 20.0软件进行差异显著性统计分析, 多重比较采用LSD法, 气孔形态指标和光合参数图采用Origin Pro 9软件绘制。
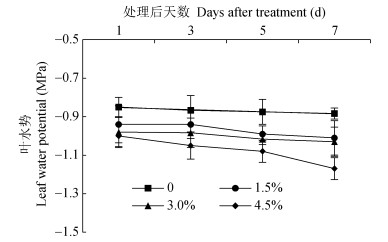
2 结果与分析 2.1 不同PEG-6000处理对棉花叶片水势的影响叶水势是反映植物体内水分状况的灵敏的生理指标之一。随PEG-6000处理浓度的增加, 叶水势显著下降, 说明干旱胁迫越重, 叶片水势越低。如图 1所示, 随PEG-6000处理时间延长, 各处理叶片水势逐渐下降。1.5%浓度在PEG-6000处理后1 d和3 d与对照差异不显著, 5 d差异显著。3.0%和4.5%浓度在处理后1 d即与对照差异显著, 其中4.5%浓度在处理后1 d、3 d、5 d和7 d分别下降17.65%、21.15%、23.43%和32.45%。表明1.5%处理的第5 d是棉花叶片水势的临界条件。干旱导致叶片水势降低, 以便更容易地从溶液中吸收水分。
|
图 1 不同PEG-6000浓度处理下棉花叶片水势变化 Fig. 1 Change of leaf water potential under four PEG-6000 concentrations in cotton |
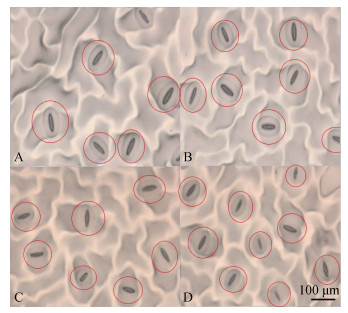
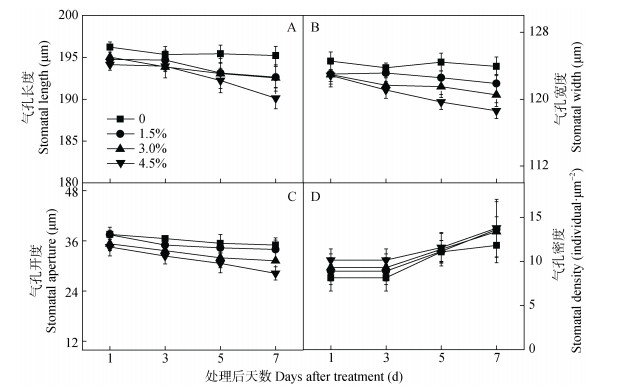
经不同浓度PEG-6000处理后, 棉花叶片气孔形态发生明显变化(图 2)。由图 2可知, 随着处理时间的延长, 除对照外, 其余PEG处理的棉花气孔长度、宽度和开度均呈下降趋势, 气孔密度呈上升趋势。处理后1 d, 3.0% PEG处理的气孔长度和宽度与对照差异显著(P < 0.05)。不同处理间各气孔指标在处理后3 d开始差别逐渐加大。处理后第7 d, 4.5% PEG处理的气孔长度、宽度和开度比对照分别降低2.61%、4.28%和19.29%, 而气孔密度上升16.55% (图 3)。表明在干旱初期叶片通过微闭气孔减少蒸腾, 严重干旱时气孔开度的降幅高于气孔长度和宽度。
|
图 2 不同PEG-6000浓度处理1 d后棉花叶片气孔形态变化(A、B、C和D分别对应PEG-6000处理浓度为0、1.5%、3.0%和4.5%) Fig. 2 Leaf stomatal morphology of cotton under four PEG-6000 concentrations for 1 day (A: 0; B: 1.5%; C: 3.0% and D: 4.5%) |
|
图 3 不同PEG-6000浓度处理下棉花气孔形态指标的变化(A-D分别为气孔长度、宽度、开度和密度) Fig. 3 Leaf stomatal length (A), width (B), aperture (C) and density (D) of cotton under four PEG-6000 concentrations |
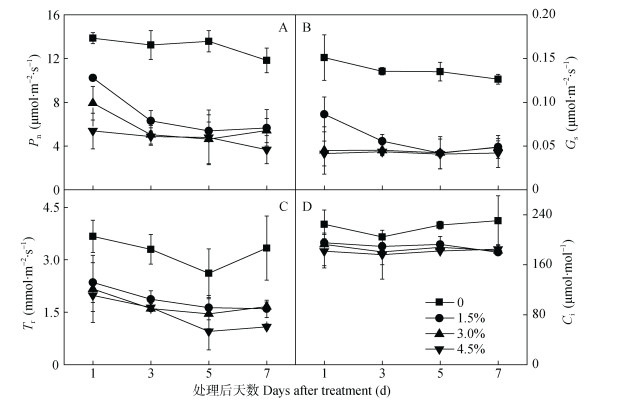
随PEG-6000处理浓度的增加和处理时间的延长, 净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)都呈明显下降的趋势(图 4)。与处理后1 d相比, 1.5%处理的Pn在第3 d、5 d、7 d分别下降38.37%、47.32%和44.67%, 相应地4.5%处理分别下降9.58%、11.02%和31.95%, 且与对照之间均差异显著(图 4A)。Gs也有相似变化趋势, 从第1 d开始加入PEG-6000的各处理与正常处理差异显著, 但自处理后3 d开始, PEG-6000 1.5%、3.0%和4.5% 3个处理间差异不显著(图 4B)。干旱同样降低了叶片的蒸腾速率, 在每个测定日, 加入PEG-6000各处理与正常处理差异均达显著水平(P < 0.05)。处理后第1 d、3 d、5 d和7 d, 4.5%处理相对于正常处理分别下降46.02%、50.49%、63.52%和67.48%(图 4C)。与对照相比, 加入PEG- 6000处理也不同程度地降低了Ci, 处理后各测定日Ci均与对照差异显著, 各干旱处理间的差异小于干旱与对照之间的差异(图 4D)。
|
图 4 不同PEG-6000浓度处理下棉花叶片净光合速率(Pn, A)、气孔导度(Gs, B)、蒸腾速率(Tr, C)和胞间CO2浓度(Ci, D)的变化 Fig. 4 Leaf net photosynthetic rate (Pn, A), stomatal conductance (Gs, B), transpiration rate (Tr, C) and intercellular CO2 concentration (Ci, D) of cotton leaf under four PEG-6000 concentrations |
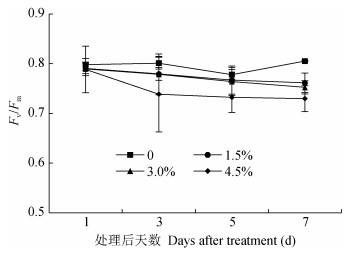
随干旱胁迫程度和处理天数的增加, Fv/Fm整体呈下降趋势(图 5)。在处理后1 d, 各处理间差异不显著; 处理后3 d和5 d, 4.5%处理显著低于对照, 而1.5%和3.0%处理与对照差异不显著; 处理后7 d, 各处理显著低于对照, 1.5%、3.0%和4.5%处理分别比对照低5.42%、5.55%和9.39%。表明短期轻度干旱胁迫不会对棉花叶片PSⅡ最大光化学效率造成显著影响, 但长期重度干旱胁迫会造成PSⅡ最大光化学效率严重下降。
|
图 5 不同PEG-6000浓度处理下棉花叶片最大光化学效率(Fv/Fm) Fig. 5 Leaf maximal photochemical efficiency of PSⅡ in the dark (Fv/Fm) under four PEG-6000 concentrations in cotton |
由图 6A可知, 经干旱胁迫处理后棉花实际光化学量子产量Yield值总体呈下降趋势, 表明干旱使棉花叶片的光合电子传递过程受到了抑制。1.5%处理直到处理后第7 d Yield值才显著低于对照, 3.0%和4.5%处理在处理后第1 d便显著低于对照, 其中4.5%处理在处理后的第1 d、3 d、5 d和7 d分别比正常处理下降20.64%、24.81%、35.07%和19.60%。非光化学淬灭(NPQ)常用来评价植物耗散过剩激发能的能力[13]。由图 6B可以看出, 随着干旱胁迫的加重, NPQ呈上升趋势。处理后1 d, 3个干旱处理的NPQ值均显著高于对照(P < 0.05);处理后3 d, 各干旱处理NPQ值均高于对照, 但处理间差异未达显著水平; 处理后5 d和7 d, 4.5%处理显著高于对照, 比对照分别提高22.72%和31.82%。表明干旱导致棉花叶片中PS Ⅱ反应中心耗散过剩光能的能力增强, 吸收的光能较多用于热耗散。

|
图 6 不同PEG-6000浓度处理下棉花实际光化学量子产量(Yield, A)和非光化学淬灭(NPQ, B) Fig. 6 Photochemical quantum yield (Yield, A) and non-photochemical quenching coefficient (NPQ, B) of cotton under four PEG-6000 concentrations |
由表 1可见, 棉花气孔长度、宽度和开度之间极显著正相关(P < 0.01), 气孔宽度和气孔密度不相关。气孔长度、宽度和开度与Pn和Yield极显著正相关(P < 0.01), 与NPQ极显著负相关(P < 0.01), 与Gs、Tr和Fv/Fm相关不显著。
| 表 1 棉花气孔形态指标与光合、荧光参数的关系 Table 1 Correlation coefficients among leaf stomata morphological parameters, gas exchange and chlorophyll fluorescence parameters under four PEG-6000 concentrations in cotton (n=80) |
气孔是植物体内水分和CO2与外界环境进行交换的通道, 气孔的大小、多少和调节功能与叶片的光合作用和蒸腾作用等生理过程有密切的联系[14]。在干旱胁迫下, 植物可通过气孔调节来适应。一般而言, 植物叶片气孔长度、宽度、气孔开张度会随着土壤干旱胁迫程度的加重而逐渐降低[7, 15-16]。气孔密度变化因作物种类和胁迫程度不同而异。在轻度至中度胁迫或者胁迫发生的初期, 叶片气孔密度会上升, 即适度的干旱可增加叶片气孔密度[17], 而过度干旱或长期干旱则使叶片气孔密度下降[18]。其原因可能是轻度和中度干旱胁迫使细胞伸长受抑制, 导致叶面积减少, 即单位面积的气孔数目增加, 气孔密度上升。严重干旱胁迫时, 叶片受影响严重, 抑制了气孔发生, 气孔数目显著减少, 最终表现为气孔密度下降[19]。本研究采用PEG渗透胁迫模拟干旱, 结果表明随着胁迫程度的加深, 棉花叶片气孔长度、宽度、开度下降, 气孔密度上升, 未发现气孔密度下降, 可能是胁迫程度不够。此外, 有报道称可通过基因调控降低气孔密度来提高植物的抗旱性[20]。气孔关闭的原因受到ABA和/或水力学信号调控[21]。
干旱胁迫对作物光合能力的限制是由气孔关闭引起还是由碳代谢受损所导致, 因植物种类、胁迫程度不同而不同。Ennahli等[22]认为适度水分亏缺下棉花叶片净光合速率的变化主要是由于叶片气孔关闭, 胞间CO2浓度降低造成的。Ahmed等[23]认为干旱胁迫早期绿豆叶片的Pn迅速下降, 但气孔导度并没有发生任何变化, 随着干旱胁迫时间的不断延长气孔导度才明显降低, 说明干旱胁迫初期非气孔限制因素是导致Pn降低的主要因素, 而后期Pn的降低则主要是由于气孔关闭导致CO2亏缺造成的。罗宏海等[12]认为花铃期土壤干旱导致棉花叶片光合速率降低, 轻度干旱叶片荧光参数变化不显著, 中度干旱下qP和ϕPSⅡ显著下降, NPQ显著升高。本研究表明, PEG-6000模拟干旱导致棉花叶片气孔闭合、Ci降低, Pn降低主要受气孔限制。在应对干旱的响应上, 叶绿素荧光参数Fv/Fm在1.5%和3%浓度处理1 d、3 d和5 d均与对照无显著差异, 表明该参数对干旱的敏感性比Yield和NPQ差。这与罗宏海等[12]的结论一致。
本试验条件下, 处理后1 d, 各浓度处理的叶片水势、光合性能明显下降, 说明PEG-6000模拟棉花干旱效果显著。下一步可以适当降低PEG-6000浓度, 或者在处理后数小时内, 连续观测叶片气孔和光合指标变化, 以明确叶片对短时间内干旱胁迫的响应。还可以增加恢复试验, 经胁迫处理一定时间后利用正常营养液继续培养, 研究叶片在干旱解除后的恢复能力。
本研究通过对PEG-6000诱导的棉花叶片气孔形态、光合和荧光指标分析, 发现干旱引起净光合速率等指标的下降, 主要是由气孔的闭合引起。荧光参数Yield和NPQ比Fv/Fm对干旱反应更敏感。
| [1] |
HETHERINGTON A M, WOODWARD F I. The role of stomata in sensing and driving environmental change[J]. Nature, 2003, 424(6951): 901-908. DOI:10.1038/nature01843 |
| [2] |
李芳兰, 包维楷. 植物叶片形态解剖结构对环境变化的响应与适应[J]. 植物学报, 2005, 22(S1): 118-127. LI F L, BAO W K. Responses of the morphological and anatomical structure of the plant leaf to environmental change[J]. Chinese Bulletin of Botany, 2005, 22(S1): 118-127. |
| [3] |
CASSON S A, HETHERINGTON A M. Environmental regulation of stomatal development[J]. Current Opinion in Plant Biology, 2010, 13(1): 90-95. DOI:10.1016/j.pbi.2009.08.005 |
| [4] |
于海秋, 王晓磊, 蒋春姬, 等. 土壤干旱下玉米幼苗解剖结构的伤害进程[J]. 干旱地区农业研究, 2008, 26(5): 143-147. YU H Q, WANG X L, JIANG C J, et al. Injured process on anatomical structure of maize seedling under soil drought[J]. Agricultural Research in the Arid Areas, 2008, 26(5): 143-147. |
| [5] |
张志芬, 刘景辉, 付晓峰, 等. 干旱胁迫对燕麦叶片气孔和叶肉细胞超微结构的影响[J]. 麦类作物学报, 2017, 37(9): 1216-1223. ZHANG Z F, LIU J H, FU X F, et al. Effect of drought stress on stomata and ultrastructure of mesophyll cells of oat leaf[J]. Journal of Triticeae Crops, 2017, 37(9): 1216-1223. |
| [6] |
ZHANG Y L, HU Y Y, LUO H H, et al. Two distinct strategies of cotton and soybean differing in leaf movement to perform photosynthesis under drought in the field[J]. Functional Plant Biology, 2011, 38(7): 567-575. DOI:10.1071/FP11065 |
| [7] |
王春艳, 庞艳梅, 李茂松, 等. 干旱胁迫对大豆气孔特征和光合参数的影响[J]. 中国农业科技导报, 2013, 15(1): 109-115. WANG C Y, PANG Y M, LI M S, et al. Effects of drought stress on soybean stomatal characteristics and photosynthetic parameter[J]. Journal of Agricultural Science and Technology, 2013, 15(1): 109-115. |
| [8] |
李平, 张永江, 刘连涛, 等. 水分胁迫对棉花幼苗水分利用和光合特性的影响[J]. 棉花学报, 2014, 26(2): 113-121. LI P, ZHANG Y J, LIU L T, et al. Effects of water stress on water utilization and leaf photosynthetic characteristics in cotton (Gossypium hirsutum L.) seedlings[J]. Cotton Science, 2014, 26(2): 113-121. DOI:10.3969/j.issn.1002-7807.2014.02.003 |
| [9] |
MASSACCI A, NABIEV S M, PIETROSANTI L, et al. Response of the photosynthetic apparatus of cotton (Gossypium hirsutum) to the onset of drought stress under field conditions studied by gas-exchange analysis and chlorophyll fluorescence imaging[J]. Plant Physiology and Biochemistry, 2008, 46(2): 189-195. DOI:10.1016/j.plaphy.2007.10.006 |
| [10] |
SNIDER J L, OOSTERHUIS D M, COLLINS G D, et al. Field-acclimated Gossypium hirsutum cultivars exhibit genotypic and seasonal differences in photosystem Ⅱ thermostability[J]. Journal of Plant Physiology, 2013, 170(5): 489-496. DOI:10.1016/j.jplph.2012.11.004 |
| [11] |
李东晓, 李存东, 孙传范, 等. 干旱对棉花主茎叶片内源激素含量与平衡的影响[J]. 棉花学报, 2010, 22(3): 231-235. LI D X, LI C D, SUN C F, et al. The effects of drought on endogenous hormone contents and balance in main stem leaves of cotton[J]. Cotton Science, 2010, 22(3): 231-235. DOI:10.3969/j.issn.1002-7807.2010.03.007 |
| [12] |
罗宏海, 张亚黎, 张旺锋, 等. 新疆滴灌棉花花铃期干旱复水对叶片光合特性及产量的影响[J]. 作物学报, 2008, 34(1): 171-174. LUO H H, ZHANG Y L, ZHANG W F, et al. Effects of rewatering after drought stress on photosynthesis and yield during flowering and boll-setting stage of cotton under-mulch-drip irrigation in Xinjiang[J]. Acta Agronomica Sinica, 2008, 34(1): 171-174. DOI:10.3321/j.issn:0496-3490.2008.01.026 |
| [13] |
MAXWELL K, JOHNSON G N. Chlorophyll fluorescence-A practical guide[J]. Journal of Experimental Botany, 2000, 51(345): 659-668. DOI:10.1093/jexbot/51.345.659 |
| [14] |
CASSON S, GRAY J E. Influence of environmental factors on stomatal development[J]. New Phytologist, 2008, 178(1): 9-23. DOI:10.1111/j.1469-8137.2007.02351.x |
| [15] |
杨再强, 谭文, 刘朝霞, 等. 土壤水分胁迫对设施番茄叶片气孔特性的影响[J]. 生态学杂志, 2015, 34(5): 1234-1240. YANG Z Q, TAN W, LIU Z X, et al. Effect of soil water stress on stomatal characters of greenhouse tomato leaves[J]. Chinese Journal of Ecology, 2015, 34(5): 1234-1240. |
| [16] |
张德巧, 徐增莱, 褚晓芳, 等. 蓝莓叶片与抗旱性相关的解剖结构指标研究[J]. 果树学报, 2008, 25(6): 864-867. ZHANG D Q, XU Z L, CHU X F, et al. Study on leaf anatomical structure indexes related to drought resistance of blueberry[J]. Journal of Fruit Science, 2008, 25(6): 864-867. |
| [17] |
FRASER L H, GREENALL A, CARLYLE C, et al. Adaptive phenotypic plasticity of Pseudoroegneria spicata:Response of stomatal density, leaf area and biomass to changes in water supply and increased temperature[J]. Annals of Botany, 2009, 103(5): 769-775. DOI:10.1093/aob/mcn252 |
| [18] |
XU Z Z, ZHOU G S. Responses of leaf stomatal density to water status and its relationship with photosynthesis in a grass[J]. Journal of Experimental Botany, 2008, 59(12): 3317-3325. DOI:10.1093/jxb/ern185 |
| [19] |
李中华, 刘进平, 谷海磊, 等. 干旱胁迫对植物气孔特性影响研究进展[J]. 亚热带植物科学, 2016, 45(2): 195-200. LI Z H, LIU J P, GU H L, et al. Review on the effects of drought stress on plant stomatal characteristics[J]. Subtropical Plant Science, 2016, 45(2): 195-200. DOI:10.3969/j.issn.1009-7791.2016.02.021 |
| [20] |
HUGHES J, HEPWORTH C, DUTTON C, et al. Reducing stomatal density in barley improves drought tolerance without impacting on yield[J]. Plant Physiology, 2017, 174(2): 776-787. DOI:10.1104/pp.16.01844 |
| [21] |
TOMBESI S, NARDINI A, FRIONI T, et al. Stomatal closure is induced by hydraulic signals and maintained by ABA in drought-stressed grapevine[J]. Scientific Reports, 2015, 5: 12449. DOI:10.1038/srep12449 |
| [22] |
ENNAHLI S, EARL H J. Physiological limitations to photosynthetic carbon assimilation in cotton under water stress[J]. Crop Science, 2005, 45(6): 2374-2382. DOI:10.2135/cropsci2005.0147 |
| [23] |
AHMED S, NAWATA E, HOSOKAWA M, et al. Alterations in photosynthesis and some antioxidant enzymatic activities of mungbean subjected to waterlogging[J]. Plant Science, 2002, 163(1): 117-123. DOI:10.1016/S0168-9452(02)00080-8 |
 2019, Vol. 27
2019, Vol. 27



