光合作用是作物产量形成的重要物质基础[1], 光合效率大小是作物产量高低的决定性因素之一[2]。作物光合效率除受遗传因素影响外, 对环境因素也高度敏感, 水分是光合作用的重要原料, 干旱胁迫作为作物生长的逆境因子之一, 对作物的光合作用、水分代谢及物质转运等生理活动具有重要影响[3-7]。
甘薯[Ipomoea batatas (L.) Lam.]是重要的粮食、能源作物, 具有较强的耐旱、耐瘠特性[8], 曾为保障我国的粮食安全做出巨大贡献。关于甘薯水分生理方面的相关研究, 国外主要集中在甘薯抗逆基因的研究和探究甘薯耐旱的分子机理[9-10]; 国内则涉及甘薯耐旱性根系生物学研究、耐旱性生理生化机制及抗逆农艺措施等多个领域[11]。实践表明, 水分供应对甘薯生长发育、产量形成具有重要影响, 不同水分供应不仅影响甘薯根系对养分的吸收, 还对甘薯叶片的光合作用产生影响, 进而影响营养物质合成和块根产量。张海燕等[12]研究发现, 干旱发生的越早、持续时期越长, 对甘薯叶片光合作用的影响越大。孙哲等[13]研究发现, 干旱胁迫下施钾可使甘薯叶片气孔导度(Gs)下降, 气孔阻力增大, 从而降低蒸腾速率(Tr)和胞间CO2浓度(Ci), 提高甘薯叶片水分利用效率(WUE)。但是, 已有研究仅展示了不同水分条件下甘薯叶片光合速率及水分利用效率的变化, 对光合作用变化的机理却少有进行解释。
叶绿素荧光参数是一组描述植物光合作用机理和光合生理特征的变量, 由于环境胁迫可直接或间接地影响植物光系统Ⅱ(PSⅡ)的功能, 所以叶绿素荧光参数的变化可在一定程度上反映环境胁迫对植物的影响程度[14], 被视为研究植物光合作用与环境关系的内在探针。通过对不同逆境条件下叶绿素荧光参数的分析, 可深入了解各因素对植物PSⅡ的影响以及光合机构对环境的适应机制。王慧等[15]关于肥料添加剂对甘薯叶绿素荧光特征参数的影响研究显示, 施用肥料添加剂使甘薯叶片单位反应中心用于热耗散的能量(DIo/RC)减少, 单位反应中心吸收的光能(ABS/RC)、单位反应中心捕获的用于电子传递的能量(ETo/RC)以及单位反应中心捕获的用于还原QA的能量(TRo/RC)增多, 以吸收光能为基础的性能指数(PIABS)上升。李长志等[16]对甘薯不同时期干旱研究显示, 与对照相比, 前期和中期干旱使甘薯叶片PSⅡ最大光化学效率(Fv/Fm)、PIABS降低。研究甘薯不同水分处理下叶绿素荧光参数的变化有助于判断各水分处理对PSⅡ的影响程度。
光响应曲线的拟合, 是植物光合生理生态学的重要研究手段, 通过光响应曲线的拟合可以获得暗呼吸速率(Rd)、光补偿点(Ic)、光饱和点(Isat)、最大净光合速率(Pnmax)和初始量子效率(α)等光合生理参数, 这些参数可以帮助确定植物的光合作用机构是否正常运转[17]。目前, 光合-光响应模型主要有直角双曲线修正模型、指数函数模型、非直角双曲线模型和直角双曲线模型等。由于植物光响应曲线拟合受水分差异影响较大[18], 且各模型推导机理存在差异, 不同模型往往具有不同的适应性[19]。对不同水分条件下山杏[Armeniaca sibirica (L.) Lam.][20]、玉米(Zea mays L.)[17]、日本荚蒾(Viburnum japonicum)[21]、胡杨(Populus euphratica Oliv.)[22]等植物的光响应模型研究表明, 在选择光响应拟合模型时应充分考虑物种及生长环境的差异。张玉娟等[23]使用非直角双曲线模型对3种水培甘薯进行了光响应拟合研究, 发现不同类型甘薯品种光响应特征参数存在一定差异。张磊等[24]选用4种模型对淀粉型、鲜食型和紫甘薯进行了光响应最佳模型的筛选, 发现直角双曲线修正模型对3种类型甘薯均有较好的拟合优势。截至目前, 关于不同模型对不同水分处理下甘薯光合响应过程的适应性并不清楚。因此, 本研究以鲜食型甘薯‘烟薯25号’为试验材料, 在室内盆栽条件下模拟设置3种土壤水分状况, 通过测定甘薯叶片的光合-光响应过程和荧光特性, 探讨不同水分处理对甘薯光合和荧光特性的影响, 并采用直角双曲线修正模型、指数函数模型、非直角双曲线模型和直角双曲线模型对光合-光响应曲线进行拟合, 筛选不同水分梯度下适宜甘薯叶片的最佳光响应拟合模型, 寻求不同水分条件下甘薯最大光强及适宜的光响应参数, 以期为甘薯高产栽培过程中的水分管理提供科学依据。
1 材料与方法 1.1 供试材料及方法试验采取盆栽法, 于2018年3月在青岛农业大学科研温室中进行。温室内光照强度约为自然光强的85%, 温度为25.9~30.6 ℃, 空气相对湿度为27.55%~ 57.72%, CO2浓度为405.4~418.5 μmol∙m-2∙s-1。试验用盆规格为21 cm×16 cm×21 cm(上径×下径×高), 供试土壤为砂姜黑土, 其基本理化性质为:土壤容重1.36 g∙cm-3, 田间持水量24.3%, pH 7.64, 土壤有机质6.26 g∙kg-1, 碱解氮26.55 mg∙kg-1, 速效磷43.41 mg∙kg-1, 速效钾71.96 mg∙kg-1。所有试验用土均过2 mm土筛后装盆, 每盆装土5 kg。供试甘薯品种为‘烟薯25号’, 其耐旱性属中等偏低水平。
1.2 试验设计试验设置干旱(土壤饱和含水量的30%~35%)、正常(土壤饱和含水量的60%~65%)、淹水(土壤饱和含水量的90%~95%)3个水分梯度。每个处理6次重复, 完全随机排列。于2018年3月14日, 选取长势一致的5叶一心薯苗进行移栽, 每盆定植1株。移栽后, 将土壤相对含水量控制在75%左右进行缓苗直至进行水分处理。2018年4月14日(移栽后30 d)开始进行水分处理, 每天18:00用电子秤称重补水至设定土壤水分含量范围内, 结合土壤墒情测定仪, 使各处理的土壤含水量维持在设定水平。在试验期间, 定期调换各处理的相对位置, 以保证各处理均能得到等量光照。
1.3 分析项目以及测定方法 1.3.1 光合-光响应曲线自水分处理后第20 d土壤相对含水量达到预设的水平开始, 在上午9:00—11:30, 使用美国汉莎CIRAS-3型便携式光合作用仪测定系统, 在甘薯主茎上数第5片完全展开叶的固定位置进行光合-光响应曲线测定。CO2浓度设定为大气CO2浓度, 空气相对湿度为70%±5%, 叶片温度为(28±2) ℃, 分别设置光有效辐射强度(PAR, μmol∙m-2∙s-1)为1 600、1 400、1 200、1 000、800、600、400、200、100、80、40和0共12个梯度, 按照PAR由高到低的顺序测定, 由仪器自动记录不同PAR下的净光合速率(Pn)、胞间CO2浓度(Ci)、蒸腾速率(Tr)、气孔导度(Gs)等指标。试验期间每个处理测定3次, 每次测定间隔3 d, 测定时, 每株记录5个读数。根据以上测定结果计算叶片瞬时水分利用效率WUE=Pn/Tr, 气孔限制值Ls=1-Ci/Ca, Ca为仪器直接测定出的大气CO2浓度。
1.3.2 叶绿素荧光参数在每次测定光合-光响应曲线参数的同时, 利用美国汉莎公司生产的M-PEA, 测定各株相同位置叶片的叶绿素荧光参数。测定时, 每株获取5次重复读数。
1.4 光合-光响应模型拟合采用以下4种模型进行光响应曲线的拟合。并根据实测数据点走势估计暗呼吸速率(Rd, μmol∙m-2∙s-1)、光补偿点(Ic, μmol∙m-2∙s-1)、饱和光强(Isat, μmol∙m-2∙s-1)和最大净光合速率(Pnmax, μmol∙m-2∙s-1)[14]。利用Microsoft Excel 2010进行数据统计和图表绘制, 利用DPS数据处理系统进行光合参数的单因素方差分析。
1) 直角双曲线模型
Baly[25]在1935年提出的直角双曲线模型的数学表达式为:
| $ {P_{\rm{n}}} = {P_{\rm{n}}}\left( I \right) = \frac{{\alpha I{P_{{\rm{nmax}}}}}}{{\alpha I + {P_{{\rm{nmax}}}}}} - {R_{\rm{d}}} $ | (1) |
式中: Pn表示净光合速率; I表示光合有效辐射值(本文中用PAR表示); Pnmax表示最大净光合速率; Rd表示暗呼吸速率; α是光响应曲线中光强为零时的斜率, 也就是光响应曲线的初始斜率, 又称为初始量子效率。光补偿点(Ic)计算公式为:
| $ {I_{\rm{c}}} = \frac{{{R_{\rm{d}}} \times {P_{{\rm{nmax}}}}}}{{\alpha \left( {{P_{{\rm{nmax}}}} - {R_{\rm{d}}}} \right)}} $ | (2) |
直线
2) 非直角双曲线模型
1976年, Thornley[26]提出的非直角双曲线模型的数学表达式为:
| $ {P_{\rm{n}}}\left( I \right) = \frac{{\alpha \times I + {P_{{\rm{nmax}}}} - \sqrt {{{\left( {\alpha \times I + {P_{{\rm{nmax}}}}} \right)}^2} - 4 \times I \times \alpha \times k \times {P_{{\rm{nmax}}}}} }}{{2k}} - {R_{\rm{d}}} $ | (3) |
式中: Pnmax、α、Rd和I的定义同前; k是曲角参数, 表示光响应曲线的凸度。Ic计算公式为:
| $ {I_{\rm{c}}} = \frac{{{R_{\rm{d}}} \times {P_{{\rm{nmax}}}} - k \times {R_{\rm{d}}}^2}}{{\alpha \left( {{P_{{\rm{nmax}}}} - {R_{\rm{d}}}} \right)}} $ | (4) |
直线
3) 指数函数模型
1991年, Bassman等[27]提出的指数函数模型的数学表达式为:
| $ {P_{\rm{n}}}\left( I \right) = {P_{{\rm{nmax}}}}\left( {1 - {e^{ - \alpha I/{P_{{\rm{nmax}}}}}}} \right) - {R_{\rm{d}}} $ | (4) |
式中: Pn、α、I、Pnmax、Rd的定义同前, e为自然对数的底数。估算Isat时, 假设Pn为0.99 Pnmax时所对应的光强即为饱和光强。
4) 直角双曲线修正模型
2007年, 中国学者Ye[28]提出的直角双曲线修正模型即光响应叶子飘新模型数学表达式为:
| $ {P_{\rm{n}}}(I) = \alpha \frac{{1 - \beta I}}{{1 + \gamma I}}\left( {I - {I_c}} \right) $ | (5) |
式中: α、I的定义同前; β和γ为系数, 其中β为修正系数, 也称光抑制项, γ是一个与光强无关的系数, 也被称为光饱和项[29]。
暗呼吸速率(Rd)计算公式为:
| $ {R_{\rm{d}}} = - P\left( {I = 0} \right) = - \alpha {I_{\rm{c}}} $ | (6) |
饱和光强(Isat)计算公式为:
| $ {I_{{\rm{sat}}}} = \frac{{\sqrt {\left( {\beta + \gamma } \right) + \left( {1 + \gamma {I_c}} \right)/\beta } - 1}}{\gamma } $ | (7) |
最大净光合速率(Pnmax)计算公式为:
| $ {P_{{\rm{n}}\;{\rm{max}}}} = \alpha \frac{{1 - \beta {I_{{\rm{sat}}}}}}{{1 + \gamma {I_{{\rm{sat}}}}}}({I_{{\rm{sat}}}} - {I_{\rm{c}}}) $ | (8) |
叶片比活力参数, 即叶片单位受光面积(CS)的各种量子效率, 包括单位面积吸收的光能(ABS/ CSo)、单位面积捕获的光能(TRo/CSo)、单位面积电子传递的量子产额(ETo/CSo)、单位面积用于热耗散的能量(DIo/CSo)以及单位面积上反应中心的数量(RCo/CSo)[14], 所有参数的计算均基于叶绿素荧仪所获取的荧光参数, 通过计算两两的比值得到。
1.6 数据处理所有数据的处理和统计图的绘制均通过Microsoft Excel 2010进行。利用LSD法进行数据之间的差异显著性检验, 显著性水平设置为0.05。
2 结果与分析 2.1 不同水分处理下甘薯叶片气体交换参数的光响应变化不同水分处理下, 净光合速率(Pn)随光强(PAR)变化表现出相似的响应规律, 3种水分处理在光强0~1 600 μmol∙m-2∙s-1内Pn-PAR曲线变化趋势均呈先迅速升高后增速减缓。其中, PAR 0~200 μmol∙m-2∙s-1时Pn均呈快速增加趋势, 当PAR > 200 μmol∙m-2∙s-1后Pn增速减缓直至开始下降。正常水分处理Pn显著(P < 0.05)大于干旱和淹水处理, 干旱和淹水处理Pn差异不明显(图 1a)。
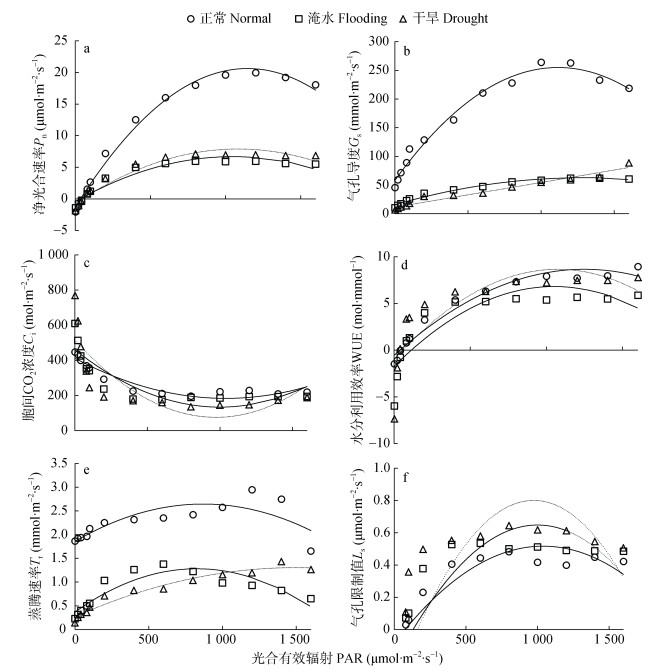
|
图 1 不同水分处理下甘薯叶片气体交换参数的光响应变化 Fig. 1 Light-response variation of gas exchange parameters of sweet potato leaves under different water treatments 图中曲线均由二项式拟合得出。The curves in the figure are all derived from the binomial fit. Pn: net photosynthetic rate; Gs: stomatal conductance; Ci: intercellular CO2; WUE: water use efficiency; Tr: transpiration rate; Ls: stomatal limit; PAR: photosynthetically active radiation. |
甘薯叶片气孔导度(Gs)随PAR变化在不同水分处理下存在差异。当PAR < 200 μmol∙m-2∙s-1时, 3种水分处理甘薯叶片气孔导度(Gs)均随PAR的增加而迅速增加; 当PAR > 1 000 μmol∙m-2∙s-1时, 正常和干旱处理Gs开始降低, 而淹水处理持续增加。相同PAR条件下, 以正常水分处理Gs最大, 并且显著高于干旱和淹水处理(P < 0.05), 干旱和淹水处理的Gs差异不显著(图 1b)。
3个水分处理叶片胞间CO2浓度(Ci)均随PAR的增加呈先降低后增加的趋势, 当PAR < 200 μmol∙m-2∙s-1时, Ci呈快速降低趋势; 当200 μmol∙m-2∙s-1 < PAR < 1 000 μmol∙m-2∙s-1时降幅减缓; 当PAR > 1 000 μmol∙m-2∙s-1时Ci值有所回升(图 1c)。
不同水分处理下甘薯叶片水分利用效率(WUE)均随PAR的增加呈先增加后降低的趋势。在PAR < 1 200 μmol∙m-2∙s-1时, 干旱处理WUE最大, 其次为正常处理, 淹水处理WUE最小; 当PAR继续增加, 干旱处理WUE降低, 正常水分处理WUE大于干旱处理, 淹水处理WUE最小(图 1d)。
正常和淹水处理叶片蒸腾速率(Tr)均随PAR的增加呈先增加后降低的趋势。干旱处理Tr随PAR变化呈持续增加趋势。在任意光强下, 正常水分处理Tr均大于干旱和淹水处理; 当PAR < 1 000 μmol∙m-2∙s-1时, 淹水处理的Tr大于干旱处理; 当PAR > 1 000 μmol∙m-2∙s-1时, 淹水处理的Tr小于干旱处理(图 1e)。
不同水分处理下甘薯叶片气孔限制值(Ls)均随PAR的增加呈先增加后降低的趋势。当PAR < 200 μmol∙m-2∙s-1时, 3个处理Ls大小顺序为正常处理 > 淹水处理 > 干旱处理; 当PAR > 200 μmol∙m-2∙s-1时, 3个水分处理Ls大小顺序为干旱处理 > 淹水处理 > 正常处理(图 1f)。
2.2 不同水分处理下甘薯叶片荧光特性分析 2.2.1 不同水分处理对甘薯叶片比活性参数的影响由图 2可知, 单位面积吸收的光能(ABS/CSo)以正常水分处理下最大, 其次为干旱处理, 淹水处理下最小, 干旱处理和淹水处理相对正常水分处理分别下降7.23%和16.99%。单位面积捕获的光能、单位面积电子传递的量子产额、单位面积上反应中心的数量(TRo/CSo、ETo/CSo、REo/CSo)均为正常水分处理下最大, 其次为淹水处理, 干旱处理下最小, 淹水相对正常水分处理分别下降3.96%、11.01%、14.37%, 干旱处理相对于淹水处理分别下降6.57%、22.56%、18.06%。甘薯叶片单位面积用于热耗散的能量(DIo/CSo)正常水分处理下最小, 淹水处理下最大, 干旱处理和淹水处理相对正常水分处理分别增加26.42%和38.29%。
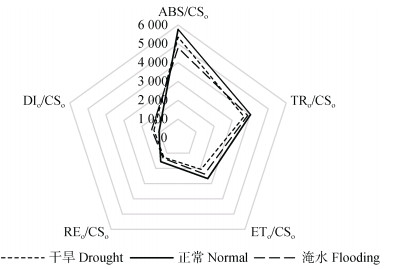
|
图 2 不同水分处理对甘薯叶片比活性参数的影响 Fig. 2 Effects of different water treatments on specific activity parameters of sweet potato leaves |
PIABS作为叶片光化学性能指数, 可以准确地反映植物的光合机构状态和胁迫对光合机构的影响[19]; Fv/Fm代表叶片PSⅡ的最大光化学效率, 反映PSⅡ反应中心内原初光能的转换效率[30]。如图 3所示, 正常水分处理甘薯叶片的PIABS显著大于干旱处理和淹水处理, 三者大小顺序为正常处理 > 干旱处理 > 淹水处理。与正常水分处理相比, 干旱和淹水处理的PIABS分别降低30.21%和34.41%, 淹水处理相对于干旱处理降低6.02%。不同水分处理甘薯叶片的Fv/Fm正常水分处理最高, 干旱和淹水处理分别降低3.71%和1.64%, 淹水处理相对于干旱处理降低2.10%, 但差异均未达显著水平。
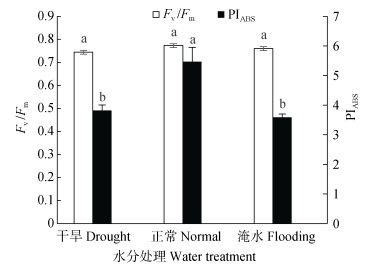
|
图 3 不同水分处理对甘薯叶片最大光化学效率(Fv/Fm)及光化学性能指数(PIABS)的影响 Fig. 3 Effects of different water treatments on maximal photochemical efficiency (Fv/Fm) and photochemical performance index (PIABS) of sweet potato leaves |
利用直角双曲线模型、非直角双曲线模型、指数函数模型以及直角双曲线修正模型对不同水分条件下甘薯光合响应曲线进行拟合, 结果如图 4所示。在弱光强下(PAR < 400 μmol∙m-2∙s-1), 3个水分处理的4种模型拟合的光合-光响应曲线的变化趋势基本一致, 甘薯叶片净光合速率(Pn)随着PAR的增加而持续上升; 当PAR继续加强, 直角双曲线模型、非直角双曲线模型、指数模型得到的拟合曲线均为渐近线, 没有极值, 其Pn随着PAR的增加而持续增加; 直角双曲线修正模型拟合达到饱和光强后拟合曲线呈现非线性下降趋势。
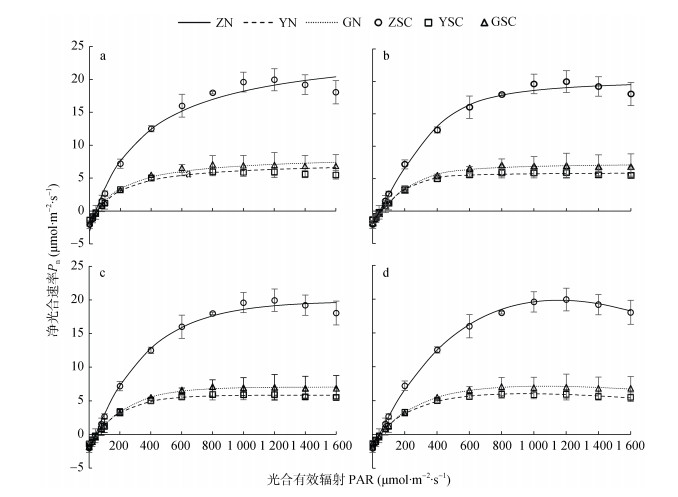
|
图 4 甘薯叶片净光合速率光响应的实测点与不同模型拟合曲线(a:直角双曲线模型; b:非直角双曲线模型; c:指数函数模型; d:直角双曲线修正模型) Fig. 4 Light-response curves of photosynthesis of sweet potato leaves under different water treatments (a: rectangular hyperbolic model; b: non-rectangular hyperbolic model; c: exponential model; d: modified rectangular hyperbolic model) ZN:正常水分处理拟合值; YN:淹水处理拟合值; GN:干旱处理拟合值; ZSC:正常水分处理实测值; YSC:淹水处理实测值; GSC:干旱处理实测值。ZN: fitted value of normal water treatment; YN: fitted value of flooded water treatment; GN: fitted value of drought treatment; ZSC: measured value of normal moisture treatment; YSC: measured value of flooded water treatment; GSC: measured value of drought treatment. Pn: net photosynthetic rate; PAR: photosynthetically active radiation. |
表 1展示了不同模型拟合下不同水分处理甘薯叶片光合响应特征参数。由表 1可知, 在各水分条件下, 直角双曲线模型和非直角双曲线模型拟合出的最大净光合速率(Pnmax)均大于实测值, 指数模型拟合出Pnmax小于实测值, 且三者均为呈上升趋势的渐近线, 无法拟合出饱和光强(Isat)。直角双曲线修正模型拟合出的Pnmax与实测值接近, 且通过模型拟合得到的Isat也接近实测值。从拟合精度的比较来看, 直角双曲线模型在各水分处理下的决定系数(R2)最小, 可知该模型拟合精度最低; 非直角双曲线模型、指数模型在各水分处理下R2均大于0.990 0;直角双曲线修正模型仅在淹水处理下R2小于0.999 0, 拟合精度为4个模型中最优。
| 表 1 不同模型拟合的不同水分处理甘薯叶片光响应特征参数 Table 1 Light response parameters of sweet potato leaves under different water treatments fitted by different models |
本研究选用直角双曲线修正模型拟合所获取的光合响应特征参数进行分析(表 1)。最大净光合速率(Pnmax)以正常水分处理下最大, 为19.64 μmol∙m-2∙s-1, 淹水和干旱处理下分别为6.02 μmol∙m-2∙s-1和7.13 μmol∙m-2∙s-1, 相对于正常水分处理分别降低69.35%和63.70%, 差异显著; 饱和光强(Isat)以正常水分处理最大, 为1 157.45 μmol∙m-2∙s-1, 淹水和干旱处理相对于正常水分处理分别下降18.12%和8.27%, 差异显著; 光补偿点(Ic)以正常水分处理最低, 为42.93 μmol∙m-2∙s-1, 淹水和干旱处理相对于正常水分处理分别升高7.17%和21.85%, 差异显著; 暗呼吸速率(Rd)以正常水分处理最高, 为2.25 μmol∙m-2∙s-1, 淹水和干旱处理相对于正常处理分别降低30.67%和15.56%, 差异显著; 初始量子效率(α)在3种水分处理下的值均在0~0.125的理论范围值内[31], 以正常水分处理最大, 为0.054 9, 淹水和干旱处理相对于正常处理分别减少28.78%和23.32%, 差异显著。
3 讨论 3.1 水分胁迫对甘薯叶片光合及荧光参数的影响土壤水分是影响植物光合作用、水分代谢和物质转运等生理活动的重要因素[7]。水分胁迫可使植物叶片对光的利用能力减弱[32-34], 从而使净光合速率(Pn)降低。研究表明, 环境胁迫条件下, 植物可以通过气孔限制和非气孔限制两条途径降低叶片Pn, 从而提高其对水分胁迫的适应能力[30-36], 不同途径可以根据叶片胞间CO2浓度(Ci)和气孔限制值(Ls)进行判定。当Pn下降时, 若Ci降低, Ls升高, 则Pn下降主要由气孔限制导致; 若Ci升高或不变, Ls降低, 则Pn下降主要由非气孔限制导致[35]。本研究中, 当PAR≤1 000 μmol∙m-2∙s-1时, 干旱和淹水处理Ci降低, Ls增加, 说明主要受气孔限制; 当PAR > 1 000 μmol∙m-2∙s-1时, 随着PAR的增加, 干旱和淹水处理Ls降低, Pn降低使得CO2消耗减少, Ci增加, 表明Pn的降低主要受非气孔限制。WUE是水分胁迫条件下, 植物协调Pn与蒸腾速率(Tr)的外在表现。低水分条件下Tr对水分的响应比Pn敏感, Tr处于极低值, 强光容易导致叶温过高而使叶片出现灼伤[37]。从本研究结果来看, 干旱处理下, 当PAR < 1 000 μmol∙m-2∙s-1时, 拥有最高的WUE, 表明适度干旱胁迫和适宜的光强可使甘薯叶片达到最高的水分利用效率, 当PAR > 1 000 μmol∙m-2∙s-1时, 则以正常水分处理WUE最高, 表明高光强下, 干旱处理甘薯叶片Pn因非气孔限制而下降, 甘薯叶片的WUE随之下降。
叶绿素荧光参数能够反映植物叶片光合变化的内在原因[31], 可作为植物在胁迫条件下受损程度的重要评价指标[14]。其中, 光化学性能指数(PIABS)与光化学效率(Fv/Fm)分别反映植物的光合机构状态和PSⅡ反应中心内原初光能的转换效率, 光合机构的比活性参数则可以反映植物光合器官对光能的吸收、转化和耗散等情况[14]。本研究中, 甘薯叶片PIABS和Fv/Fm的降低说明干旱对光合机构造成了损伤, 而光合机构比活性参数TRo/CSo、ABS/CSo、REo/CSo和ETo/CSo变化则表明由于干旱或淹水处理导致叶片光合机构受损, 从而使叶片对光的捕获和吸收利用率下降, 甘薯叶片为避免水分胁迫下光合器官的损伤, 迫使PSⅡ光化学活性下降, 使Pn降低。本研究中干旱处理下甘薯叶片在Pn降低的同时DIo/CSo增大, 表明未利用的光能大多以热能的形式耗散, 这可能是甘薯为减轻过剩的光能对PSⅡ造成损伤而启动的一种对逆境胁迫的保护机制。
3.2 不同水分处理下光响应模型的应用光合-光响应曲线模型拟合, 作为植物光合生理生态学研究的重要手段, 可获得光合作用初始量子效率(α)、暗呼吸速率(Rd)、光补偿点(Isat)、饱和光强(Ic)和最大净光合速率(Pnmax)等重要生理参数, 这些参数有助于确定植物光合作用机构运转是否正常、不同光强环境下光合作用能力及光适应性的判别等[19]。目前应用较多的模型包括直角双曲线模型、非直角双曲线模型、指数模型和双曲线修正模型。其中, 非直角双曲线模型和直角双曲线修正模型均考虑了光响应曲线的弯曲程度, 拟合结果较符合生理学意义[31], 本研究中非直角双曲线模型对初始量子效率的拟合结果也更接近真实值, 可见其对低光强下的拟合效果较好; 但直角双曲线修正模型能较好地拟合光抑制阶段的光响应过程[34], 对整个光响应过程拟合精度优于非直角双曲线模型; 而直角双曲线模型未考虑弯曲程度, 为使曲线更加符合实测点的分布, 必须提高初始斜率, 从而降低了模型的拟合精度[19]。另外, 直角双曲线与非直角双曲线模型拟合曲线均为渐近线, 没有极值, 均无法拟合出植物在达到饱和光强后Pn随PAR增大而降低的响应趋势[27, 38-39], 估算出的Pnmax也必将大于实测值。本研究中, 4个模型对不同水分处理下甘薯叶片光合参数拟合存在差异, 直角双曲线模型、非直角双曲线模型和指数模型均无法拟合出甘薯叶片在达到饱和光强后Pn随PAR增加而降低的部分, 直角双曲线修正模型则较好地拟合出饱和光强后下降的部分, 提高了拟合精度, 对各水分处理均有较高的拟合优势, 这与前人大多数结果一致[19-22]。
3.3 不同水分处理下光响应参数的变化光响应参数是通过模型拟合所得出的反映甘薯叶片光合能力大小的一系列参数。其中, Pnmax是衡量叶片光合能力大小的指标, 反映了植物叶片在特定环境条件下的光合潜力[40]。本研究中, 干旱和淹水条件下, Pnmax与正常处理叶片相比下降显著, 说明干旱以及淹水处理限制了甘薯叶片光合潜能的发挥; 与干旱处理相比, 淹水条件下Pnmax更低, PIABS下降幅度和单位面积吸收的光能ABS/CSo均小于干旱处理, 表明淹水对甘薯叶片光系统造成的损伤大于干旱处理, 淹水处理下甘薯叶片的光合潜能最小, 光能更多地以热耗散的形式散失, 降低了其光合效率。从模型拟合的甘薯叶片α、Isat和Ic值来看, 干旱和淹水条件下的甘薯叶片Ic增加, Isat降低, 且淹水处理α和Isat显著低于干旱处理, 叶片Ic高于干旱处理, 说明干旱和淹水条件下, 甘薯叶片对弱光和强光的利用能力均明显减弱, 且淹水比干旱更易于降低甘薯叶片对光的利用能力。另外, 从模型拟合结果还可以看出, 3种水分处理下的α值均在0~0.125的理论范围值内[31], 说明即使干旱和淹水条件下, 甘薯对弱光仍具有较高的利用能力, 低光强下潜在光合能力较强, 这可能是甘薯在旱作条件下仍具有一定产量的原因。本研究中, 干旱和淹水条件下, 甘薯的Rd值为1.56~1.90 μmol∙m-2∙s-1, 与正常水分处理相比显著降低, 而Rd反映了植物在没有光照下的呼吸速率[41], 说明甘薯在水分胁迫条件下使呼吸作用减弱, 通过降低叶片生理活性来减少光合产物的消耗, 从而缓解土壤水分胁迫, 这也是甘薯对水分逆境的一种生理适应性。
4 结论1) 淹水和干旱处理相对于正常水分处理Pn明显降低, 在PAR≤1 000 μmol∙m-2∙s-1时, 干旱和淹水处理Pn主要受气孔限制因素的影响, 在PAR > 1 000
μmol∙m-2∙s-1时, Pn主要受非气孔限制因素的影响; 一定光强下, 适度的干旱胁迫能够提高甘薯叶片WUE, 光强过大会加重干旱环境下甘薯叶片的胁迫程度, 降低了甘薯对水分的利用能力。
2) 淹水和干旱处理对光吸收机构造成损伤, 使PSⅡ捕获和吸收的光能减少, 光合电子传递受阻, 光合速率下降。同时, 淹水和干旱处理还可使PSⅡ光化学活性下降, 从而增大热耗散的投入, 避免过剩光能对PSⅡ造成伤害。
3) 直角双曲线修正模型可以较好地拟合光饱和点后Pn下降的部分, 对甘薯叶片各水分处理均有较好的适应性。干旱和淹水处理均显著降低了甘薯叶片的Pnmax, 使光照生态幅变窄, 光抑制明显, 淹水比干旱更易于降低甘薯叶片对光的利用能力。但弱光条件下, 处于干旱环境的甘薯仍具有一定的光合能力, 干旱和淹水处理初始量子效率均位于理论值范围内, 表明甘薯胁迫环境下仍具有较高的光合潜能。
| [1] |
张向前, 曹承富, 乔玉强, 等. 不同土壤水分条件对小麦光合生理和产量的影响[J]. 西北农业学报, 2015, 24(4): 44-50. ZHANG X Q, CAO C F, QIAO Y Q, et al. Effect of soil water content on photosynthesis and yield of wheat under different soil water content conditions[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2015, 24(4): 44-50. |
| [2] |
许大全. 光合作用效率[M]. 上海: 上海科学技术出版社, 2002. XU D Q. Photcaynthetic Efficiency[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2002. |
| [3] |
安玉艳, 梁宗锁, 韩蕊莲, 等. 土壤干旱对黄土高原3个常见树种幼苗水分代谢及生长的影响[J]. 西北植物学报, 2007, 27(1): 91-97. AN Y Y, LIANG Z S, HAN R L, et al. Effect of soil drought on seedling growth and water metabolism of three tree species in loess plateau[J]. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(1): 91-97. DOI:10.3321/j.issn:1000-4025.2007.01.016 |
| [4] |
YUAN X K, YANG Z Q, LI Y X, et al. Effects of different levels of water stress on leaf photosynthetic characteristics and antioxidant enzyme activities of greenhouse tomato[J]. Photosynthetica, 2016, 54(1): 28-39. DOI:10.1007/s11099-015-0122-5 |
| [5] |
李德全, 张建华.冬小麦根系渗透调节的研究[C]//面向21世纪的科技进步与社会经济发展.杭州: 中国科学技术协会, 1999 LI D Q, ZHANG J H. Study on root infiltration regulation of winter wheat[C]//Scientific and Technological Progress and Social and Economic Development Facing the 21st Century. Hangzhou: China Association for Science and Technology, 1999 |
| [6] |
陈鹏, 潘晓玲. 干旱和NaCl胁迫下梭梭幼苗中甜菜碱含量和甜菜碱醛脱氢酶活性的变化(简报)[J]. 植物生理学通讯, 2001, 37(6): 520-522. CHEN P, PAN X L. Change of betaine contents and activity of betaine aldehyde dehydrogenase in seedlings of Haloxylon ammodendron under drought and NaCl stress[J]. Plant Physiology Communications, 2001, 37(6): 520-522. |
| [7] |
夏江宝, 田家怡, 张光灿, 等. 黄河三角洲贝壳堤岛3种灌木光合生理特征研究[J]. 西北植物学报, 2009, 29(7): 1452-1459. XIA J B, TIAN J Y, ZHANG G C, et al. Photosynthetic and physiological characteristics of three shrubs species in shell islands of Yellow River Delta[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(7): 1452-1459. DOI:10.3321/j.issn:1000-4025.2009.07.025 |
| [8] |
张宪初, 王胜亮. 旱地甘薯田水分供需状况及增产措施研究[J]. 干旱地区农业研究, 1999, 17(4): 93-97. ZHANG X C, WANG S L. Research on field water supply and requirement condition of dryland sweet potato and yield-increasing method[J]. Agricultural Research in the Arid Areas, 1999, 17(4): 93-97. DOI:10.3321/j.issn:1000-7601.1999.04.018 |
| [9] |
MAKUNDE G S, ANDRADE M I, RICARDO J, et al. Adaptation to mid-season drought in a sweetpotato (Ipomoea batatas[L.] Lam) germplasm collection grown in Mozambique[J]. Open Agriculture, 2017, 2(1): 133-138. |
| [10] |
MBINDA W, OMBORI O, DIXELIUS C, et al. Xerophyta viscosa aldose reductase, xvald1, enhances drought tolerance in transgenic sweetpotato[J]. Molecular Biotechnology, 2018, 60(3): 203-214. DOI:10.1007/s12033-018-0063-x |
| [11] |
孙哲, 范维娟, 刘桂玲, 等. 干旱胁迫下外源ABA对甘薯苗期叶片光合特性及相关生理指标的影响[J]. 植物生理学报, 2017, 53(5): 873-880. SUN Z, FAN W J, LIU G L, et al. Effects of exogenous ABA on leaf photosynthetic characteristics and associated physiological indexes of sweetpotato (Ipomoea batatas) seedlings under drought stress[J]. Plant Physiology Journal, 2017, 53(5): 873-880. |
| [12] |
张海燕, 解备涛, 段文学, 等. 不同时期干旱胁迫对甘薯光合效率和耗水特性的影响[J]. 应用生态学报, 2018, 29(6): 1943-1950. ZHANG H Y, XIE B T, DUAN W X, et al. Effects of drought stress at different growth stages on photosynthetic efficiency and water consumption characteristics in sweet potato[J]. Chinese Journal of Applied Ecology, 2018, 29(6): 1943-1950. |
| [13] |
孙哲, 史春余, 刘桂玲, 等. 干旱胁迫与正常供水钾肥影响甘薯光合特性及块根产量的差异[J]. 植物营养与肥料学报, 2016, 22(4): 1071-1078. SUN Z, SHI C Y, LIU G L, et al. Effect difference of potassium fertilizer on leaf photosynthetic characteristics and storage root yield of sweet potato under drought stress and normal water condition[J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(4): 1071-1078. |
| [14] |
李鹏民, 高辉远, STRASSER R J. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J]. 植物生理与分子生物学学报, 2005, 31(6): 559-566. LI P M, GAO H Y, STRASSER R J. Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study[J]. Journal of Plant Physiology and Molecular Biology, 2005, 31(6): 559-566. |
| [15] |
王慧, 曾路生, 刘庆, 等. 肥料添加剂对甘薯冠层光谱和叶绿素荧光参数特征的影响[J]. 华北农学报, 2017, 32(1): 142-148. WANG H, ZENG L S, LIU Q, et al. Effects of fertilizer additives on spectrum characteristics and the chlorophyll fluorescence parameters in sweet potato[J]. Acta Agriculturae Boreali-Sinica, 2017, 32(1): 142-148. |
| [16] |
李长志, 李欢, 刘庆, 等. 不同生长时期干旱胁迫甘薯根系生长及荧光生理的特性比较[J]. 植物营养与肥料学报, 2016, 22(2): 511-517. LI C Z, LI H, LIU Q, et al. Comparison of root development and fluorescent physiological characteristics of sweet potato exposure to drought stress in different growth stages[J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(2): 511-517. |
| [17] |
朱永宁, 张玉书, 纪瑞鹏, 等. 干旱胁迫下3种玉米光响应曲线模型的比较[J]. 沈阳农业大学学报, 2012, 43(1): 3-7. ZHU Y N, ZHANG Y S, JI R P, et al. Fitting light response curve of photosynthesis of maize under drought stress[J]. Journal of Shenyang Agricultural University, 2012, 43(1): 3-7. |
| [18] |
韩刚, 赵忠. 不同土壤水分下4种沙生灌木的光合光响应特性[J]. 生态学报, 2010, 30(15): 4019-4026. HAN G, ZHAO Z. Light response characteristics of photosynthesis of four xerophilous shrubs under different soil moistures[J]. Acta Ecologica Sinica, 2010, 30(15): 4019-4026. |
| [19] |
王荣荣, 夏江宝, 杨吉华, 等. 贝壳砂生境干旱胁迫下杠柳叶片光合光响应模型比较[J]. 植物生态学报, 2013, 37(2): 111-121. WANG R R, XIA J B, YANG J H, et al. Comparison of light response models of photosynthesis in leaves of Periploca sepium under drought stress in sand habitat formed from seashells[J]. Chinese Journal of Plant Ecology, 2013, 37(2): 111-121. |
| [20] |
郎莹, 张光灿, 张征坤, 等. 不同土壤水分下山杏光合作用光响应过程及其模拟[J]. 生态学报, 2011, 31(16): 1517-1524. LANG Y, ZHANG G C, ZHANG Z K, et al. Light response of photosynthesis and its simulation in leaves of Prunus sibirica L. under different soil water conditions[J]. Acta Ecologica Sinica, 2011, 31(16): 1517-1524. |
| [21] |
李瑞姣, 陈献志, 岳春雷, 等. 干旱胁迫对日本荚蒾幼苗光合生理特性的影响[J]. 生态学报, 2018, 38(6): 2041-2047. LI R J, CHEN X Z, YUE C L, et al. Effects of drought stress on the photosynthetic characteristics of Viburnum japonicum seedlings[J]. Acta Ecologica Sinica, 2018, 38(6): 2041-2047. |
| [22] |
周多多, 蒋少伟, 吴桂林, 等. 不同水分条件下胡杨光响应曲线拟合模型比较[J]. 植物科学学报, 2017, 35(3): 406-412. ZHOU D D, JIANG S W, WU G L, et al. Comparison of light response models of photosynthesis in Populus euphratica Oliv. grown under contrasting groundwater conditions[J]. Plant Science Journal, 2017, 35(3): 406-412. |
| [23] |
张玉娟, 周金卢, 李育明, 等. 水培甘薯的光合研究[J]. 中国农学通报, 2011, 27(3): 112-115. ZHANG Y J, ZHOU J L, LI Y M, et al. The photosynthesis study of hydroponic sweet-potato[J]. Chinese Agricultural Science Bulletin, 2011, 27(3): 112-115. |
| [24] |
张磊, 刘维正, 辛国胜, 等. 3种专用型甘薯光合光响应曲线及其模型拟合研究[J]. 中国农学通报, 2015, 31(15): 71-77. ZHANG L, LIU W Z, XIN G S, et al. Photosynthesis light response curves of three sweet-potato varieties and model fitting[J]. Agricultural Science Bulletin, 2015, 31(15): 71-77. DOI:10.11924/j.issn.1000-6850.casb14110037 |
| [25] |
BALY E C C. The kinetics of photosynthesis[J]. Proceedings of the Royal Society of London Series B:Biological Sciences, 1935, 117(804): 218-239. DOI:10.1098/rspb.1935.0026 |
| [26] |
THORNLEY J H M. Mathematical Models in Plant Physiology[M]. London, New York: Academic Press (Inc.), 1976.
|
| [27] |
BASSMAN J H, ZWIER J C. Gas exchange characteristics of Populus trichocarpa, Populus deltoids and Populus trichocarpap×P. deltoids clones[J]. Tree Physiology, 1991, 8(2): 145-159. |
| [28] |
YE Z P. A new model for relationship between irradiance and the rate of photosynthesis in Oryza sativa[J]. Photosynthetica, 2007, 45(4): 637-640. DOI:10.1007/s11099-007-0110-5 |
| [29] |
叶子飘, 康华靖. 植物光响应修正模型中系数的生物学意义研究[J]. 扬州大学学报:农业与生命科学版, 2012, 32(2): 51-57. YE Z P, KANG H J. Study on biological significance of coefficients in modified model of photosynthesis-irradiance[J]. Journal of Yangzhou University:Agricultural and Life Science Edition, 2012, 32(2): 51-57. |
| [30] |
裴斌, 张光灿, 张淑勇, 等. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报, 2013, 33(5): 1386-1396. PEI B, ZHANG G C, ZHANG S Y, et al. Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities in Hippophae rhamnoides Linn. seedings[J]. Acta Ecologica Sinica, 2013, 33(5): 1386-1396. |
| [31] |
陆佩玲, 于强, 罗毅, 等. 冬小麦光合作用的光响应曲线的拟合[J]. 中国农业气象, 2001, 22(2): 12-14. LU P L, YU Q, LUO Y, et al. Fitting light response curves of photosynthesis of winter wheat[J]. Chinese Journal of Agrometeorology, 2001, 22(2): 12-14. DOI:10.3969/j.issn.1000-6362.2001.02.003 |
| [32] |
陈建, 张光灿, 张淑勇, 等. 辽东楤木光合和蒸腾作用对光照和土壤水分的响应过程[J]. 应用生态学报, 2008, 19(6): 1185-1190. CHEN J, ZHANG G C, ZHANG S Y, et al. Response processes of Aralia elata photosynthesis and transpiration to light and soil moisture[J]. Chinese Journal of Applied Ecology, 2008, 19(6): 1185-1190. |
| [33] |
夏江宝, 张淑勇, 赵自国, 等. 贝壳堤岛旱柳光合效率的土壤水分临界效应及其阈值分级[J]. 植物生态学报, 2013, 37(9): 851-860. XIA J B, ZHANG S Y, ZHAO Z G, et al. Critical effect of photosynthetic efficiency in Salix matsudana to soil moisture and its threshold grade in shell ridge island[J]. Chinese Journal of Plant Ecology, 2013, 37(9): 851-860. |
| [34] |
DU N, GUO W H, ZHANG X R, et al. Morphological and physiological responses of Vitex negundo L. var. heterophylla (Franch.) Rehd. to drought stress[J]. Acta Physiologiae Plantarum, 2010, 32(5): 839-848. DOI:10.1007/s11738-010-0468-z |
| [35] |
FARQUHAR G D, SHARKEY T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology, 1982, 33: 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
| [36] |
STEDUTO P, KATERJI N, PUERTOS-MOLINA H, et al. Water-use efficiency of sweet sorghum under water stress conditions Gas-exchange investigations at leaf and canopy scales[J]. Field Crops Research, 1997, 54(2/3): 221-234. |
| [37] |
夏江宝, 张光灿, 孙景宽, 等. 山杏叶片光合生理参数对土壤水分和光照强度的阈值效应[J]. 植物生态学报, 2011, 35(3): 322-329. XIA J B, ZHANG G C, SUN J K, et al. Threshold effects of photosynthetic and physiological parameters in Prunus sibirica to soil moisture and light intensity[J]. Chinese Journal of Plant Ecology, 2011, 35(3): 322-329. |
| [38] |
叶子飘. 光合作用对光和CO2响应模型的研究进展[J]. 植物生态学报, 2010, 34(6): 727-740. YE Z P. A review on modeling of responses of photosynthesis to light and CO2[J]. Chinese Journal of Plant Ecology, 2010, 34(6): 727-740. DOI:10.3773/j.issn.1005-264x.2010.06.012 |
| [39] |
黄红英, 窦新永, 孙蓓育, 等. 两种不同生态型麻疯树夏季光合特性的比较[J]. 生态学报, 2009, 29(6): 2861-2867. HUANG H Y, DOU X Y, SUN B Y, et al. Comparison of photosynthetic characteristics in two ecotypes of Jatropha curcas in summer[J]. Acta Ecologica Sinica, 2009, 29(6): 2861-2867. DOI:10.3321/j.issn:1000-0933.2009.06.012 |
| [40] |
TARTACHNYK I I, BLANKE M M. Effect of delayed fruit harvest on photosynthesis, transpiration and nutrient remobilization of apple leaves[J]. New Phytologist, 2004, 164(3): 441-450. DOI:10.1111/j.1469-8137.2004.01197.x |
| [41] |
COLEY P D. Herbivory and defensive characteristics of tree species in a lowland tropical forest[J]. Ecological Monographs, 1983, 53(2): 209-234. DOI:10.2307/1942495 |
 2019, Vol. 27
2019, Vol. 27



