2. 中国农业大学资源与环境学院 北京 100193;
3. 河北武安青崖寨国家级自然保护区管理中心 武安 056300
2. College of Resources and Environment, China Agricultural University, Beijing 100193, China;
3. Management Center of Wu'an Qingyazhai National Nature Reserve in Hebei, Wu'an 056300, China
集约化生产致使农业景观中大量半自然生境丧失, 农业景观破碎化和种植单一化严重, 导致生物多样性下降, 大量天敌物种濒临灭绝[1-3]。目前, 生态学家强调通过对农业景观的合理规划和生境管护为害虫天敌提供适宜的生存环境, 从而实现对农业生物多样性的保护[4-6]。有研究指出, 农业景观中残留的半自然生境相对于周围农田生境受人类干扰较小, 可以为农田天敌提供替代食源, 同时也为其提供了栖息地、避难所以及越冬场所, 在农业生物多样性的维持和保护中起到了重要作用[7]。国际生物防治组织(International Organization of Biological Control, IOBC)规定:农田景观中边角地、树篱、草带、溪流、池塘等非农生境用地至少占5%的比例, 当非农生境用地接近15%时, 才能对生物多样性保护和实现生物防治功能发挥有效作用[6, 8]。所以在大的景观尺度上要增加半自然生境比例, 形成背景复杂的“马赛克”镶嵌体景观, 有利于害虫种群的控制和生物多样性的保护[9-10]。地块尺度, 在农田边界种植植物篱这类半自然生境能保持农业景观中较高的生物多样性, 可作为地方乡土植物、珍稀物种和包括蜘蛛在内的害虫天敌重要的资源库[11]。
生境中植被组成、植被结构和人为干扰是影响生境内天敌生物多样性及其分布的主要原因。如野花带中开花植被能够为节肢动物提供大量的蜜源资源, 从而在开花时期吸引更多节肢动物[12]; 而具有乔木和灌木层植被组成的植物篱具有较复杂垂直结构, 受人类干扰相对更小, 为节肢动物提供的栖息环境更加稳定[13]; 农作物间作可以增加农田生境内的空间结构和植物的丰富度, 从而吸引更多节肢动物[6]; 草本植物丰富的半自然生境存在更多的植食者, 进而增加地表天敌的多样性[14-15]; 此外, 农林复合系统对于水土的保持、微气候的调节以及生物多样性的保护等各个方面都有巨大的效益[16-17], 是发展山区农业同时保持生态平衡的重要方式; 半自然生境内枯落物覆盖率高, 可为害虫天敌提供避难所、栖息地, 增加害虫天敌的多样性[18]。可见, 不同土地利用类型的半自然生境由于其植被群落组成和结构不同, 导致其所提供的食物资源及微生境也不同, 其维持的生物群落也不同。
蜘蛛(Araneida)是受植物群落结构和空间结构这类生境因素影响较大的天敌类群, 复杂的生境结构维持着蜘蛛的多样性和丰富度[19]。Tscharntke等[20]认为草本植被盖度和枯落物是一个地区蜘蛛丰富度最重要的解释因素; Samu等[21]发现在小麦(Triticum aestivum)田土地裂缝有利于吸引蜘蛛, 增加蜘蛛的数量; 郑国等[22]对西双版纳地区6种林型蜘蛛的多样性进行了对比研究, 认为植物群落结构、枯落物厚度是影响蜘蛛生物多样性的重要因素; 刘文惠等[23]、胡文超等[24]在苜蓿(Medicago sativa)邻作小麦刈割后对蜘蛛的迁移动态进行了模拟研究, 发现苜蓿的盖度是影响蜘蛛多样性的重要因素; 张旭珠等[25]研究发现作物收获前后蜘蛛在农田与相邻农田边界不断地迁入和迁出; 赵爽等[26]在黄河下游平原多尺度林地对蜘蛛多样性的研究得出, 植被盖度对蜘蛛多样性有显著影响, 当地大多数蜘蛛更倾向于高的植被盖度的林地。已有研究多集中于平原农业景观或者是自然保护区内部, 但是山区农业景观与自然景观之间的过渡区中关于不同半自然生境与蜘蛛多样性分布的研究较少。
河北省武安市地处河北省南部, 太行山东麓。境内西部的太行山区分布有国家级自然保护区、国家级森林公园和地质公园及京娘湖、洺河水源保护地, 且是农业生产发展较早的地区之一。随着农业生产的发展, 人们开始毁林开荒, 耕作山坡地, 种植粮食, 致使大面积的森林自然植被遭到破坏。目前该地区生物多样性的研究较少, 又因蜘蛛在农林生态系统及农业生物防治的重要生态地位[27-29], 亟待对当地不同土地利用类型的蜘蛛多样性分布进行研究, 为当地农业环境管护和生物多样性保护提供案例支持, 同时对当地苹果(Malus pumila)-芍药(Paeonia lactiflora)套作园和改玉米(Zea mays)种植花带(绿海花廊)这种农林复合用地的生态价值进行评估。为此, 本研究主要关注: 1)太行山区农业景观中不同类型生境蜘蛛物种组成与分布; 2)不同类型生境蜘蛛的Alpha多样性分布的主要影响因素; 3)不同类型生境蜘蛛的群落结构; 4)影响蜘蛛群落组成的主要因素。
1 研究区域与研究方法 1.1 研究区概况研究区位于河北省邯郸市武安市西部山区(113°45′15″~113°55′05″E, 36°50′29″~37°01′20″N), 毗邻青崖寨自然保护区, 自然、半自然生境比例高, 景观背景良好。山势险峻, 地质地貌特殊, 生态环境良好, 是太行山区生物多样性和自然历史遗迹的典型代表。植被类型主要包括针叶林、针阔混交林落叶、灌从、灌草丛、草甸, 河北工程大学景观生态课题组前期调研记录到野生维管植物900余种。气候类型属温带季风气候, 保护区内年平均气温11.1 ℃。由于气温较低, 大宗作物多实行一年1熟, 主要种植玉米和谷子(Setaria italic)等作物, 山坡多分布人工栽植的板栗(Castanea mollissima)林和核桃(Juglans regia)林, 还有柿树(Diospyros kaki)分散分布。近两年当地对道路两侧及河边农田进行景观提升和美化, 2018年在原有农田上, 种植宽约50 m的绿海花廊, 以菊科(Asteraceae)观赏植物为主。2018年大会庄将原有的玉米田套作苹果, 改为苹果套种芍药的复合式生产模式。
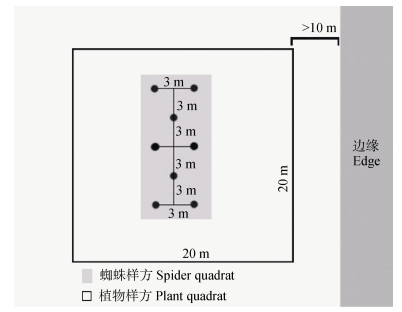
该试验于2019年在典型太行山农业景观区武安活水乡域内进行, 选择5种生境类型的样地: 1)核桃林, 当地半自然生境的代表; 2)玉米地, 当地农业生境的典型代表; 3)苹果-芍药套作园, 当地新型复合式生产模式的农业生境; 4)次生林, 当地自然生境的代表; 5)绿海花廊景观带, 当地近两年开始大面种植的非作物农业生境。每种生境类型选取4块20 m×20 m样地, 计20块样地(图 1)。样方范围设置于大会庄、门王庄、前渠村3个行政村内, 平均海拔759 m, 海拔差66 m。

|
图 1 研究区不同类型生境样点分布 Fig. 1 Map of sampling sites of different habits in the study region |
2019年5—8月利用陷阱法, 对5种生境类型样地的蜘蛛进行取样。在20 m×20 m的样方中心采用8点法取样(图 2), 每隔8~10 d取样1次, 共取样7次, 每种生境类型样地4个重复, 每个重复取8个布点杯。陷阱法是把塑料杯(上口径为7.2 cm, 下口径5.2 cm, 高10 cm)埋在地下, 地面与杯口齐平, 然后向内注入2/3的诱剂, 并盖上雨罩防止雨淋, 诱剂为75%的酒精加洗洁精和醋, 其作用是诱捕蜘蛛, 并保证不会腐烂[30]。取样后在实验室内分拣, 并用75%的酒精保存, 由河北工程大学植物保护实验室鉴定到种, 鉴定参考《河南蜘蛛志》《河北动物志蜘蛛类》《The Spiders of China》[31-33]等。
|
图 2 蜘蛛取样点设计 Fig. 2 Sampling plots design for spider collecting |
植物调查时间在8月初, 用20 m×20 m典型样方对植物进行全面调查。将植被划分为3个层次进行调查: 1)乔木层, 高度大于3 m; 2)灌木层, 高度在0.5~3 m之间; 3)草本层, 所有低于0.5 m的维管植物。记录样方内所有乔木、灌木的物种和盖度, 对草本层采用5点法取样, 在20 m×20 m的样方4个角和中心划定1 m×1 m的小样方记录里面的草本植物种类、种数(P)以及盖度(C)。枯落物厚度(D), 利用5点法测量, 分4个等级: D < 1 cm、1 cm < D≤3 cm、3 cm < D≤5 cm、D > 5 cm; 植物群落结构(S)根据植物层次划分等级, 草本层、灌木层+草本层、乔木层+灌木层+草本层(S=1, S=2, S=3);人为干扰(T)根据人为管理次数(打药、除草、浇水)划分4个等级(T < 1, 1 < T≤2, 2 < T≤5, T > 5)。不同生境植物群落基本情况见表 1。土壤酸碱性(pH)是在样方内进行5点取样, 采用电位法测定[34]。
| 表 1 研究区不同生境植物群落基本情况 Table 1 General information of vegetation of different habitats in the study areas |
蜘蛛的多样性采用Shannon-Wiener多样性指数、物种数、个体数为指标, 以上指标采用PAST 3.5软件计算[35]。为去除村庄影响, 分析采用混合效应模型, 以生境类型为固定因子, 以村庄为随机因子, 以Shannon-Wiener、丰富度和多度为响应变量进行分析, 其中蜘蛛多度数据经检测不符合正态分布, 采用平方根(Sqrt)进行转换, 符合正态分布后进行分析, 以上分析利用SPSS 20.0软件完成[36]。
利用多元回归分析检测各样地环境因子对地表蜘蛛Alpha多样性分布的影响, 以枯落物厚度(D)、植物群落结构(S)、干扰程度(T)作为解释变量, 蜘蛛物种丰富度和多度作为响应变量。采用向后剔除变量法进行分析, 利用F检验剔除对因变量无显著影响的自变量, 达到最终只包含显著变量, 而且变量间构成最优组合, 来确定主要因素, 分析利用SPSS 20.0软件完成[36]。
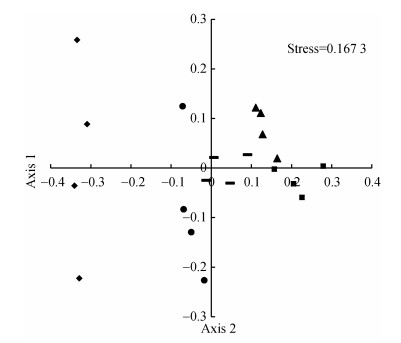
1.4.2 不同生境类型中蜘蛛群落结构性差异及环境影响采用非度量多维尺度分析(non-metric multi- dimensional scaling, NMDS), 并基于Chord度量方法, 对5种生境类型中蜘蛛群落结构进行分析, 采用胁强系数(stress)检验拟合效果。胁强系数 < 0.05时, 差异性很小; 0.05≤胁强系数 < 0.1时, 差异性较小; 0.1≤胁强系数 < 0.2时, 差异性在可接受范围内, 该分析在PAST 3.5软件中完成[35]。
环境因素对蜘蛛群落结构的影响采用冗余分析(redundancy analysis, RDA)进行。首先采用去趋势对应分析(detrended correspondence analysis, DCA)对蜘蛛群落进行排序分析, 蜘蛛的群落结构呈线性分布, 则选择RDA分析。选择草本层盖度(C)、人为干扰(T)、枯落物厚度(D)、植物群落结构(S)、植物丰富度(P)和土壤酸碱性(pH)作为解释变量, 利用Canoco 5完成[37]。
2 结果与分析 2.1 不同生境类型地表蜘蛛组成5种生境类型样地共采集蜘蛛标本3 626头, 隶属于19科59种。苹果-芍药套作园有27种1 327头, 绿海花廊有27种1 319头, 次生林地有32种591头, 核桃林有39种251头, 玉米地有23种138头。优势科为狼蛛科(Lycosidae)、蟹蛛科(Thomisidae)、平腹蛛科(Gnaphosidae), 分别占捕获总个体数的63.1%、12.0%、10.0%。优势种是星豹蛛(Pardosa astrigera)、鞍形花蟹蛛(Xysticus ephippiatus), 分别占总数的53.6%和11.5%。常见种14种, 其余43种均为稀少种(表 2)。
| 表 2 不同生境类型地表蜘蛛群落组成 Table 2 Composition of spiders communities at different habitats |
核桃林有5种优势种:唇形狼蛛(Lycosa labialis)个体数量占采集总量的18.7%、刺瓣拟隙蛛(Pireneitega spinivulva)占5.6%、齿单蛛(Haplodrassus dentatus)占5.9%、武昌狂蛛(Zelotes wuchangensis)占8.0%、阴沟瘤蛛(Ummeliata feminea)占5.2%;次生林有7种优势种:尘舞蛛(Alopecosa pulverulenta)占20.9%、湄潭熊蛛(Arctosa meitanensis)占10.3%、鞍形花蟹蛛(Xysticus ephippiatus)占13.0%、刺瓣拟隙蛛(Pireneitega spinivulva)占6.6%、锚近狂蛛(Drassyllus vinelis)占6.6%、河北雷文蛛(Raveniola hebeinica)占8.4%、日斯坦蛛(Stemmops nipponicus)占7.9%;玉米地有3种优势种:星豹蛛占39.1%、锚近狂蛛(Drassyllus vinealis)占8.7%、唇形狼蛛占6.5%;苹果-芍药套作园有1种优势种:星豹蛛占85.8%;绿海花廊中有2种优势种:星豹蛛占55.9%、鞍形花蟹蛛占20.6%。次生林的优势种最多, 核桃林次之, 苹果-芍药套作园地最少。
2.2 不同生境类型地表蜘蛛的多样性分布不同生境类型蜘蛛多样性的混合效应分析结果显示, 核桃林中蜘蛛Shannon-Wiener多样性显著高于其他生境类型, 次生林次之, 苹果-芍药套作园中蜘蛛的多样性显著低于其他4种类型生境(F=105.14, P < 0.001), 玉米地与绿海花廊之间无显著性差异(图 3A)。核桃林、次生林、绿海花廊三者之间蜘蛛丰富度无显著差异, 但均显著高于玉米地和苹果-芍药套作园; 玉米地的蜘蛛丰富度显著低于其他4种类型生玉米地和苹果-芍药套作园之间无显著差异(图 3B)。苹果-芍药套作园和绿海花廊维持着较高的蜘蛛多度, 二者之间无显著差异; 玉米地和核桃林中的蜘蛛多度显著低于其他3种样地(F=34.27, P < 0.001), 两者之间无显著差异(图 3C)。

|
图 3 不同类型生境中蜘蛛群落的多样性指数 Fig. 3 Spider community diversity indexes in different habitats Ⅰ:核桃林; Ⅱ:玉米地; Ⅲ:苹果-芍药套作园; Ⅳ:次生林; Ⅴ:绿海花廊。不同小写字母表示不同生境间差异显著(P < 0.001)。Ⅰ: walnut grove; Ⅱ: maize field; Ⅲ: apple-peony intercropping orchard; Ⅳ: secondary forest; Ⅴ: flower belt. Different lowercase letters indicate significant differences among habitats (P < 0.001). |
蜘蛛丰富度的多元回归模型显示(表 3), 植物群落结构和人为干扰程度是影响蜘蛛物种丰富度最主要的生境因子, 植物群落结构相比人为干扰程度更为显著(PS < 0.001, PT=0.006), 蜘蛛的丰富度随着干扰程度的增加而减少, 随着植物群落结构的复杂而增加。蜘蛛多度的多元回归模型显示(表 3), 植物群落结构(PS < 0.001)、人为干扰程度(PT < 0.001)和地表枯落物(PD < 0.001)都是影响蜘蛛多度的主要生境因子, 蜘蛛的多度随着干扰程度和植物群落结构的增加而减少, 随着地表枯落物的增加而增加。
| 表 3 各个生境因素与蜘蛛群落的丰富度和多度的相关性分析 Table 3 Correlation of habitat factors with richness and abundance of spider community |
如图 4所示, 核桃林的投影与其他生境相距较远, 说明核桃林的蜘蛛群落结构与其他生境的差异较大。次生林和核桃林的各自样点间投影高度分散, 样地内蜘蛛群落异质性较高。玉米地、绿海花廊、苹果-芍药套作园的样点的投影相距比较聚集, 说明这3种类型生境中蜘蛛群落异质性较低, 蜘蛛群落结构也较为相似。
|
图 4 基于Chord指数的不同生境蜘蛛群落非度量多维度分析 Fig. 4 Non-linear multi-dimensional scaling (NMDS) based on Chord measure for spider communities in different habitats ◆:核桃林; ▬:玉米地; ■:苹果-芍药套作园; ●:次生林; ▲:绿海花廊。◆: walnut grove; ▬: maize field; ■: apple-peony intercropping orchard; ●: secondary forest; ▲: flower belt. |
Monte Carlo检验显示地表枯落物厚度(D)、植物群落结构(S)、人为干扰程度(T)、植物丰富度(P)和草本覆盖度(C)对蜘蛛群落组成影响达显著水平, 5个变量共解释蜘蛛物种变异的78.2%, 其中地表枯落物是主要的影响因子, 解释率高达41.1%(表 4)。
| 表 4 基于RDA蒙卡洛检验的环境因子对蜘蛛群落组成的影响 Table 4 Analysis of effects of environmental factors on spider community composition based on Monte Carlo significance test of the RDA models |
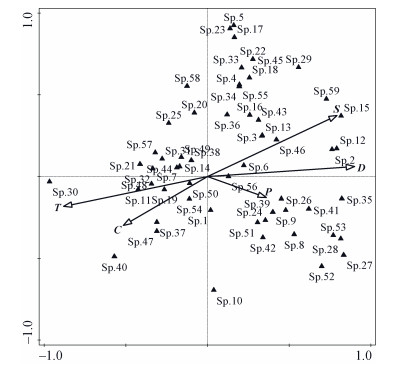
RDA排序图显示(图 5), 前两轴特征根值和为0.650, 占前4轴总特征根值的85.0%, 反映了主要的排序信息。蜘蛛群落与环境梯度两个排序轴的相关性分别为0.984和0.989, 前两排序轴物种环境的相关系数很高, 对物种与环境关系的累计贡献率达64.9%, RDA排序图第1轴物种与环境的累计贡献率达49.4%, 第2轴累计贡献率仅有15.5%。
|
图 5 蜘蛛群落组成与环境因子的RDA排序图 Fig. 5 RDA ordination plot of environmental factors and spider community composition |
人为干扰程度(T)在第1轴的负得分较高, 与草本盖度(C)呈正相关。植物群落结构(S)和地表枯落物厚度(D)呈正相关, 且在第1轴正得分较高, 与人为干扰程度(T)和草本盖度(C)呈负相关。优势种:星豹蛛(Sp.30)与人为干扰程度(T)呈正相关, 但与地表枯落物(D)呈负相关; 鞍形花蟹蛛(Sp.56)则与人为干扰程度(T)呈负相关, 与枯落物厚度(D)呈正相关。日本管蛛(Sp.59)和小狂蛛(Sp.15)与植物群落结构(S)呈正相关, 小狼逍遥蛛(Sp.40)、塔克额角蛛(Sp.21)和黑微蛛(Sp.20)与草本盖度(C)呈正相关, 尘舞蛛(Sp.27)、湄潭熊蛛(Sp.28)与植物丰富度(P)呈正相关(Sp.对照表 2)。
3 讨论 3.1 不同类型生境蜘蛛的Alpha多样性分布及影响因素5种生境中, 核桃林的蜘蛛Shannon-Wiener多样性和丰富度都是最高, 次生林次之, 造成这个结果可能的原因有:从景观格局来看, 核桃林和次生林同样都在保护区范围内, 连通度高, 核桃林又恰好处于保护区与保护区外一个过渡带, 属于两种生态系统的交互地段, 产生了边缘效应, 可以为蜘蛛提供更加丰富的资源[38-40]; 从生境尺度上, 核桃林和次生林较玉米地和苹果-芍药套作园有更加复杂的植被群落结构和更厚的地表枯落物覆盖, 可以为蜘蛛提供更为适宜的栖息环境和遮蔽场所[12-13]。本研究中回归分析结果同样证明了蜘蛛的物种丰富度随植被群落结构复杂程度的增加而增加。玉米地的Shannon-Wiener多样性高于苹果-芍药套作园, 是因为玉米地距离保护区近, 保护区内的蜘蛛可能会在玉米的三叶期—拔节期期间迁移到玉米地寻找食物源, 如利氏舞蛛、底栖小类球蛛、膨花蟹蛛、齿螯蛛属等稀少种仅5月20日—6月6日在保护区内的核桃林与玉米地中发现。苹果-芍药套作园内的蜘蛛多度较高, 是因为其地面裸露有利于狼蛛生存, 大量的狼蛛导致多度较高, 丰富度较低是因为套作芍药虽增加了空间复杂度, 但人为管理较多导致内部生境单一, 其所提供的食物源也相对单一, 相对于人为干扰较小且内部生境较为复杂的核桃林这类半自然生境, 不利于较多种类蜘蛛的生存。玉米地的丰富度低于苹果-芍药套作园, 是因为苹果-芍药套作园植物群落结构高于玉米地, 苹果-芍药套作园和绿海花廊的多度无显著差异, 但显著高于其他3种生境, 是因为这两类样地有较高的草本盖度并且都间作果树, 可能拥有较丰富的节肢动物能为蜘蛛提供足量的食源, 从而吸引了星豹蛛这种具有强掠食性的蜘蛛进入到农田, 促进了蜘蛛多度的提升[41]。所以绿海花廊间作板栗和苹果-芍药套作园这类农林复合系统, 有利于吸引更多种类和更多数量的害虫天敌进行生物防治, 也有利于当地生态系统的稳定[22, 25, 42]。
从区域尺度分析, 城市化进程使一定比例的耕地变为绿海花廊和改玉米种植芍药都增加了景观的异质性, 有助于减少传统农业对蜘蛛造成的负面影响, 保护蜘蛛的多样性, 这与段美春[43]和Pfister等[44]研究结论一致。
3.2 不同类型生境的蜘蛛群落结构差异NMDS分析显示, 次生林和核桃林的蜘蛛群落异质性较大, 因两者均是人为干扰弱的自然半自然生境, 复杂的生境可以为一些特有物种提供生存环境, 从而使各个复杂生境之间的异质性变大, Beta多样性更高[45-46]。玉米地、绿海花廊和苹果-芍药套作园蜘蛛群落结构组成较为相似, 群落异质性较小, 是因为三者都是有人为管理的农业生境, 植物群落结构相对于自然半自然生境较为单一, Beta多样性低。另一方面优势种星豹蛛(共调查到1 942头)仅在核桃林出现12头, 其余都在3种人为管理较强的农业生境中, 并且占绝对优势, 小狼逍遥蛛也几乎仅在这3种生境出现。
有学者认为人工林的生物多样性会低于植物丰富且结构复杂的自然林地, 因为人工林物种单一、结构简单很难维持高的生物多样性[47-48]; 也有观点认为种植人工林是未来景观建设的必然趋势, 是自然林地的补充, 为生物多样性保护做出了重要贡献[49-50]。本试验中核桃林和次生林的蜘蛛群落结构显著不同, 核桃林的Shannon-Wiener多样性指数和丰富度都高于相对自然的次生林, 所以核桃林作为人工林在当地是对自然林补充, 我们的结论更倾向于后者。但是次生林中蜘蛛的优势种和总多度都高于核桃林, 核桃林中的稀少种多说明次生林的蜘蛛群落结构更稳定, 如晨舞蛛、湄潭熊蛛、河北文雷蛛和日斯坦蛛在核桃地仅出现1~3头, 但在次生林中都存在47~124头。
3.3 蜘蛛群落组成的影响因素不同的生境因子影响着不同的生物类群[51]。本研究RDA分析显示, 地表枯落物、植物群落结构、干扰程度、植物丰富度和草本覆盖度对蜘蛛群落分布有显著影响, 其中地表枯落物是最主要影响因子。这可能是因为陷阱法主要采集的是地表游猎蜘蛛, 地表枯落物可以为游猎蜘蛛提供栖息地和避难所。本研究结果发现优势种星豹蛛(狼蛛科)与枯落物厚度呈负相关, 但与人为干扰有显著正相关性。这可能是因为狼蛛善于奔跑, 它的猎食行为倾向于地面比较裸露的苹果-芍药套作园[52-54]; 另外, 果园管理中小剂量农药也可以提高狼蛛科蜘蛛活力[55]。鞍形花蟹蛛与植物群落结构和枯落物厚度呈正相关, 鞍形花蟹蛛善于在灌木丛中游猎, 又常在石缝和枯枝落叶下隐藏。虽然星豹蛛与植物空间结构和枯落物厚度呈负相关, 但增加植物群落结构和地表枯落物有利于鞍形花蟹蛛、日本管蛛和小狼逍遥蛛这类善于在灌木丛中捕食的蜘蛛类群。
4 结论生境类型是影响蜘蛛多样性和群落结构的主要因素, 生境因子对不同蜘蛛群落影响不同, 从而导致不同的类型生境对蜘蛛多样性保护功能也存在差异。在山区农业景观中, 种植人工林是对当地自然林的有益补充, 有利于当地生物多样性的恢复和保护; 农田退耕改种绿海花廊和苹果-芍药套作园的景观提升实施方案, 增加了蜘蛛的丰富度和多度, 对生物防治和生物多样性的保护有积极作用。因此, 未来要在保护地过渡带适当创造多样化的半自然生境, 如种植人工林和野花带, 开发农林复合系统, 如农田适当种植开花类中药或多种作物间作套种, 既有助于提升山区农业景观和多种生态服务功能, 又能促进生产、生态和景观综合效益的发挥。
| [1] |
NORRIS K. Agriculture and biodiversity conservation:Opportunity knocks[J]. Conservation Letters, 2008, 1(1): 2-11. |
| [2] |
贺达汉. 农业景观与害虫种群控制[J]. 植物保护, 2009, 35(3): 12-15. HE D H. Landscape structure and control of insect pests in agroecosystems[J]. Plant Protection, 2009, 35(3): 12-15. |
| [3] |
TILMAN D. Global environmental impacts of agricultural expansion:The need for sustainable and efficient practices[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(11): 5995-6000. DOI:10.1073/pnas.96.11.5995 |
| [4] |
FAHRIG L. Effects of habitat fragmentation on biodiversity[J]. Annual Review of Ecology, Evolution, and Systematics, 2003, 34: 487-515. DOI:10.1146/annurev.ecolsys.34.011802.132419 |
| [5] |
刘云慧, 李良涛, 宇振荣. 农业生物多样性保护的景观规划途径[J]. 应用生态学报, 2008, 19(11): 2538-2543. LIU Y H, LI L T, YU Z R. Landscape planning approaches for biodiversity conservation in agriculture[J]. Chinese Journal of Applied Ecology, 2008, 19(11): 2538-2543. |
| [6] |
段美春, 刘云慧, 张鑫, 等. 以病虫害控制为中心的农业生态景观建设[J]. 中国生态农业学报, 2012, 20(7): 825-831. DUAN M C, LIU Y H, ZHANG X, et al. Agricultural disease and insect-pest control via agro-ecological landscape construction[J]. Chinese Journal of Eco-Agriculture, 2012, 20(7): 825-831. |
| [7] |
SUTTER L, ALBRECHT M, JEANNERET P. Landscape greening and local creation of wildflower strips and hedgerows promote multiple ecosystem services[J]. Journal of Applied Ecology, 2018, 55(2): 612-620. DOI:10.1111/1365-2664.12977 |
| [8] |
BOLLER JR P F. Presidential Campaigns From George Washington To George W. Bush[M]. Oxford: Oxford University Press, 2004.
|
| [9] |
ZHAO Z H, REDDY G V P, HUI C, et al. Approaches and mechanisms for ecologically based pest management across multiple scales[J]. Agriculture, Ecosystems & Environment, 2016, 230: 199-209. |
| [10] |
赵紫华. 从害虫"综合治理"到"生态调控"[J]. 科学通报, 2016, 61(18): 2027-2034. ZHAO Z H. From "Integrated pest management" to "Ecologically based pest management"[J]. Chinese Science Bulletin, 2016, 61(18): 2027-2034. |
| [11] |
李良涛, 刘文平, 肖禾, 等. 农业景观中植物篱的建设与管理[J]. 中国水土保持, 2012(6): 26-29. LI L T, LIU W P, XIAO H, et al. Construction and management of hedgerows in agricultural landscape[J]. Soil and Water Conservation in China, 2012(6): 26-29. |
| [12] |
WOLF S, ROMEIS J, COLLATZ J. Utilization of plant-derived food sources from annual flower strips by the invasive harlequin ladybird Harmonia axyridis[J]. Biological Control, 2018, 122: 118-126. DOI:10.1016/j.biocontrol.2018.04.008 |
| [13] |
HATT S, MOUCHON P, LOPES T, et al. Effects of wildflower strips and an adjacent forest on aphids and their natural enemies in a pea field[J]. Insects, 2017, 8(3): 99. DOI:10.3390/insects8030099 |
| [14] |
KLEIN A M, VAISSIERE B E, CANE J H, et al. Importance of pollinators in changing landscapes for world crops[J]. Proceedings of the Royal Society B:Biological Sciences, 2006, 274(1608): 303-313. |
| [15] |
CLOUGH Y, KRUESS A, KLEIJN D, et al. Spider diversity in cereal fields:Comparing factors at local, landscape and regional scales[J]. Journal of Biogeography, 2005, 32(11): 2007-2014. DOI:10.1111/j.1365-2699.2005.01367.x |
| [16] |
MARSHALL E J P, MOONEN A C. Field margins in northern Europe:Their functions and interactions with agriculture[J]. Agriculture, Ecosystems & Environment, 2002, 89(1/2): 5-21. |
| [17] |
张旭珠, 常虹, 张鑫, 等. 农业景观步甲多样性时间格局及其与景观结构的关系[J]. 生态学杂志, 2012, 31(12): 3127-3132. ZHANG X Z, CHANG H, ZHANG X, et al. Temporal patterns of carabid beetle diversity in agro-landscape in relation to landscape structure[J]. Chinese Journal of Ecology, 2012, 31(12): 3127-3132. |
| [18] |
NG K, BARTON P S, MACFADYEN S, et al. Beetle's responses to edges in fragmented landscapes are driven by adjacent farmland use, season and cross-habitat movement[J]. Landscape Ecology, 2018, 33(1): 109-125. DOI:10.1007/s10980-017-0587-7 |
| [19] |
ÁVILA A C, STENERT C, RODRIGUES E N L, et al. Habitat structure determines spider diversity in highland ponds[J]. Ecological Research, 2017, 32(3): 359-367. DOI:10.1007/s11284-017-1442-7 |
| [20] |
TSCHARNTKE T, KLEIN A M, KRUESS A, et al. Landscape perspectives on agricultural intensification and biodiversity-ecosystem service management[J]. Ecology Letters, 2005, 8(8): 857-874. DOI:10.1111/j.1461-0248.2005.00782.x |
| [21] |
SAMU F, SUNDERLAND K D, TOPPING C J, et al. A spider population in flux:Selection and abandonment of artificial web-sites and the importance of intraspecific interactions in Lephthyphantes tenuis (Araneae:Linyphiidae) in wheat[J]. Oecologia, 1996, 106(2): 228-239. DOI:10.1007/BF00328603 |
| [22] |
郑国, 杨效东, 李枢强. 西双版纳地区六种林型地表蜘蛛多样性比较研究[J]. 昆虫学报, 2009, 52(8): 875-884. ZHENG G, YANG X D, LI S Q. Biodiversity of ground-dwelling spider in six forest types in Xishuangbanna, S.W. China[J]. Acta Entomologica Sinica, 2009, 52(8): 875-884. |
| [23] |
刘文惠, 胡懿君, 胡文超, 等. 苜蓿邻作麦田地表步甲和蜘蛛种群动态及其对苜蓿刈割的响应[J]. 应用生态学报, 2014, 25(9): 2677-2682. LIU W H, HU Y J, HU W C, et al. Population dynamics of ground carabid beetles and spiders in a wheat field along the wheat-alfalfa interface and their response to alfalfa mowing[J]. Chinese Journal of Applied Ecology, 2014, 25(9): 2677-2682. |
| [24] |
胡文超, 刘军和, 贺达汉. 苜蓿田地表蜘蛛边缘效应及苜蓿刈割后的溢出效应[J]. 植物保护学报, 2018, 45(4): 773-781. HU W C, LIU J H, HE D H. Edge effect of ground-dwelling spiders and spillover effect after alfalfa mowing in alfalfa fields of Yinchuan area[J]. Journal of Plant Protection, 2018, 45(4): 773-781. |
| [25] |
张旭珠, 韩印, 宇振荣, 等. 半自然农田边界与相邻农田步甲和蜘蛛的时空分布[J]. 应用生态学报, 2017, 28(6): 1879-1888. ZHANG X Z, HAN Y, YU Z R, et al. Spatio-temporal distribution of carabids and spiders between semi-natural field margin and the adjacent crop fields in agricultural landscape[J]. Chinese Journal of Applied Ecology, 2017, 28(6): 1879-1888. |
| [26] |
赵爽, 宋博, 丁圣彦, 等. 黄河下游农业景观中景观结构和生境特征对林表生蜘蛛多样性的影响[J]. 生态学报, 2017, 37(6): 1816-1825. ZHAO S, SONG B, DING S Y, et al. Effects of landscape structure and habitat characteristics on spider diversity in the agro-landscape along the lower reaches of the Yellow River[J]. Acta Ecologica Sinica, 2017, 37(6): 1816-1825. |
| [27] |
PÉREZ-GUERRERO S, GELAN-BEGNA A, VARGAS-OSUNA E. Impact of Cheiracanthium pelasgicum (Araneae:Miturgidae) and Chrysoperla carnea (Neuroptera:Chrysopidae) intraguild predation on the potential control of cotton pest Helicoverpa armigera (Lepidoptera:Noctuidae)[J]. Biocontrol Science and Technology, 2014, 24(2): 216-228. DOI:10.1080/09583157.2013.855167 |
| [28] |
NYFFELER M, SUNDERLAND K D. Composition, abundance and pest control potential of spider communities in agroecosystems:A comparison of European and US studies[J]. Agriculture, Ecosystems & Environment, 2003, 95(2/3): 579-612. |
| [29] |
WHITEHOUSE M E A, HARDWICK S, SCHOLZ B C G, et al. Evidence of a latitudinal gradient in spider diversity in Australian cotton[J]. Austral Ecology, 2009, 34(1): 10-23. |
| [30] |
SØMME L, BLOCK W. Adaptations to alpine and polar environments in insects and other terrestrial arthropods[M]//LEE R E, DENLINGER D L. Insects at Low Temperature. Boston, MA: Springer, 1991
|
| [31] |
宋大祥, 朱明生. 河北动物志:蜘蛛类[M]. 石家庄: 河北科学技术出版社, 2001. SONG D X, ZHU M S. The Spiders of Hebei[M]. Shijiazhuang: Hebei Science & Technology Press, 2001. |
| [32] |
朱明生, 张保石. 河南蜘蛛志:蛛形纲:蜘蛛目[M]. 北京: 科学出版社, 2011. ZHU M S, ZHANG B S. The Spiders of Henan[M]. Beijing: Science Press, 2011. |
| [33] |
SONG D X, ZHU M S, CHEN J. The Spiders of China[M]. Shijiazhuang: Hebei Science & Technology Press, 1999.
|
| [34] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000. BAO S D. Soil and Agricultural Chemistry Analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2000. |
| [35] |
HAMMER Ø, HARPER D A T, RYAN P D. PAST:Paleontological statistics software package for education and data analysis[J]. Palaeontologia Electronica, 2001, 4(1): 1-9. |
| [36] |
卢纹岱. SPSS统计分析[M]. 4版. 北京: 电子工业出版社, 2010. LU W D. SPSS Statistical Analysis[M]. 4th ed. Beijing: Publishing House of Electronics Industry, 2010. |
| [37] |
张金屯. 数量生态学[M]. 北京: 科学出版社, 2004. ZHANG J T. Quantitative Ecology[M]. Beijing: Science Press, 2004. |
| [38] |
INGRAO A J, SCHMIDT J, JUBENVILLE J, et al. Biocontrol on the edge:Field margin habitats in asparagus fields influence natural enemy-pest interactions[J]. Agriculture, Ecosystems & Environment, 2017, 243: 47-54. |
| [39] |
MAGURA T. Carabids and forest edge:Spatial pattern and edge effect[J]. Forest Ecology and Management, 2002, 157(1/3): 23-37. |
| [40] |
HOLLAND M M, RISSER P G. The role of landscape boundaries in the management and restoration of Changing environments: Introduction[M]//HOLLAND M M, RISSER P G, NAIMAN R J, et al. Ecotones. Boston, MA: Springer, 1991
|
| [41] |
STENCHLY K, CLOUGH Y, BUCHORI D, et al. Spider web guilds in cacao agroforestry-comparing tree, plot and landscape-scale management[J]. Diversity and Distributions, 2011, 17(4): 748-756. DOI:10.1111/j.1472-4642.2011.00774.x |
| [42] |
SUNDERLAND K, SAMU F. Effects of agricultural diversification on the abundance, distribution, and pest control potential of spiders:A review[J]. Entomologia Experimentalis et Applicata, 2000, 95(1): 1-13. DOI:10.1046/j.1570-7458.2000.00635.x |
| [43] |
段美春.农业景观的时空格局对植物和节肢动物多样性的影响研究[D].北京: 中国农业大学, 2016: 5-59 DUAN M C. The impact of spatial and temporal structure of agriculture landscape on plant and arthropod diversity[D]. Beijing: China Agricultural University, 2016: 5-59 http://cdmd.cnki.com.cn/Article/CDMD-10019-1017000844.htm |
| [44] |
PFISTER S C, SCHÄFER R B, SCHIRMEL J, et al. Effects of hedgerows and riparian margins on aerial web-building spiders in cereal fields[J]. Journal of Arachnology, 2015, 43(3): 400-405. DOI:10.1636/0161-8202-43.3.400 |
| [45] |
AAVIK T, LIIRA J. Quantifying the effect of organic farming, field boundary type and landscape structure on the vegetation of field boundaries[J]. Agriculture, Ecosystems & Environment, 2010, 135(3): 178-186. |
| [46] |
TSCHARNTKE T, TYLIANAKIS J M, RAND T A, et al. Landscape moderation of biodiversity patterns and processes-eight hypotheses[J]. Biological Reviews, 2012, 87(3): 661-685. DOI:10.1111/j.1469-185X.2011.00216.x |
| [47] |
FAHY O, GORMALLY M. A comparison of plant and carabid beetle communities in an Irish oak woodland with a nearby conifer plantation and clear felled site[J]. Forest Ecology and Management, 1998, 110(1/3): 263-273. |
| [48] |
SOUZA A F, RAMOS N P, PIZO M A, et al. Afforestation effects on vegetation structure and diversity of grasslands in southern Brazil:The first years[J]. Journal for Nature Conservation, 2013, 21(1): 56-62. DOI:10.1016/j.jnc.2012.10.002 |
| [49] |
LACHANCE D, LAVOIE C, DESROCHERS A. The impact of peatland afforestation on plant and bird diversity in southeastern Québec[J]. Écoscience, 2005, 12(2): 161-171. DOI:10.2980/i1195-6860-12-2-161.1 |
| [50] |
SANTOS T, TELLERÍA J L, DÍAZ M, et al. Evaluating the benefits of CAP reforms:Can afforestations restore bird diversity in Mediterranean Spain?[J]. Basic and Applied Ecology, 2006, 7(6): 483-495. DOI:10.1016/j.baae.2005.11.001 |
| [51] |
CARVALHEIRO L G, SEYMOUR C L, NICOLSON S W, et al. Creating patches of native flowers facilitates crop pollination in large agricultural fields:Mango as a case study[J]. Journal of Applied Ecology, 2012, 49(6): 1373-1383. DOI:10.1111/j.1365-2664.2012.02217.x |
| [52] |
OPATOVSKY I, LUBIN Y. Coping with abrupt decline in habitat quality:Effects of harvest on spider abundance and movement[J]. Acta Oecologica, 2012, 41: 14-19. DOI:10.1016/j.actao.2012.03.001 |
| [53] |
HADDAD N M, BRUDVIG L A, CLOBERT J, et al. Habitat fragmentation and its lasting impact on Earth's ecosystems[J]. Science Advances, 2015, 1(2): e1500052. DOI:10.1126/sciadv.1500052 |
| [54] |
ÖBERG S. Influence of landscape structure and farming practice on body condition and fecundity of wolf spiders[J]. Basic & Applied Ecology, 2009, 10(7): 614-621. |
| [55] |
王智, 颜亨梅, 王洪全. 低剂量农药对稻田蜘蛛控虫力的影响[J]. 生态学报, 2002, 22(3): 346-351. WANG Z, YAN H M, WANG H Q. The influence of low-dose pesticides on the insect-control power of paddy field spiders[J]. Acta Ecologica Sinica, 2002, 22(3): 346-351. |
 2020, Vol. 28
2020, Vol. 28



