2. 云南农业大学云南省药用植物生物学重点实验室 昆明 650201;
3. 云南农业大学农学与生物技术学院 昆明 650201
2. Key Laboratory of Medicinal Plant Biology, Yunnan Agricultural University, Kunming 650201, China;
3. College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China
在自然环境中, 植物会受到各种生物或非生物因子的刺激, 影响植株新陈代谢过程, 进而可能发生一系列形态、生理生化上的病理变化, 最终阻碍植物的正常生长发育。一般来说, 所有植物对生物因子侵染的反应大致相似。当病原物侵染植株后, 植物会通过降低光合作用、增强呼吸和蒸腾作用以及合成相关拮抗性酶类等策略来抵御病原物的侵入; 随着病原物与寄主植物相互作用的深入, 会使寄主组织内的细胞数目和体积发生变化以抵御病原物的进一步扩展; 病变加剧后, 植株最终会出现形态病变, 如变色、腐烂、萎蔫等症状[1]。
关于植物病害影响光合作用的研究表明, 植物病害的发生会导致罹病植株叶绿体结构受损, 叶绿素(Chl)含量降低, 光合有效面积减小, 进而引起光合速率显著下降[2-3]。车前草(Plantago ovata)感染霜霉病(Downy mildew)后, 叶片中会积累大量淀粉, 气孔被病原物阻塞, 气孔导度(Gs)下降, 从而使净光合速率(Pn)下降[4]。西葫芦(Cucurbita pepo)感染银叶病后, 叶绿体数目和CO2固定效率减小导致Pn下降[5]。这些研究表明, 病原菌抑制植物光合效率可能是由 Gs下降导致的, 但也有可能是非气孔限制因素所导致。另一方面, 叶绿素荧光参数也能在一定程度上体现病原侵染对植株光合作用的影响。受病原侵染的烟草(Nicotiana tabacum)和甜瓜(Cucumis melo)叶片暗适应下最大量子效率(Fv/Fm)和光合电子传递速率下降, 使光系统Ⅱ(PSⅡ)反应中心暂时失活或受到不可逆的伤害, 导致同化力(NADPH、ATP)的合成受阻, 进而影响暗反应阶段CO2的固定与同化[6-7]。因此, 研究病原侵染对植株光合生理活性的影响具有重要意义。
病原侵染和水分亏缺分别是植物在自然环境中最常遭受的生物与非生物胁迫, 同时, 植物病害和水分之间关系密切, 病害的发生时常伴随水分胁迫[8]。番茄(Lycopersicon esculentum)、小麦(Triticum aestivum)在病原菌侵染后, 植株叶片因水分散失而萎蔫[9-10]。条锈菌(Puccinia striiformis)侵染小麦后使植株内部水分亏缺, 水分利用率显著降低, 光合效率也随之降低[11]。这些研究表明, 病原物侵染植物后, 往往使寄主植物缺水而影响植株的正常生长。此外, 崔振华[12]研究表明, 葡萄卷叶病(grapevine leafroll disease)和水分亏缺能显著降低葡萄(Vitis vinifera)叶片的Chl含量及其光合效率。也就是说, 现有的研究主要聚焦于病原侵染和水分亏缺之间的关系, 关于病原侵染引起植株水分亏缺的光合生理还鲜有报道, 而研究罹病植株的光合生理状况对于病害的早期防控具有重要意义。
三七(Panax notoginseng)为五加科(Araliaceae)人参属多年生宿根草本植物, 因其喜温暖阴湿的栽培环境而有利于病原菌的繁殖, 导致三七根腐病问题十分严重[13]。王朝梁等[14]研究发现, 温度决定根腐病害出现的时间和扩展的速度。官会林等[15]研究表明, 厌氧细菌、真菌和放线菌是三七根腐病的主要病原菌, 其中毁坏柱孢霉(Cylindrocarpon destructans)和三七黄腐病菌(Cylindrocarpon didynum)是三七根腐病的主要病原真菌[13]。罗文富等[16]认为, 三七根腐病是一种复合侵染病害, 主要是细菌和真菌混合致病。其中, 由假单胞杆菌(Pseudomon adaceae)引起的细菌性根腐病, 又被七农称为“绿臭”, 即急性青枯型根腐病, 表现为地上部叶片呈绿色但萎蔫下垂, 块根有大量脓菌, 该病主要发生于种苗移栽田, 2、3年生三七整个生长期都有可能发生[13, 16]。然而, 现有的研究大多集中在三七根腐病的病原菌和根腐病的发生规律上, 关于细菌性根腐病诱导的缺水对三七光合生理的研究尚鲜见报道。本研究通过盆栽试验, 以发生细菌性根腐病的2年生三七为试验材料, 分别对植株形态、器官含水量、叶绿素含量、光合气体交换参数及叶绿素荧光参数等进行分析, 阐明细菌性根腐病对三七光合生理的影响机制, 以期为三七病害生理学研究提供理论基础。
1 材料与方法 1.1 试验地概况试验设在云南农业大学后山教学农场(位于昆明市盘龙区, 25°08′N、102°45′E), 海拔1 966 m, 干湿季节分明, 属亚热带季风气候。种植土壤为未栽种过三七的红壤, 其土壤基本理化性状: pH 6.84, 有机质3.18 g·kg–1, 全氮0.17 g·kg–1, 全磷0.23 g·kg–1, 全钾0.24 g·kg–1, 速效磷11.04 mg·kg–1, 速效钾127.32 mg·kg–1。
1.2 试验材料及处理于2019年1月, 将健壮且长势一致的1年生三七种苗(购自文山苗乡三七股份有限公司), 用百菌清和福满双消毒后, 移栽在装有6 kg土的花盆中(花盆规格为口径32 cm、底径19 cm、高21 cm), 共种植40盆, 每盆3株。按正常生产水平15 kg·hm–2施肥, N:P2O5:K2O施用比例为1:1:2。
于2019年7月, 三七自然发病时, 选取症状一致的三七植株为研究材料。试验设2个处理, 参考相关研究[13], 选取土壤水分适宜(土壤水分60%左右)、地上部叶片呈绿色并萎蔫下垂及具有细菌性根腐病特征的三七, 作为发病植株(Diseased plants, DP); 选取土壤水分适宜(土壤水分60%左右), 无病害的正常三七, 作为健康对照植株(Healthy plants, CK), 如图 1A所示。此次试验中所选植株的长势和叶片数一致。试验统计重复数为7(n=7)。
1.3 植株形态和各器官含水量测量于2019年7月18日, 利用直尺(精确度为0.1 cm)测量株高; 摘下叶片, 使用Li-3000C叶面积仪(Li-Cor, USA)对叶长、叶宽、叶面积等参数进行采集; 整株挖起三七后, 分别称取根、茎、叶的鲜质量, 之后将各部分放于70 ℃烘箱烘至恒重, 计算植株的各器官含水量[17]。试验统计重复数为7(n=7)。
| $ {\text{含水量}} = ({\text{鲜质量}} - {\text{干质量}})/{\text{鲜质量}} \times 100\% $ | (1) |
7月18日, 将不同处理的三七功能叶经主脉与边缘之间切取1~2 mm2的方形小块, 后用刀片在茎基部切取长0.3~0.5 cm的横切环, 参考James等[18]的方法对其进行石蜡切片的制作, 将制好的切片置于光学显微镜(DM2500)下观测, 并测量三七叶片的上表皮、下表皮、叶片、栅栏组织和海绵组织的厚度。试验统计重复数为7(n=7)。
1.5 叶绿素含量测定将1.4中所剩的三七功能叶洗净擦干后, 用丙酮:乙醇(1:1)浸提叶片后得到提取液, 利用分光光度计测定浸提液在663 nm和645 nm下的吸光值, 按照赵世杰等[19]的方法计算叶绿素a(mg·g–1)和叶绿素b(mg·g–1)含量, 叶绿素(mg·g–1)以叶绿素a和叶绿素b的总和表示。试验统计重复数为7(n=7)。
1.6 光合相关参数测定 1.6.1 气体交换参数测定于2019年7月10—18日的晴天上午8:30— 11:30, 使用Li-6400XT光合-荧光记录仪(Li-Cor, USA)对三七功能叶进行光合作用参数测定。测定时空气流速300 mL·min–1, 温度25 ℃, 相对湿度(50±5)%。
1) 光响应曲线测定。设定CO2浓度为400 μmol(CO2)·mol–1, 夹上叶片后在500 μmol(photons)·m-2·s-1光强下诱导约8 min, 数据稳定后启动自动测量程序, 光强梯度[μmol(photons)·m-2·s-1]设为: 500、300、200、150、100、80、60、40、20、10、0。每个光强下稳定约 3 min, 取Pn、Gs的参数值。根据Bassman等[20]的方法拟合光响应曲线方程, 计算得到潜在水分利用效率(WUEinst)、内禀水分利用效率(WUEi) [21]和表观叶肉导度(AMC):
| $ {\rm{WU}}{{\rm{E}}_{{\rm{inst}}}}{\rm{ = }}{\mathit{P}_{\rm{n}}}{\rm{/}}{\mathit{T}_{\rm{r}}} $ | (2) |
| $ {\rm{WU}}{{\rm{E}}_{\rm{i}}}{\rm{ = }}{\mathit{P}_{\rm{n}}}{\rm{/}}{\mathit{G}_{\rm{S}}} $ | (3) |
| $ {\rm{AMC = }}{\mathit{P}_{\rm{n}}}{\rm{/}}{\mathit{C}_{\rm{i}}} $ | (4) |
式中: Ci为胞间CO2浓度。AMC常用于估测1, 5-二磷酸核酮糖羧化酶(RuBP case)的活性[22]。
2) CO2响应曲线测定。将光照强度控制为500 μmol(photons)·m-2·s -1, 夹上叶片后于400 μmol(CO2)·mol–1浓度下稳定8 min, 数据稳定后启动自动测量程序, CO2浓度[μmol(CO2)·mol–1]依次为400、350、300、250、200、150、100、50、400、600、800和1 000, 每个浓度下稳定3 min后采集各参数值。以 Ci为横轴, Pn为纵轴, 绘制CO2响应曲线(Ci-Pn曲线), 根据Bassman等[20]的方法进行拟合。
1.6.2 PSⅡ和PSⅠ叶绿素荧光参数测定参考Zhang等[23]的方法, 用Dual-PAM-100 (Walz, Germany)对测完气体交换参数的三七功能叶进行叶绿素荧光的测量。
1) 凌晨荧光测定。于凌晨3:00, 采用Dual-PAM-100的“SP-Analysis”模式对荧光参数进行采集, 测量暗适应下PSⅡ最小荧光(Fo)、最大荧光(Fm)和PSⅠ反应中心P700最大荧光信号(Pm)。
2) 叶绿素荧光响应曲线测定。在“SP-Analysis”模式下, 设置光强[μmol(photons)·m-2·s -1]梯度为: 0、18、36、59、94、132、172、214、272、330、421、501和611, 同时记录光适应下PSⅡ最小荧光(Fo′)、最大荧光(Fm′)和PSⅠ反应中心P700最大荧光信号(Pm′)。参考Miyake等[24]和Huang等[25]的方法对荧光参数进行计算。
3) 快速叶绿素荧光诱导动力学曲线(O-J-I-P曲线)的测定。于凌晨3:00, “Fast Acquisition”模式下对PSⅡ叶绿素荧光进行测定。先用3 000 μmol·m–2·s–1的饱和光诱导叶片, 叶绿素荧光信号记录从10 ms开始, 至1 s结束。根据Strasser等[26]的方法对O-J-I-P曲线进行分析。
| $ {\mathit{W}_{\rm{k}}}{\rm{ = (}}{\mathit{F}_{\rm{k}}}{\rm{ - }}{\mathit{F}_{\rm{o}}}{\rm{)/(}}{\mathit{F}_{\rm{j}}}{\rm{ - }}{\mathit{F}_{\rm{o}}}{\rm{)}} $ | (5) |
| $ {\mathit{V}_{\rm{j}}}{\rm{ = (}}{\mathit{F}_{\rm{j}}}{\rm{ - }}{\mathit{F}_{\rm{o}}}{\rm{)/(}}{\mathit{F}_{\rm{m}}}{\rm{ - }}{\mathit{F}_{\rm{o}}}{\rm{)}} $ | (6) |
式中: Fo、Fk、Fj和Fm分别代表时间为20 μs、300 μs、2 ms和300 ms的荧光值, Wk为K相的相对可变荧光, Vj为可变荧光 Fj占 Fo-Fp振幅比例。
1.7 数据处理所测量的数据通过Excel 2010软件进行统计; 用统计分析软件SPSS 20.0进行配对T检验(Paired-Samples T test)及差异显著性分析, 所有参数均以平均值±标准差(n=7)表示, P≤0.05为差异显著; 用Sigmaplot 10.0软件作图。
2 结果与分析 2.1 根腐病对三七形态结构和器官含水量的影响在根腐病的侵染下, 三七的形态结构发生明显变化(图 1)。与CK相比, DP的叶片萎蔫下垂(图 1A); 茎的外部形态无明显差异(图 1A, 1B); DP根系表皮有破损, 主根变褐腐烂, 须根断损(图 1C, 1D); 此外, DP横截面显示韧皮部出现褐色斑点(图 1D)。这些结果表明假单胞杆菌侵染三七根系后, 导致三七根系受损严重, 叶片萎蔫下垂。

|
图 1 细菌性根腐病对三七植株形态的影响 Fig. 1 Effect of bacterial root rot on the morphology of Panax notoginseng A:正常植株(CK)和发病植株(DP)盆栽图; B: CK和DP的表型性状; C: CK和DP的根系形态性状; D: CK和DP的主根横截面。A: potted healthy plants (CK) and diseased plants (DP); B: plant phenotypic traits of CK and DP; C: root traits of CK and DP; D: cross sections of taproots of CK and DP. |
DP萎蔫下垂可能是由于叶片蒸腾失水而导致, 而植物器官的含水量是反映植物组织水分生理状况的重要指标。图 2表明, 根腐病影响三七各器官的含水量。DP植株的根、茎和叶含水量均显著低于CK(P≤0.05), 说明根腐病使得三七植株缺水。
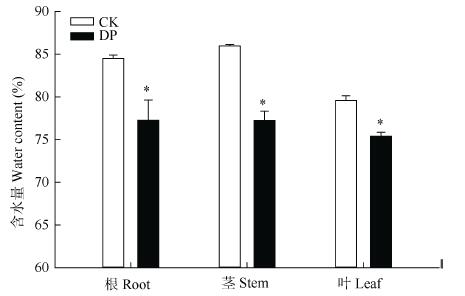
|
图 2 细菌性根腐病对三七器官含水量的影响 Fig. 2 Effect of bacterial root rot on water contents of Panax notoginseng organs CK:对照植株; DP:发病植株。*表示差异显著(P≤0.05)。CK: healthy plant; DP: diseased plant. * indicates significant difference between CK and DP (P≤0.05). |
缺水的DP和CK地上部的茎、叶外形差异不明显, 但解剖结构差异较大。如图 3所示, DP的株高和叶面积虽有减小, 但与CK相比并无显著性差异。茎基部的解剖结构表明, DP茎基部中空腐烂, 同时, CK的茎呈椭圆形, 而DP的茎明显内陷, 呈现不规则形状(图 4)。此外, 叶片组织解剖结构参数表明, 与CK相比, DP叶片上、下表皮和叶片厚度虽有所减少, 但没有差异; 栅栏组织厚度和海绵组织厚度与CK相比略有增加, 但无显著性差异(表 1)。总之, DP植株的茎因缺水而收缩, 茎基部内部腐烂中空, 而叶片未对胁迫做出响应。
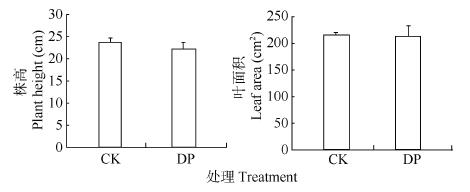
|
图 3 细菌性根腐病对三七株高和叶面积的影响 Fig. 3 Effects of bacterial root rot on plant height and leaf area of Panax notoginseng CK:对照植株; DP:发病植株。CK: healthy plant; DP: diseased plant. |
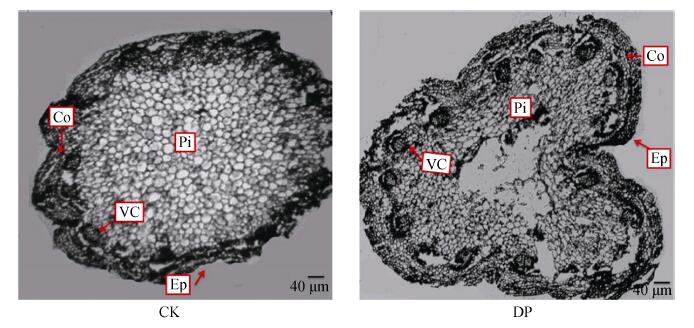
|
图 4 细菌性根腐病对三七茎基部显微结构的影响 Fig. 4 Effect of bacterial root rot on the anatomic structure of stem base of Panax notoginseng CK:对照植株; DP:发病植株; Ep:表皮; Co:皮层; VC:维管束; Pi:髓。CK: healthy plant; DP: diseased plant; Ep: epidermis; Co: cortex; VC: vascular bundle; Pi: pith. |
| 表 1 细菌性根腐病对三七叶片组织解剖结构参数的影响 Table 1 Effect of bacterial root rot on anatomic structure of leaf of Panax notoginseng |
植物叶片的叶绿素含量是反映其光合性能的重要指标。比较CK与DP叶片的叶绿素含量发现(图 5), CK叶片的叶绿素a和叶绿素含量显著高于DK(P≤0.05), 而叶绿素b含量及叶绿素a:叶绿素b值差异不显著。DP叶片叶绿素含量和叶绿素a含量较CK均下降26%, 表明DP导致叶片叶绿素降解, 进而造成光能吸收和捕获光能的能力下降。
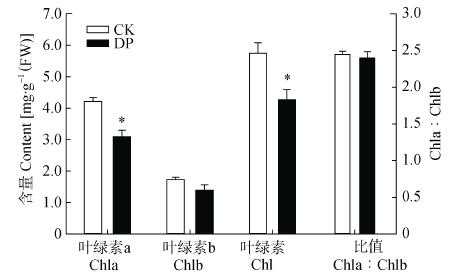
|
图 5 细菌性根腐病对三七叶片叶绿素含量的影响 Fig. 5 Effect of bacterial root rot on chlorophyll content in leaves of Panax notoginseng CK:对照植株; DP:发病植株。*表示差异显著(P≤0.05)。CK: healthy plant; DP: diseased plant. * indicates significant difference between CK and DP (P≤0.05). |
光合气体交换参数的变化可直接反映胁迫对植株的伤害程度。由图 6可知, CK和DP叶片的响应曲线表现出明显的差异。CK的Pn随着光照的增强, 先上升后趋于饱和; 而DP整体呈现为一个波动状态(图 6A), 不同光照强度下的Pn基本为负值。CK的Pn-Ci响应曲线(图 6B)呈正相关关系, Pn随着 Ci的升高而逐渐升高; 而DP的CO2响应曲线则呈负相关, Ci在450 μmol(CO2)·mol–1后, Pn均为负值, 说明DP叶片光合作用同化的CO2量小于呼吸作用释放的CO2量, 只进行呼吸作用。与CK相比, DP的Gs显著降低(图 6C)。这些结果表明, DP叶肉细胞的光合能力下降, 内部的胞间CO2浓度出现紊乱, 导致CO2过剩, 碳同化受到抑制。

|
图 6 细菌性根腐病对三七叶片气体交换参数的影响 Fig. 6 Effect of bacterial root rot on gas exchange parameters in leaves of Panax notoginseng CK:对照植株; DP:发病植株。CK: healthy plant; DP: diseased plant. |
由表 2可知, DP叶片WUEinst显著低于CK(P≤ 0.05), 且WUEi降低85%, 表明DP的水分利用效率低, 植株水分消耗过度。AMC常用于估测RuBP case的活性, 表中DP的AMC也显著低于CK(P≤0.05)。这些结果表明DP的RuBP case活性下降、水分代谢受抑, 降低了CO2同化率, 进而限制DP叶片的暗反应阶段。
| 表 2 细菌性根腐病对三七光合相关参数的影响 Table 2 Effect of bacterial root rot on photosynthetic related trait parameters in leaves of Panax notoginseng |
叶绿素荧光参数的变化常用于检测光合机构对环境胁迫的响应, 其中, Fm反映的是PSⅡ的电子传递情况; Fv/Fm主要反映植物叶片光合器官的生理状态, 在未受胁迫时, 一般在0.80左右, 受到胁迫后该值明显下降; Pm值是反映PSⅠ活性的一个指标, 可用于反映PSⅠ反应中心复合体的数量[6, 27]。由表 3可知, DP叶片PSⅡ活性受到抑制, 较CK相比下降7%, 而PSⅠ活性不受影响。DP的Pm、Fm受胁迫后虽有所下降, 但无显著性差异, 这表明DP叶片PSⅡ反应中心发生光抑制, 能量转换受到影响。
| 表 3 三七对照植株与发病植株的PSⅡ和PSⅠ活性变化 Table 3 Effect of bacterial root rot on PSⅡ and PSⅠactivities in leaves of Panax notoginseng |
一般来说, 叶绿体吸收的光能主要用于光合电子传递、热能耗散和以叶绿素荧光形式耗散过剩的光能, 三者间存在此消彼长的关系, 因此, 可通过解析相关荧光动力学参数的变化来阐明光能利用途径的信息[6]。
2.3.3.1 根腐病对光能分配的影响CK和DP叶片对光合电子传递的响应差异显著(图 7)(P≤0.05)。CK和DP的ETR随着光强的增高而升高, 172 μmol(photons)·m-2·s-1饱和之后ETR增长减缓, 其中, DP的ETR(Ⅱ)和ETR(Ⅰ)均下降70%左右。PSⅠ周围的CEF随着光照的增强被强烈激发, 但DP的CEF激发被抑制; CEF/ETR(Ⅱ)随PPFD逐步升高, DP显著高于CK(P≤0.05)。这些结果表明, DP抑制线性电子的传递(LEF), 激发CEF。
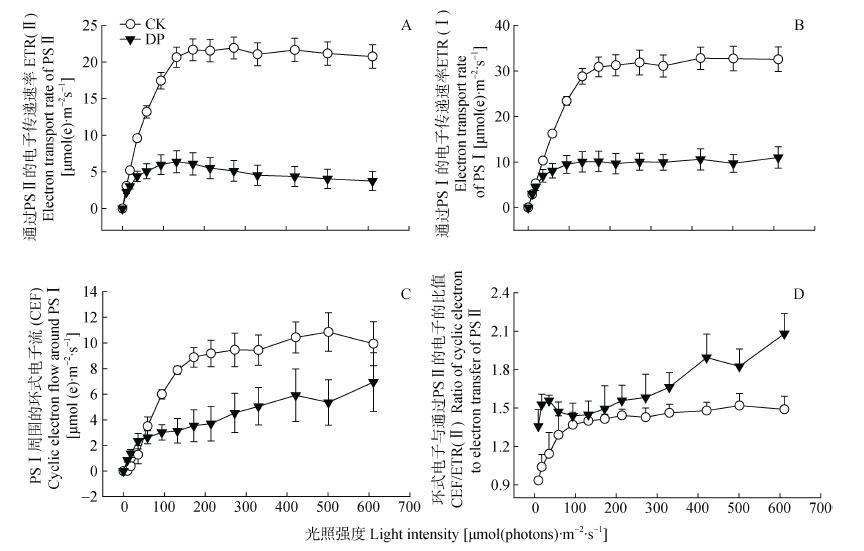
|
图 7 细菌性根腐病对三七叶片PSⅡ和PSⅠ光合电子传递的影响 Fig. 7 Effect of bacterial root rot on electron transport of PSⅡ and PSⅠ in 1eaves of Panax notoginseng CK:对照植株; DP:发病植株。CK: healthy plant; DP: diseased plant. |
Fv′/Fm′表示PSⅡ反应中心原初光能捕获效率; 1-qP反映的是PSⅡ反应中心的关闭程度。如图 8A、8B所示, DP的PSⅡ反应中心大量关闭, 光能捕获效率显著降低。叶绿素荧光猝灭分为光化学猝灭(qP)和非光化学猝灭(NPQ)两个过程, qP表示PSⅡ天线色素吸收的光能用于光化学电子传递的份额, NPQ反映PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的部分。由图 8C可知, 随着光强的增加, CK的qP逐渐减少, 而DP的qP值稳定在0.4左右; 图 8D中, DP在100 μmol(photons)·m-2·s-1光强后NPQ明显低于CK(P≤0.05), 表明DP的热耗散能力被抑制。

|
图 8 细菌性根腐病对三七叶片荧光猝灭动力学的影响 Fig. 8 Effect of bacterial root rot on fluorescence quenching kinetics in 1eaves of Panax notoginseng CK:对照植株; DP:发病植株。CK: healthy plant; DP: diseased plant. |
Y(Ⅱ)表示PSⅡ有效光化学量子产量, 是 Fv′/Fm′和 qP 共同作用的结果; Y(NPQ)反映叶片通过调节性的非光化学猝灭机制耗散为热能量份额的高低, 而Y(NO)与植物光损伤程度有关。三七染病后, DP植株叶绿体捕获的光能用于Y(Ⅱ)的能量减少(图 9A); 而用于 Y(NPQ)的能量在快速升高后缓慢上升并逐渐达到饱和(图 9B), Y(NO)也在缓慢上升并趋于稳定(图 9C)。由此表明, DP使叶片PSⅡ受到严重光损伤后进而通过维持较高的热耗散能力, 以保护和修复PSⅡ产生的光氧化损伤。
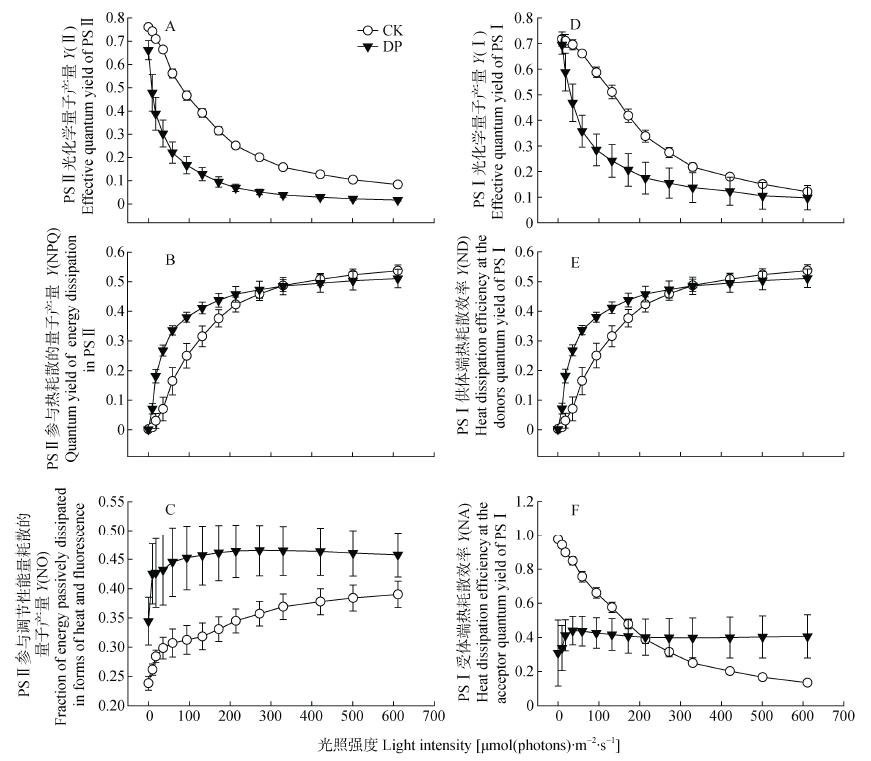
|
图 9 细菌性根腐病对三七叶片中光能分配的影响 Fig. 9 Effect of bacterial root rot on light energy distribution in leaves of Panax notoginseng CK:对照植株; DP:发病植株。CK: Healthy plant; DP: Diseased plant. |
Y(ND)为PSⅠ供体侧限制引起的非光化学量子产量, 也表示氧化态P700占全部P700的比例; Y(NA)表示PSⅠ受体侧限制引起的非光化学量子产量, 即不能被氧化的处于还原态的P700所占的比例[25]。如图 9D-F所示, DP与CK在PSⅠ能量分配上有明显的差异(P≤0.05)。DP叶片Y(Ⅰ)随着光照强度的降低而减小(图 9D); Y(ND)快速升高并提前饱和; 而Y(NA)维持在较低的水平, 但在200μmol(photons)·m-2·s-1后, Y(NA)趋于稳定且高于CK。这些参数表明, DP叶片Y(Ⅰ)降低是由于PSⅠ供体端电子被还原, 受体端受到限制引起的。
2.4 根腐病对快速叶绿素荧光动力学曲线(O-J-I-P曲线)的影响O-J-I-P曲线可提供有关PSⅡ的光化学信息, 能准确反映各类胁迫对光合机构的影响。Wk能反映PSⅡ供体侧放氧复合体(OEC)的状况, Wk越大, OEC受到的伤害越严重[27]。曲线上J相的变化常反映反应中心电子从QA传递到QB的能力大小。DP的快速叶绿素荧光曲线与CK相比, 差异显著(P≤0.05)。DP的OJIP曲线显著高于CK(P≤0.05)(图 10), 同时, DP的K点(300 μs)相对荧光与J点(2 ms)相对荧光的比例(Wk)也显著高于CK(P≤0.05)(图 11A), 增幅为 22%, 说明OEC受到损伤; J点相对可变荧光强度(Vj)上升48%(图 11B)。这些结果表明DP叶片PSⅡ的供体侧(Wk)和受体侧(Vj)均受到损伤[28]。
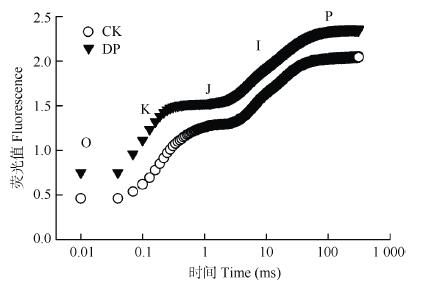
|
图 10 细菌性根腐病对三七叶片快速叶绿素荧光动力学曲线(O-K-J-I-P曲线)的影响 Fig. 10 Effect of bacterial root rot on chlorophyll fluorescence kinetics curve (O-K-J-I-P curve) in leaves of Panax notoginseng CK:对照植株; DP:发病植株。O、K、J、I和P分别代表时间为20 μs、300 μs、2 ms、30 ms和300 ms的荧光。O, K, J, I and P represent the fluorescence at time=20 μs, 300 μs, 2 ms, 30 ms, and 300 ms, respectively. CK: healthy plant; DP: diseased plant. |
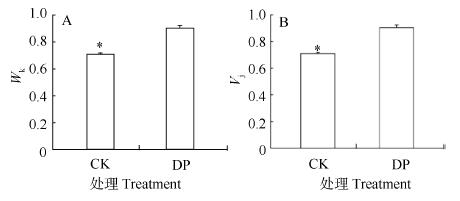
|
图 11 细菌性根腐病对三七叶绿素可变荧光Fk占Fo-Fj振幅的比例(Wk, A)与可变荧光Fj占Fo-Fp振幅比例(Vj, B)的影响 Fig. 11 Effects of bacterial root rot on ratio of variable fluorescence Fk to Fo-F j amplitude (Wk) and ratio of variable fluorescence Fj to Fo-Fp amplitude (Vj) *表示差异显著(P≤0.05)。* indicates significant difference be-tween CK and DP (P≤0.05). |
病原侵染导致植株内部组织结构发生变化, 进而使植物的外部和内部表现出病态[1]。受到根腐病胁迫的大豆(Glycine max), 根和茎变褐腐烂, 下部 叶片脉间变黄, 上部叶片褪绿, 严重时植株萎蔫死亡[29]。本研究中, DP主根腐烂, 须根断损, 韧皮部变褐(图 1), 说明假单胞杆菌侵染三七植株后, 三七根系受损, 根毛无法正常吸收水分, 导致植株内部水分供应不足。而DP的株高、叶片大小(图 3)和叶片解剖结构(表 1)与CK相比, 均无显著性差异, 这一结果与先前研究大豆根腐病会使地上部生长发育受抑、叶片组织结构发生变化的结论有所差异[29], 这是因为细菌性萎蔫发展快, 植株死亡也快, 对株高、叶片大小及解剖结构还未造成影响。但是, 细菌性根腐病会影响三七茎基部结构。本研究中, DP茎的内部结构显示植株茎秆内陷(图 4), 这与王晓森等[30]发现棉花(Gossypium hirsutum)在干旱胁迫下茎秆收缩的研究结果类似, 表明DP的茎因根系吸水无法满足蒸腾而产生失水收缩, 这可能与病原菌有关, 因为根腐病原菌从根部的伤口侵入至茎, 导致茎的导管变黑, 进而使水分运输受阻。这一结果与前人研究报道的细菌性根腐病会造成三七茎基部腐烂中空的结论一致[14]。因此, 根腐病对三七各器官的损伤程度为:根 > 茎 > 叶, 这种差异一方面与病原菌的侵染有关, 另一方面与植物吸收、运输水分过程有关。
3.2 细菌性根腐病诱导植株缺水植物组织含水量是反映植物水分状况的重要参数之一。孙冬梅等[31]研究发现, 小麦叶枯性病害使得小麦病叶水分运转受阻而缺水。本研究结果中, DP的根、茎和叶含水量均显著低于CK, 表明根腐病诱发三七各器官缺水(图 2)。另一方面, 水分利用效率(WUE)也可用于反映植物的水分状况。WUE是指水分产出与消耗的比率, 是农业生产中的重要指标[32]。在叶片中, 水分利用效率分为内禀水分利用效率(WUEi)和瞬时水分利用效率(WUEinst), 其中WUEinst用于评估环境因素对植物的影响, 但易受外界因素影响, 无法真实地反映作物本身的水分利用特性; 为剔除大气干湿条件的影响, WUEi被提出可用于估算不同物种或基因对植物水分利用特性的影响[21]。因此, 结合WUEi与WUEinst可更加全面地反映出根腐三七的水分利用效率情况。本研究中, DP的WUEi和WUEinst均显著低于CK(表 2), 排除土壤水分(土壤相对含水量60%左右)对三七的影响, 说明根腐三七因根系吸水受到限制, 进而影响植株内部的水分利用。由此说明, 根腐使得三七植株的根、茎和叶失水, 且抑制叶片的水分利用。
3.3 细菌性根腐病使三七光合能力下降植物光合能力与叶片叶绿素、Gs、Ci等因素密切相关。叶绿素是植物叶绿体中捕获光能的主要功能分子, 其含量的多少直接影响着植物吸收光能的量[33]。大量研究表明, 病原物侵染能引起植物叶片叶绿素降解, 本研究结果(图 5)与染病的烟草和大豆叶片的研究结果相同[29, 34], 表明假单胞杆菌侵染导致三七叶片光合色素含量降低, 有效光合面积减少, 从而抑制光合能力。一般来说, 植物受到胁迫时, 导致光合作用下降的因素包括气孔限制和非气孔限制[35]。如果Gs和 Ci同时下降, 说明气孔因素是引起 Pn下降的主要原因; 若是Gs下降, 而Ci上升, 则认为Pn下降主要是由非气孔因素引起[36]。前人研究表明, 烟草和空心莲子草(Alternanthera philoxeroides)在受到病原物侵染后, 叶绿体结构受到破坏, 非气孔限制阻碍了CO2的利用, 从而造成细胞间隙CO2积累, 导致Pn降低[34, 37]。在本研究中, DP的 Pn和 Ci呈负相关关系, Gs、AMC显著下降(图 6, 表 2), 表明Pn下降是由RuBP case活性下降导致CO2的同化率低, 造成细胞间隙CO2积累等非气孔因素引起的, 但与左应梅等[38]研究发现水分亏缺并不会影响三七叶片的光合作用的结果不同, 这可能与根腐病原菌侵染和水分亏缺双重胁迫有关, 因为三七受假单胞杆菌侵染后, 病菌孢子阻碍水分向上运输, 但叶片一直保持高蒸腾水平, 水分利用率大幅下降, 使得植株长时间处于缺水状态, 进而影响光合效率。总之, DP导致 Pn下降是由于叶片叶绿素降解、细胞间隙CO2积累以及叶片蒸腾失水等因素导致。
3.4 细菌性根腐病使三七PSⅡ受损光系统是植物光合机构对外界胁迫的敏感部位, 其中PSⅡ被认为是光抑制的原初位点, 在强光、低温、干旱、病害等胁迫下均会发生光抑制, 而PSⅠ一般是在低温强光条件下发生光抑制[6, 39]。Fv/Fm和 Pm下降是光合作用PSⅠ和PSⅡ发生光抑制的显著特征[40]。大量研究发现, 病原物对两个光系统的影响并不是等同的, 病原侵染后主要作用于PSⅡ, 这在烟草和苹果(Malus domestica)等植物中均得到证实[41-42]。本研究中DP处理下Fv/Fm降低, Pm值保持稳定(表 3), 由此说明相同光照下DP的PSⅡ易发生光抑制, 而PSⅠ对病害不敏感。
为减少光抑制造成的伤害, 植物形成了一系列光保护机制, 而增强光能的耗散被认为是保护PSⅡ免受病害胁迫的重要机制之一, 这在病原菌侵染后的烟草和蚕豆(Vicica faba)等植物中均得到证实[43-44]。本研究中, DP表现出较低的ETR(Ⅱ)、Y(Ⅱ)和NPQ, 较高的Y(NO)和Y(NPQ)(图 7-9), 说明叶片失水后LEF受到抑制, 由电子传递产生的跨类囊体膜质子梯度也受到影响, 从而使依赖于跨类囊体膜质子梯度激发的NPQ也降低, 导致叶片不能将过剩的光能以热或光化学形式耗散, 诱发PSⅡ光损伤[27]。PSⅡ的损伤首先发生在OEC, 而O-J-I-P曲线中K相的出现被作为衡量OEC损伤的指标[27]。核盘菌(Sclerotina sclerotiorum)侵染黄瓜(Cucumis sativus)后, K点出现、Wk值上升, 说明OEC活性被抑制[45], 本研究DP处理的结果与此相似, 不同的是DP的Vj(48%)升幅大于Wk(22%), 表明OEC受到损伤的同时, 还抑制PSⅡ供体侧和受体侧, 且受体侧损伤重于供体侧[28, 46]。总之, DP导致PSⅡ光损伤的主要原因是叶片PSⅡ供体侧的OEC活性被抑制, 受体侧的电子传递被阻碍。
围绕PSⅠ的CEF在保护光合机构方面有重要作用。由CEF介导的ATP可用于PSⅡ光损伤的修复[27]。但有研究表明, 病原物侵染会抑制PSⅡ的修复[47]。靶斑病菌(Bipolaris sorghicola)侵染高粱(Sorghum bicolor)叶片后, 活性氧被大量积累, D1蛋白的合成被抑制, 进而影响PSⅡ反应中心的修复[47]。本研究中, DP的光反应阶段被抑制, 导致光合碳同化能力低, 合成ATP少, PSⅡ损伤速率大于修复速率, 过量积累活性氧, 使PSⅡ受到不可逆损伤。另一方面, CEF的激发会降低PSⅠ受体端电子的积累, 减轻电子链过度还原而引起的氧化伤害[27, 39]。但本研究DP下Y(ND)、Y(NA)均升高(图 9), CEF减少(图 7), 说明CEF的激发被抑制, 导致PSⅠ受体端的电子过度积累, 进而引起PSⅠ反应中心铁硫蛋白的过度还原, 并产生超氧阴离子, 最终损伤PSⅠ。也就是说, 受病害胁迫的叶片会激活CEF, 但可能因活性氧和超氧阴离子在光系统处的大量积累, 使CEF无法发挥保护光合机构的作用, 最终导致三七无法进行光合作用。
3.5 三七细菌性根腐病的病程特征植物受病原物的感染, 一般经过生理病变和组织病变后, 最后才在外部出现有别于正常植株的形态病变[1]。结合其他作物病程特征[1, 29], 推测出三七细菌性根腐病的大致病程为:三七受假单胞杆菌侵染后, 细菌为争夺三七养分, 先破坏寄主植株养分输导系统, 改变代谢平衡及一些酶的活性, 进而抑制光合作用, 增强呼吸作用, 合成一系列拮抗性酶类和化学物质; 随着细菌的深入, 假单胞杆菌在三七体内获得生长发育所需要的营养和空间后, 在芦头与芽基结合处出现褐色水渍状病变, 阻塞导管, 地上部叶片的色素含量相应减少; 进一步病变, 主根变褐腐烂, 茎秆失水收缩, 叶片萎蔫下垂。病变加重后, 根系腐烂, 茎秆基部腐烂中空, 叶片干枯; 最后, 全株失水, 植株积累高含量的自由基, 细胞坏死, 植株枯萎死亡。
4 结论细菌性根腐病导致三七主根褐变腐烂, 须根断损, 茎基部腐烂中空, 茎秆失水收缩, 叶片蒸腾过度而萎蔫。同时, 根腐病诱导的缺水使三七叶片叶绿素降解, PSⅡ供体侧的OEC活性受损, 受体侧电子传递被抑制, 反应中心受到不可逆损伤, PSⅠ受体端电子过度还原, 进而导致叶肉细胞CO2的同化能力降低, 从而抑制细菌性根腐三七植株的光合速率。
然而, 细菌性根腐病不仅仅会导致植株缺水, 还可造成自由基毒性的积累、缺氧等胁迫, 但因缺水是造成植株死亡的直接原因, 因此, 本研究仅侧重于探讨根腐病诱导的缺水对三七植株光合生理特性的影响。此外, 本研究仅仅关注三七形态病变后的光合生理特性, 而细菌侵入后引起的一系列免疫反应(如活性氧积累和清除)还需进一步的研究讨论, 以期为三七病害生理学研究提供充实的理论依据。
| [1] |
谢联辉. 普通植物病理学[M]. 2版. 北京: 科学出版社, 2013: 14-18. XIE L H. General Plant Pathology[M]. Second edition. Beijing: Science Press, 2013: 14-18. |
| [2] |
FUNAYAMA S, SONOIKE K, TERASHIMA I. Photosynthetic properties of leaves of Eupatorium makinoi infected by a geminivirus[J]. Photosynthesis Research, 1997, 53(2): 253-261. |
| [3] |
ZHOU Y H, PENG Y H, LEI J L, et al. Effects of potato virus YNTN infection on gas exchange and photosystem 2 function in leaves of Solanum tuberosum L[J]. Photosynthetica, 2004, 42(3): 417-423. DOI:10.1023/B:PHOT.0000046161.16215.dd |
| [4] |
MANDAL K, SARAVANAN R, MAITI S, et al. Effect of downy mildew disease on photosynthesis and chlorophyll fluorescence in Plantago ovata Forsk[J]. Journal of Plant Diseases and Protection, 2009, 116(4): 164-168. DOI:10.1007/BF03356305 |
| [5] |
张战备, 张慧杰, 段国琪, 等. 西葫芦叶上遗传性银斑与银叶病病斑光合生理及解剖特征比较[J]. 中国生态农业学报, 2007, 15(6): 123-125. ZHANG Z B, ZHANG H J, DUAN G Q, et al. Comparison of photosynthetic physiological and anatomical features of gene and virus controlled silver-leaf mottling of summer squash[J]. Chinese Journal of Eco-Agriculture, 2007, 15(6): 123-125. |
| [6] |
杨志晓, 丁燕芳, 张小全, 等. 赤星病胁迫对不同抗性烟草品种光合作用和叶绿素荧光特性的影响[J]. 生态学报, 2015, 35(12): 4146-4154. YANG Z X, DING Y F, ZHANG X Q, et al. Impacts of Alternaria alternata stress on characteristics of photosynthesis and chlorophyll fluorescence in two tobacco cultivars with different resistances[J]. Acta Ecologica Sinica, 2015, 35(12): 4146-4154. |
| [7] |
柯思佳, 毕研飞, 任琴琴, 等. 蔓枯病菌侵染影响抗感甜瓜品种及杂种的光合特性分析[J]. 植物病理学报, 2019, 49(4): 465-473. KE S J, BI Y F, REN Q Q, et al. Analysis of photosynthetic characteristics of anti-allergic melon varieties and hybrids after inoculated with Didymella bryoniae[J]. Acta Phytopathologica Sinica, 2019, 49(4): 465-473. |
| [8] |
李玥仁, 商鸿生. 小麦条锈病罹病植株对水分胁迫的响应[J]. 植物生理学报, 2000, 26(5): 417-421. LI Y R, SHANG H S. Responses of wheat plants infected with stripe rust to water stress[J]. Acta Phytophysiologica Sinica, 2000, 26(5): 417-421. |
| [9] |
RISTAINO J B, DUNIWAY J M. Effect of preinoculation and postinoculation water-stress on the severity of Phytophthora root-rot in processing tomatoes[J]. Plant Disease, 1989, 73(4): 349-352. DOI:10.1094/PD-73-0349 |
| [10] |
冯汉青, 吴强, 李红玉, 等. 干旱与条锈病复合胁迫对小麦的生理影响[J]. 生态学报, 2006, 26(6): 1963-1974. FENG H Q, WU Q, LI H Y, et al. Combined effect of water stress and pathogen infection on wheat physiology[J]. Acta Ecologica Sinica, 2006, 26(6): 1963-1974. |
| [11] |
赵鸿, 王润元, 马鹏里, 等. 半干旱区春小麦受条锈菌侵染后光合作用和蒸腾作用的变化规律[J]. 干旱气象, 2004, 22(4): 56-59. ZHAO H, WANG R Y, MA P L, et al. Effect of stripe rust infection on photosynthesis and transpiration of wheat in the semi-arid region[J]. Arid Meteorology, 2004, 22(4): 56-59. |
| [12] |
崔振华.葡萄试管苗对葡萄卷叶病和PEG诱导的干旱胁迫的响应及耐病毒砧木评价的研究[D].杨凌: 西北农林科技大学, 2017 CUI Z H. Responses of in vitro grapevine plantlets to grapevine leafroll-associated virus infection and peg-induced drought stress, and preliminary evaluations of tolerance of grapevine rootstocks to grapevine leafroll disease[D]. Yangling: Northwest A & F University, 2017 |
| [13] |
缪作清, 李世东, 刘杏忠, 等. 三七根腐病病原研究[J]. 中国农业科学, 2006, 39(7): 1371-1378. LIAO Z Q, LI S D, LIU X Z, et al. The causal microorganisms of Panax notoginseng root rot disease[J]. Scientia Agricultura Sinica, 2006, 39(7): 1371-1378. |
| [14] |
王朝梁, 崔秀明, 李忠义, 等. 三七根腐病发生与环境条件关系的研究[J]. 中国中药杂志, 1998, 23(12): 714-716. WANG C L, CUI X M, LI Z Y, et al. Studies on relationship between root rot on Panax notoginseng Burk. F. H. Chen and its environmental conditions[J]. China Journal of Chinese Materia Medica, 1998, 23(12): 714-716. |
| [15] |
官会林, 杨建忠, 陈煜君, 等. 三七设施栽培根际微生物菌群变化及其与三七根腐病的相关性研究[J]. 土壤, 2010, 42(3): 378-384. GUAN H L, YANG J Z, CHEN Y J, et al. Change of rhizospheric microbe colony in cultivated soil and its correlation to root rot disease in Panax notoginseng[J]. Soils, 2010, 42(3): 378-384. |
| [16] |
罗文富, 喻盛甫, 黄琼, 等. 三七根腐病复合侵染中病原细菌的研究[J]. 云南农业大学学报, 1999, 14(2): 123-127. LUO W F, YU S F, HUANG Q, et al. Studies on pathogenic bacteria in complex infection of Panax notoginseng root rot[J]. Journal of Yunnan Agricultural University, 1999, 14(2): 123-127. |
| [17] |
刘筱, 王锐洁, 杨淑君, 等. 干旱胁迫对何首乌生长和叶绿素荧光参数的影响[J]. 河南农业科学, 2019, 48(1): 50-56. LIU X, WANG R J, YANG S J, et al. Effects of drought stress on growth and chlorophyll fluorescence parameters of Polygonum multiflorum[J]. Journal of Henan Agricultural Sciences, 2019, 48(1): 50-56. |
| [18] |
JAMES S A, BELL D T. Influence of light availability on leaf structure and growth of two Eucalyptus globulus ssp. globulus provenances[J]. Tree Physiology, 2000, 20(15): 1007-1018. DOI:10.1093/treephys/20.15.1007 |
| [19] |
赵世杰, 苍晶. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2016: 77-80. ZHAO S J, CANG J. Plant Physiology Experiment Guide[M]. Beijing: China Agriculture Press, 2016: 77-80. |
| [20] |
BASSMAN J B, ZWIER J C. Gas exchange characteristics of Populus trichocarpa, Populus deltoides and Populus trichocarpa×P. deltoids clone[J]. Tree Physiology, 1991, 8(2): 145-149. DOI:10.1093/treephys/8.2.145 |
| [21] |
赵福年, 杨红燕, 王润元, 等. 作物内禀水分利用效率变化[J]. 核农学报, 2019, 33(9): 1873-1881. ZHAO F N, YANG H Y, WANG R Y, et al. Variation of intrinsic water use efficiency for crop[J]. Journal of Nuclear Agricultural Sciences, 2019, 33(9): 1873-1881. |
| [22] |
刘晓龙, 徐晨, 徐克章, 等. 盐胁迫对水稻叶片光合作用和叶绿素荧光特性的影响[J]. 作物杂志, 2014(2): 88-92. LIU X L, XU C, XU K Z, et al. Effects on characteristics of photosynthesis and chlorophyll fluorescence of rice under salt stress[J]. Crops, 2014(2): 88-92. |
| [23] |
ZHANG S B, HUANG W, ZHANG J L, et al. Differential responses of photosystems Ⅰ and Ⅱ to seasonal drought in two Ficus species[J]. Acta Oecologica, 2016, 73: 53-60. DOI:10.1016/j.actao.2016.03.001 |
| [24] |
MIYAKE C, MIYATA M, SHINZAKI Y, et al. CO2 response of cyclic electron flow around PSI (CEF-PSⅠ) in tobacco leaves-relative electron fluxes through PSⅠ and PSⅡ determine the magnitude of non-photochemical quenching (NPQ) of chl fluorescence[J]. Plant and Cell Physiology, 2005, 46(4): 629-637. DOI:10.1093/pcp/pci067 |
| [25] |
HUANG W, YANG Y J, ZHANG S B, et al. Cyclic electron flow around photosystem Ⅰ promotes ATP synthesis possibly helping the rapid repair of photodamaged photosystem Ⅱ at low light[J]. Frontiers in Plant Science, 2018, 9: 239. DOI:10.3389/fpls.2018.00239 |
| [26] |
STRASSER R J, TSIMILLI-MICHAEL M, SRIVASTAVA A. Analysis of the chlorophyll a fluorescence transient[C]//GOVINDJEE P G. Chlorophyll a Fluorescence. Advances in Photosynthesis and Respiration. Dordrecht: Springer, 2004: 1-47
|
| [27] |
黄伟.环式电子传递在植物抗环境胁迫过程中的重要作用[D].合肥: 中国科学技术大学, 2012 HUANG W. The significant role of cyclic electron flow in plants' adaptation to environmental stresses[D]. Hefei: University of Science and Technology of China, 2012 |
| [28] |
李耕, 高辉远, 赵斌, 等. 灌浆期干旱胁迫对玉米叶片光系统活性的影响[J]. 作物学报, 2009, 35(10): 1916-1922. LI G, GAO H Y, ZHAO B, et al. Effects of drought stress on activity of photosystems in leaves of maize at grain filling stage[J]. Acta Agronomica Sinica, 2009, 35(10): 1916-1922. |
| [29] |
杨峰, 黄山, 武晓玲, 等. 根腐病胁迫对大豆光谱特征和叶绿素荧光特性的影响[J]. 大豆科学, 2013, 32(4): 490-495. YANG F, HUANG S, WU X L, et al. Effects of phytophthora root rot stress on canopy spectra reflectance and chlorophyll fluorescence characteristics of soybean[J]. Soybean Science, 2013, 32(4): 490-495. |
| [30] |
王晓森, 孟兆江, 段爱旺, 等. 充分灌溉和干旱胁迫对棉花茎直径变化的影响[J]. 灌溉排水学报, 2009, 28(5): 75-78. WANG X S, MENG Z J, DUAN A W, et al. Stem diameter variation subjected to full irrigation and drought stress in cotton[J]. Journal of Irrigation and Drainage, 2009, 28(5): 75-78. |
| [31] |
孙冬梅, 刘惕若, 杨凤军, 等. 小麦叶枯性病害生理学研究[J]. 黑龙江八一农垦大学学报, 1999, 11(4): 27-31. SUN D M, LIU T R, YANG F J, et al. The study on the disease physiology of wheat blight[J]. Journal of Heilongjiang August First Land Reclamation University, 1999, 11(4): 27-31. |
| [32] |
叶子飘, 段世华, 康华靖. 不同CO2浓度下大豆叶片的水分利用效率比较[J]. 核农学报, 2019, 33(5): 1006-1015. YE Z P, DUAN S H, KANG H J. Comparison of water use efficiency for Glycine max leaves under different CO2 concentration[J]. Journal of Nuclear Agricultural Sciences, 2019, 33(5): 1006-1015. |
| [33] |
LI X G, MENG Q W, JIANG G Q, et al. The susceptibility of cucumber and sweet pepper to chilling under low irradiance is related to energy dissipation and water-water cycle[J]. Photosynthetica, 2003, 41(2): 259-265. DOI:10.1023/B:PHOT.0000011959.30746.c0 |
| [34] |
郭兴启, 李向东, 朱汉城, 等. 马铃薯Y病毒(PVY)的侵染对烟草叶片光合作用的影响[J]. 植物病理学报, 2000, 30(1): 94-95. GUO X Q, LI X D, ZHU H C, et al. Effect of PVY-infection on photosynthesis of tobacco[J]. Acta Phytopathologica Sinica, 2000, 30(1): 94-95. |
| [35] |
许大全. 光合作用气孔限制分析中的一些问题[J]. 植物生理学通讯, 1997, 33(4): 241-244. XU D Q. Some problems in stomatal limitation analysis of photosynthesis[J]. Plant Physiology Communications, 1997, 33(4): 241-244. |
| [36] |
FARQUHAR G D, SHARKEY T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology, 1982, 33(1): 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
| [37] |
王连水, 张云霞, 黄江华, 等. Vuculic acid对空心莲子草叶片光合作用的影响[J]. 植物病理学报, 2012, 42(3): 319-322. WANG L S, ZHANG Y X, HUANG J H, et al. Effect of vuculic acid produced by Nimbya alternantherae on photosynthesis of alligatorweed leaf[J]. Acta Phytopathologica Sinica, 2012, 42(3): 319-322. |
| [38] |
左应梅, 杨维泽, 杨天梅, 等. 干旱胁迫下4种人参属植物抗性生理指标的比较[J]. 作物杂志, 2016(3): 84-88. ZUO Y M, YANG W Z, YANG T M, et al. Comparison of resistant physiological index among four species in the Genus Panax under water stress[J]. Crops, 2016(3): 84-88. |
| [39] |
薛娴, 许会敏, 吴鸿洋, 等. 植物光合作用循环电子传递的研究进展[J]. 植物生理学报, 2017, 53(2): 145-158. XUE X, XU H M, WU H Y, et al. Research progress of cyclic electron transport in plant photosynthesis[J]. Plant Physiology Journal, 2017, 53(2): 145-158. |
| [40] |
DEMMIG-ADAMS B, ADAMS Ⅲ W W. Photoprotection and other responses of plants to high light stress[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1992, 43(1): 599-626. DOI:10.1146/annurev.pp.43.060192.003123 |
| [41] |
王春梅, 施定基, 朱水芳, 等. 黄瓜花叶病毒对烟草叶片和叶绿体光合活性的影响[J]. 植物学报, 2000, 42(4): 388-392. WANG C M, SHI D J, ZHU S F, et al. Effects of cucumber mosaic virus infection on photosynthetic activities of tobacco leaves and chloroplasts[J]. Acta Botanica Sinica, 2000, 42(4): 388-392. |
| [42] |
杜国栋, 李爽, 刘志琨, 等. 苹果褐斑病菌侵染对苹果叶片光合机构功能的影响[J]. 植物生理学报, 2013, 49(9): 902-908. DU G D, LI S, LIU Z K, et al. Effects of apple brown spot pathogen infection on the function of photosynthetic apparatus in apple leaves[J]. Plant Physiology Journal, 2013, 49(9): 902-908. |
| [43] |
WILHELMOVÁ N, PROCHÁ ZKOVÁ D, ŠINDELÁ ŘOVÁ M, et al. Photosynthesis in leaves of Nicotiana tabacum L. infected with tobacco mosaic virus[J]. Photosynthetica, 2005, 43(4): 597-602. DOI:10.1007/s11099-005-0093-z |
| [44] |
李燕宏, 洪健, 谢礼, 等. 蚕豆萎蔫病毒2号分离物侵染对蚕豆叶片光合活性和叶绿体超微结构的影响[J]. 植物生理与分子生物学学报, 2006, 32(4): 490-496. LI Y H, HONG J, XIE L, et al. Effects of broad bean wilt virus 2 isolate infection on photosynthetic activities and chloroplast ultrastructure in broad bean leaves[J]. Journal of Plant Physiology and Molecular Biology, 2006, 32(4): 490-496. |
| [45] |
部建雯, 姚广, 高辉远, 等. 核盘菌(Sclerotinia sclerotiorum (Lib.) de Bary)侵染抑制黄瓜光合作用的机理[J]. 植物病理学报, 2009, 39(6): 613-621. BU J W, YAO G, GAO H Y, et al. Inhibition mechanism of photosynthesis in cucumber leaves infected by Sclerotinia sclerotiorum (Lib.) de Bary[J]. Acta Phytopathologica Sinica, 2009, 39(6): 613-621. |
| [46] |
王振兴, 陈丽, 艾军, 等. 不同干旱胁迫对山葡萄的光合作用和光系统Ⅱ活性的影响[J]. 植物生理学报, 2014, 50(8): 1171-1176. WANG Z X, CHEN L, AI J, et al. Effects of different drought stress on photosynthesis and activity of photosystem Ⅱ in leaves of amur grape (Vitis amurensis)[J]. Plant Physiology Journal, 2014, 50(8): 1171-1176. |
| [47] |
张园园, 徐秀德, 王振东, 等. 高粱靶斑病菌侵染对高粱光系统Ⅱ的影响[J]. 作物杂志, 2012(2): 42-46. ZHANG Y Y, XU X D, WANG Z D, et al. Effects of infection of Bipolaris sorghicola on PSⅡ of sorghum[J]. Crops, 2012(2): 42-46. |
 2020, Vol. 28
2020, Vol. 28



