丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是一种重要的农业有益微生物, 能与80%以上的陆生植物形成共生, 其孢子萌发在宿主植物根周围形成根外菌丝, 并侵染进入植物根中形成根内菌丝, 以及泡囊和丛枝等侵染结构, 独特的丛枝结构是宿主植物和AMF之间养分和碳交换的主要场所[1-2]。菌根共生系统能帮助宿主植物吸收土壤中的氮、磷、锌、镁和钾等养分, 尤其是磷, 从而提高植物在养分缺乏的环境中的生存能力。作为回报, 植物为AMF提供碳源, 保证其生长发育和生命周期的正常进行。已有的研究[1, 3-4]表明, 菌根主要是在低磷条件下促进作物生长和磷吸收:一方面通过菌根真菌的菌丝扩大根系对磷的吸收面积; 另一方面, 通过菌丝的分泌物如磷酸酶等活化土壤中的磷。AMF侵染的植物根系存在两条磷吸收途径:一条是直接吸收途径, 即植物的根系, 包括根毛, 通过根系诱导表达的磷转运蛋白直接从土壤中吸收磷; 另一条是间接的菌根吸收途径, 即通过共生的AMF的根外菌丝吸收外界的磷, 然后通过根外和根内菌丝转运磷到皮层细胞的丛枝, 在皮层细胞中, 植物菌根诱导表达的磷转运蛋白将丛枝中的磷转运给植物[5-6]。有研究表明, AMF侵染结构形成后, 植物根系直接吸收途径的磷转运蛋白基因的表达会受到抑制, 而菌根吸收途径的磷转运蛋白基因的表达则被显著上调[7], 因此, AMF侵染的植物主要通过菌根磷吸收途径从外界吸收磷养分, 而根系直接磷吸收途径在菌根植物中会部分关闭[1, 3]。
根系是植物从土壤中吸收水分和养分的主要器官。一方面, 菌根真菌的侵染会影响植物根系的形态构型。例如, 江夏等[8]的研究发现, AMF接种显著增加了番茄(Lycopersicon esculentum Mill.)植株的主根长, 而减少了1级侧根长, 同时, 显著降低了2~3级侧根数量。在甜橙[Citrus sinensis (L.) Osbeck]中, AMF接种增加了根系长度, 而根系的平均直径有所下降[9]; 在荔枝(Litchi chinensis Sonn.)中, AMF接种显著增加了侧根数量[10]。另一方面, 宿主植物的根系形态构型也会影响AMF的侵染。刘灵等[11]的研究发现, 低磷条件下, 深根型大豆[Glycine max (Linn.) Merr.]的菌根侵染率较高, 浅根型大豆的菌根侵染率较低。并且, 菌根侵染状况与宿主植物的磷效率也存在一定的关系。低磷条件下, 磷高效小麦(Triticum aestivum L.)对菌根依赖性较低, 而磷中效小麦对菌根依赖性较高[12]。然而, 不同磷效率基因型大豆对AMF接种的生长反应还少有报道。
大豆是我国重要的粮油作物。缺磷条件下AMF接种能显著促进大豆生长和磷吸收[13-16], 但不同磷效率大豆基因型对AMF接种的生长反应, 及其与菌根诱导的磷转运基因表达的关系还少有报道。本试验在低磷条件下, 以磷高效大豆BX10和磷低效大豆BD2为试验材料, 设置接种和不接种AMF两个接菌处理, 试图探究菌根真菌接种对两个大豆基因型生长, 以及菌根诱导的磷转运蛋白基因表达的影响, 及其与磷效率的关系, 以期为菌根真菌对植物磷吸收贡献的研究提供依据。
1 材料与方法 1.1 试验材料供试植物材料为磷高效大豆BX10和磷低效大豆BD2, 来自于华南农业大学根系生物学研究中心, 为本中心前期研究工作中筛选出来的磷效率不同的大豆基因型[17-18]。采用的AMF菌种为根内球囊霉(Rhizophagus irregularis), 编号DAOM 197198, 来自加拿大生物系统研究中心。试验所用土壤取自华南农业大学增城教学科研基地, 土壤基本理化性状参见文献[19]。栽培用石英砂从商业购买, 分为粗砂和中砂。营养液采用改良版大豆砂培1/2-Hoagland营养液, 并进行减磷减氮处理(2 500 μmol·L-1 N和50 μmol·L-1 P), 其他营养液具体配方如下(μmol·L-1): 250 K2SO4, 80 Fe-EDTA(Na), 4.50 MnCl2·4H2O, 0.30 ZnSO4·7H2O, 0.16 CuSO4·5H2O, 0.16 (NH4)6Mo7O24·4H2O, 20 H3BO3, 1 000 MgSO4·7H2O。
1.2 试验方法试验包括大豆基因型和接菌两个因素。其中, 大豆基因型为磷高效BX10和磷低效BD2两种; 接菌处理包括接种丛枝菌根真菌(AM)和不接种丛枝菌根真菌(NM)。试验共有4个处理, 每个处理设5个生物学重复。石英砂(粗砂:中砂=1:2)和土壤均经过两次121 ℃灭菌20 min(两次灭菌中间间隔12 h), 灭好的砂和土按4:1的比例混合均匀装入栽培用根箱。
大豆种子使用氯气灭菌法灭菌3 h, 每盆播3颗种子, 待种子出苗后保留长势一致的1株苗作为试验材料。AM处理接种约1 000个孢子, NM处理不接种孢子。试验期间, 每周浇一次50 μmol·L-1 KH2PO4的低磷1/2-Hoagland营养液, 其余时间浇实验用二级水保持砂土湿润。
1.3 收获与分析测定盆栽种植8周后收获, 地上部和根部分别取样并称重记录。将根系清洗干净, 通过根系扫描仪(Epson1460XL, 日本)扫描, 再用根系分析软件WinRHIZO (Regent Instruments Inc., 加拿大)分析根系性状, 包括总根长、根表面积和根直径。
根系扫描后随机取一部分根样, 剪成1 cm根段后, 加入10% KOH溶液, 于95 ℃水浴锅中水浴15 min, 使根系透明, 冷却至室温后, 用5%醋酸墨水染色液进行染色, 采取方格交叉划线法, 通过实体显微镜观察并记录根系的菌根侵染率和菌根侵染结构丰富度[19]。
取一部分根样用异丙醇沉淀法提取根部RNA, 在PCR仪(博日Life ECO基因扩增仪, 中国)中反转录, 得到的cDNA原液稀释20倍后, 使用实时荧光定量PCR仪(Applied Biosystems7500, 美国)进行基因表达量分析, 所测定的基因包括:菌根诱导表达的磷转运基因GmPT8、GmPT9和GmPT10, 引物见文献[14]; 以大豆看家基因EF-1a(序列号: X56856)作为内参基因, 使目标基因的表达水平归一化[16]。
地上部和根部样品于烘箱105 ℃杀青30 min, 75 ℃烘干至恒重, 称量干重。使用高速旋转磨样机和研钵磨碎样品, 用H2SO4-H2O2消煮得到待测液, 使用SKALAR San++流动分析仪(Skalar, 荷兰)测定植株中的磷含量和氮含量[15]。
菌根生长反应(mycorrhizal growth response, MGR)和菌根磷反应(mycorrhizal phosphorus response, MPR)分别根据下面公式计算[20]:
| ${\rm{MGR = 100}} \times \left( {{\rm{菌根植物干重 - 非菌根植物干重}}} \right)/{\rm{非菌根植物干重}} $ | (1) |
| ${\rm{MPR = 100}} \times \left( {{\rm{菌根植物磷含量 - 非菌根植物磷含量}}} \right)/{\rm{非菌根植物磷含量}} $ | (2) |
试验数据均采用Microsoft Excel 2010 (Microsoft Company, 美国)软件进行平均值和标准误计算, 用SAS统计分析软件(Version 8)进行双因素和单因素方差分析, 采用LSD法进行多重比较。
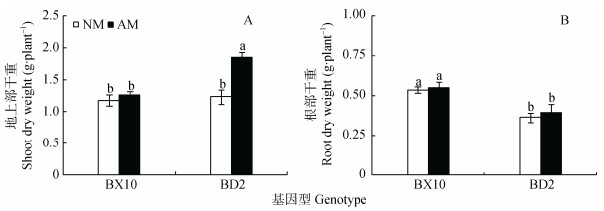
2 结果与分析 2.1 接种AMF对不同大豆基因型干重的影响由图 1可见, 不同接菌处理显著影响大豆地上部干重(P < 0.01), 但对大豆根部干重无显著影响; 大豆地上部和根部干重均存在显著基因型差异(P < 0.01和P < 0.001);同时, 地上部干重在不同接菌处理和不同基因型之间存在显著的交互作用(P < 0.01)。从不同接菌处理来看, 接种菌根真菌对BX10地上部干重没有显著影响; 但对BD2地上部干重影响显著, 与不接菌处理相比, 接菌处理的BD2地上部干重增加50%(图 1A)。而根部干重有所不同, 接种菌根真菌对BX10和BD2根部干重均无影响显著(图 1B)。从不同大豆基因型来看, 不接菌条件下, BX10和BD2地上部干重没有显著差异, 而接菌处理的BD2地上部干重比BX10高47%(图 1A)。而在不接菌和接菌条件下, BX10根部干重都比BD2高, 分别高46%和38%(图 1B)。
|
图 1 接种菌根真菌对不同大豆基因型干重的影响 Fig. 1 Effects of inoculation of arbuscular mycorrhizal fungi on plant dry weight of different soybean genotypes NM:不接菌处理; AM:接菌处理。不同字母表示差异达5%显著水平。NM: non-AMF inoculation; AM: AMF inoculation. Different lowercase letters indicate significant differences (P < 0.05). |
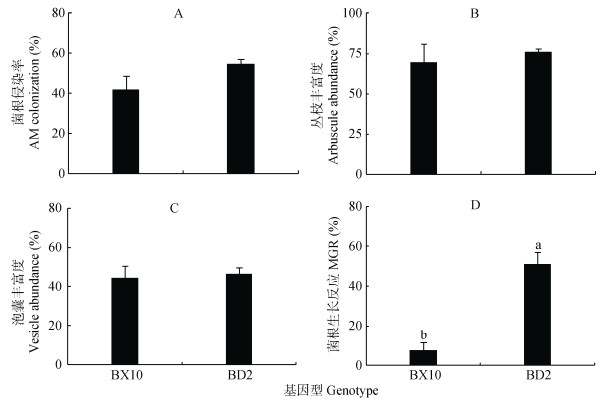
由图 2可见, 大豆菌根侵染率、丛枝丰富度和泡囊丰富度均无显著基因型差异, 而大豆菌根生长反应(MGR)存在显著基因型差异(P < 0.01)。从不同基因型分析结果来看, BD2菌根生长反应明显, 比BX10菌根生长反应高近7倍(图 2D)。
|
图 2 接种菌根真菌对不同大豆基因型菌根侵染性状和菌根生长反应的影响 Fig. 2 Effects of inoculation of arbuscular mycorrhizal fungi (AM)on mycorrhizal infection characteristics and mycorrhizal growth responses of different soybean genotypes 不同字母表示两基因型间差异达5%显著水平。MGR: mycorrhizal growth response. Different lowercase letters indicate significant differences between two genotypes (P < 0.05). |
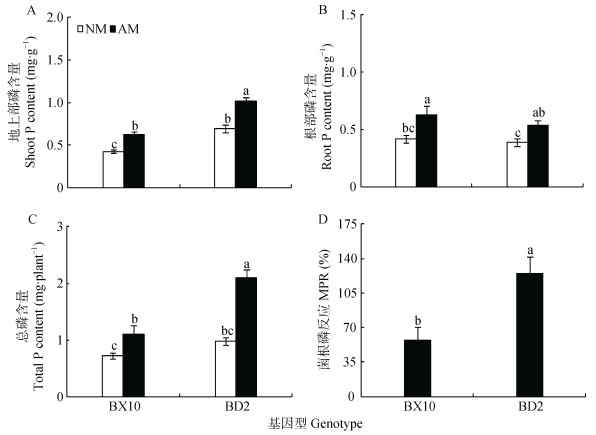
由图 3可见, 不同接菌处理极显著影响大豆地上部和根部磷含量以及总磷吸收量(P < 0.001)。地上部磷含量和总磷吸收量均存在极显著基因型差异(P < 0.001)。总磷吸收量在不同接菌处理和不同基因型之间存在显著的交互作用(P < 0.01)。从不同接菌处理来看, 与不接菌处理相比, 接菌处理的BX10地上部磷含量、根部磷含量和总磷吸收量分别增加48%、50%和52%, 而BD2地上部磷含量、根部磷含量和总磷吸收量分别增加46%、38%和114%(图 3)。从不同大豆基因型来看, 无论是否接菌, BD2都有较高的地上部磷含量, 在不接菌和接菌条件下, BD2地上部磷含量比BX10分别高67%和65%(图 3A)。然而, 无论是否接菌, BX10和BD2之间根部磷含量没有显著差异(图 3B)。在不接菌条件下BX10和BD2之间总磷吸收量没有显著差异, 在接菌条件下, BD2总磷吸收量比BX10高89%(图 3C)。而从大豆菌根磷反应(MPR)来看, 两个大豆基因型菌根磷反应均较高, 并且存在显著基因型差异(P < 0.05), BD2菌根磷反应比BX10高2倍多(图 3D)。
|
图 3 接种菌根真菌对不同大豆基因型磷营养状况和菌根磷反应的影响 Fig. 3 Effects of inoculation of arbuscular mycorrhizal fungi on P nutrition status and mycorrhizal P response of different soybean genotypes NM:不接菌处理; AM:接菌处理。不同字母表示差异达5%显著水平。MPR: mycorrhizal phosphorus response. NM: non-AMF inoculation; AM: AMF inoculation. Different lowercase letters indicate significant differences (P < 0.05). |
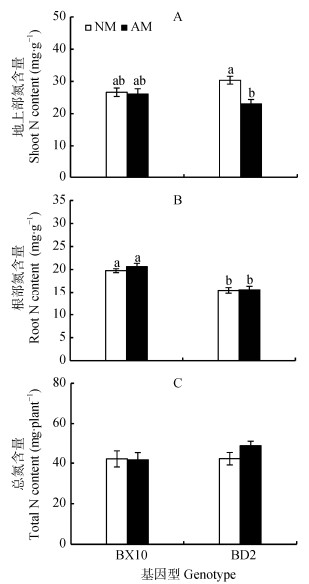
由图 4和方差分析来看, 不同接菌处理显著影响大豆地上部氮含量(P < 0.05), 而对根部氮含量和总氮吸收量均无显著影响。大豆根部氮含量存在极显著的基因型差异(P < 0.001), 地上部氮含量和总氮吸收量均无显著的基因型差异。地上部氮含量在不同接菌处理和不同基因型之间存在显著的交互作用(P < 0.05)。从不同接菌处理来看, BX10地上部氮含量在不同接菌处理间无显著差异; 但接菌处理对BD2地上部氮含量影响显著, 与不接菌处理相比, 接菌处理的BD2地上部氮含量减少24%(图 4A)。而BX10和BD2根部氮含量以及总氮吸收量在不同接菌处理间无显著差异(图 4B, 4C)。从不同大豆基因型来看, 在不接菌和接菌条件下, BX10根部氮含量均比BD2要高, 分别高28%和32%(图 4B)。但无论是否接菌, BX10和BD2的地上部氮含量和总氮吸收量均无显著差异(图 4A, 4C)。
|
图 4 接种菌根真菌对不同大豆基因型氮营养状况的影响 Fig. 4 Effects of inoculation of arbuscular mycorrhizal fungi on N nutrition status of different soybean genotypes NM:不接菌处理; AM:接菌处理。不同字母表示差异达5%显著水平。NM: non-AMF inoculation; AM: AMF inoculation. Different lowercase letters indicate significant differences (P < 0.05). |
由图 5及方差分析可见, 不同接菌处理对大豆总根长、根表面积、根系体积和根系平均直径均无显著影响。大豆根系平均直径存在显著基因型差异(P < 0.01)。大豆根表面积和根系体积在不同接菌处理和不同基因型之间均存在显著的交互作用(P < 0.05)。从不同大豆基因型来看, 接菌处理的BX10根系体积和根系平均直径均比BD2高, 分别高63%和29%(图 5C, 5D)。
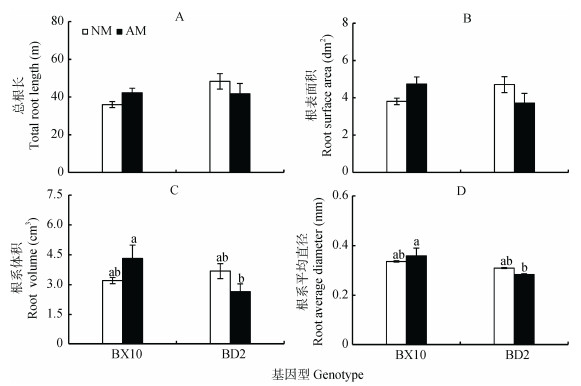
|
图 5 接种菌根真菌对不同大豆基因型根系性状的影响 Fig. 5 Effects of inoculation of arbuscular mycorrhizal fungi on root traits of different soybean genotypes NM:不接菌处理; AM:接菌处理。不同字母表示差异达5%显著水平。NM: non-AMF inoculation; AM: AMF inoculation. Different lowercase letters indicate significant differences (P < 0.05). |
由图 6可见, 不同接菌处理对大豆根系磷转运基因GmPT8、GmPT9和GmPT10表达存在显著影响(P < 0.001、P < 0.01和P < 0.01), 并且3个磷转运基因的表达存在显著的基因型差异(P < 0.01、P < 0.05和P < 0.05)。同时, 磷转运基因表达在不同接菌处理和不同基因型之间存在显著的交互作用(P < 0.001、P < 0.01和P < 0.01)。已有的研究表明, GmPT8、GmPT9和GmPT10是在根系菌根诱导表达的磷转运基因, 代表植物菌根的磷吸收途径[14, 16]。从不同接菌处理来看, 与不接菌处理相比, 接菌处理BX10根系GmPT8表达增加了10倍(图 6A); 而接菌处理的BD2根系GmPT8、GmPT9和GmPT10表达分别增加176倍、112倍和36倍(图 6)。从不同大豆基因型来看, 不接菌条件下, 3个磷转运基因的表达在两个大豆基因型间没有明显差异, 而接菌处理的BD2根系GmPT8、GmPT9和GmPT10表达比BX10分别增加了4倍、6倍和27倍(图 6)。
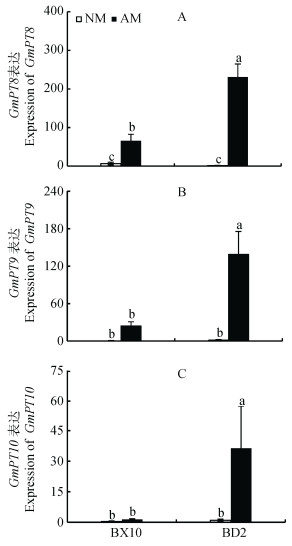
|
图 6 接种菌根真菌对不同大豆基因型根系中磷转运基因表达的影响 Fig. 6 Effects of inoculation of arbuscular mycorrhizal fungi on the expression of Pi transporter genes in roots of different soybean genotypes NM:不接菌处理; AM:接菌处理。不同字母表示差异达5%显著水平。NM: non-AMF inoculation; AM: AMF inoculation. Different lowercase letters indicate significant differences (P < 0.05). |
丛枝菌根对改善缺磷土壤中植物的磷营养状况具有不可忽视的作用, 高效的AMF接种能显著提高宿主植物的生长和吸磷能力[21]。本研究发现, 接种根内球囊霉增加了大豆基因型BD2地上部干重50%;同时, 分别增加了BX10和BD2的总磷吸收量52%和114%, 这一结果与前人的研究结果基本一致[13-16], 表明根内球囊霉是高效的AMF菌种, 能够促进大豆生长和磷吸收。与前人研究结果不同的是, AMF接种对BX10的生长没有显著的促进作用, 这可能是由于本试验条件下, 使用的是低磷营养液, 并进行了减氮处理, 氮磷营养缺乏的共同作用影响了BX10的AMF接种效果。同时, 也说明, 在氮磷共同缺乏条件下, 不同大豆基因型对菌根真菌接种的反应是存在基因型差异的, 本试验中两个大豆基因型菌根生长反应(MGR)和菌根磷反应(MPR)存在显著差异也证明了这一点。此外, 接菌处理对大豆植株氮营养状况影响并不显著, 一方面可能是由于本试验中减氮处理氮减少的幅度不够, 另一方面也表明AMF接种对大豆磷吸收的贡献更大。
已有的研究表明, BX10是浅根型、磷高效大豆基因型, BD2是深根型、磷低效大豆基因型[18, 22]。在田间条件下, 浅根型大豆根系与施磷较多的表层土壤接触多, 能促进磷吸收, 提高磷效率, 而深根型大豆的根系在有效磷含量较低的深层土壤中分布较多, 不利于浅层土壤中磷的吸收, 因此, 磷效率较低。在本研究盆栽条件下, 无论接菌与否, BD2均有较高的地上部磷含量(图 3A), 表明磷低效的BD2具有较高的植株体内磷转运能力。AMF接种对两个大豆基因型的根系性状产生了影响。例如, 与BX10相比, 接种AMF降低了BD2的根系体积和根系平均直径, 然而, 菌根侵染率没有显著差异, 表明根系性状的变化对大豆菌根侵染的影响较小, 这与前人的研究结果一致[13]。
MGR和MPR通常用来衡量植物对菌根真菌侵染的反应大小[20]。已有的研究利用促进作物生长的合作型AMF菌株, 以及不能促进作物生长的低合作型AMF菌株进行试验, 发现大豆MGR在不同AMF菌种之间的差异非常明显, 并且不同磷效率的大豆基因型接种不同AMF菌种的MGR表现出相同变化趋势[16]。然而, 针对同一合作型AMF菌种不同磷效率大豆的生长反应是否存在差异还少有报道。已有研究表明, 磷效率高的大麦(Hordeum vulgare L.)和小麦基因型的菌根反应以及菌根依赖性均较低[12, 23-24]。本研究结果也发现, 磷低效的BD2的MGR和MPR均显著高于磷高效的BX10, 表明BD2的菌根依赖性更高, 菌根真菌侵染更有利于BD2的生长和磷吸收。
GmPT8、GmPT9和GmPT10是大豆根系中菌根诱导表达的磷转运基因[14, 16, 25-26], 负责将AMF吸收和运输到丛枝中的磷转运, 这3个基因的表达能促进植物根系菌根途径的磷吸收。本研究中, 接菌处理的BD2根系GmPT8、GmPT9和GmPT10表达均显著高于BX10, 并且BD2的总磷吸收量显著高于BX10, 进一步证实BD2对菌根的依赖性更高。同时, 与不接菌相比, 根系菌根诱导表达的GmPT8在接菌的BX10中显著上调表达, 且接菌增加了BX10的地上部磷含量和总磷吸收量, 表明菌根真菌接种对促进BX10的磷吸收也有重要贡献, 但这3个菌根诱导的磷转运蛋白基因的表达与浅根型BX10的磷高效并没有直接关系。而菌根途径磷吸收对BD2生长的贡献大于BX10, 可能主要是不同磷效率基因型大豆本身特有的差异造成。一方面BX10植株体内磷转运能力较低, 另一方面BX10根系平均直径较大, 消耗的碳水化合物较多, 能为AMF有益共生提供的碳源相对较少, 具体原因还有待于进一步深入研究。
4 结论综上所述, 接种AMF能显著增加磷高效大豆BX10和磷低效大豆BD2的地上部磷浓度和总磷含量, 并且菌根侵染对根部性状有明显影响。BD2对菌根依赖性更高, 接种AMF后对促进BD2生长和磷吸收作用更大, 这可能主要是由于BD2根系菌根诱导表达的磷转运基因的表达较高, 体内磷转运效率较高。以上结果将为研究AMF接种对磷吸收的贡献提供理论依据。
| [1] |
SMITH S E, SMITH F A. Roles of arbuscular mycorrhizas in plant nutrition and growth:new paradigms from cellular to ecosystem scales[J]. Annual Review of Plant Biology, 2011, 62: 227-250. DOI:10.1146/annurev-arplant-042110-103846 |
| [2] |
李瑞卿, 刘润进, 李敏. 园艺作物菌根及其在生态农业的应用[J]. 中国生态农业学报, 2002, 10(1): 24-26. LI R Q, LIU R J, LI M. Mycorrhizas of horticultural crops and its application in eco-agriculture[J]. Chinese Journal of Eco-Agriculture, 2002, 10(1): 24-26. |
| [3] |
SMITH S E, JAKOBSEN I, GRØNLUND M, et al. Roles of arbuscular mycorrhizas in plant phosphorus nutrition:Interactions between pathways of phosphorus uptake in arbuscular mycorrhizal roots have important implications for understanding and manipulating plant phosphorus acquisition[J]. Plant Physiology, 2011, 156(3): 1050-1057. DOI:10.1104/pp.111.174581 |
| [4] |
冯海艳, 冯固, 宋建兰, 等. 丛枝菌根真菌根内菌丝碱性磷酸酶活性与菌根共生效应的研究[J]. 中国生态农业学报, 2004, 12(2): 124-127. FENG H Y, FENG G, SONG J L, et al. Studies on the relationship between the activity of alkaline phosphatase in intraradical hyphae of arbuscular mycorrhizae fungi and efficiency of mycorrhizal symbiosis[J]. Chinese Journal of Eco-Agriculture, 2004, 12(2): 124-127. |
| [5] |
HARRISON M J, DEWBRE G R, LIU J Y. A phosphate transporter from Medicago truncatula involved in the acquisition of phosphate released by arbuscular mycorrhizal fungi[J]. The Plant Cell, 2002, 14(10): 2413-2429. DOI:10.1105/tpc.004861 |
| [6] |
PASZKOWSKI U, KROKEN S, ROUX C, et al. Rice phosphate transporters include an evolutionarily divergent gene specifically activated in arbuscular mycorrhizal symbiosis[J]. Proceedings of the National Academy Sciences of the United States of America, 2002, 99(20): 13324-13329. DOI:10.1073/pnas.202474599 |
| [7] |
GRUNWALD U, GUO W B, FISCHER K, et al. Overlapping expression patterns and differential transcript levels of phosphate transporter genes in arbuscular mycorrhizal, Pi-fertilised and phytohormone-treated Medicago truncatula roots[J]. Planta, 2009, 229(5): 1023-1034. DOI:10.1007/s00425-008-0877-z |
| [8] |
江夏, 陈伟立, 徐春香, 等. 丛枝菌根真菌和磷水平对番茄幼苗侧根形成的影响[J]. 应用生态学报, 2015, 26(4): 1186-1192. JIANG X, CHEN W L, XU C X, et al. Influences of arbuscular mycorrhizal fungus and phosphorus level on the lateral root formation of tomato seedlings[J]. Chinese Journal of Applied Ecology, 2015, 26(4): 1186-1192. |
| [9] |
YAO Q, LIN F X, CHEN J Z, et al. Responses of citrus seedlings and a leguminous herb, Stylosanthes gracilis, to arbuscular mycorrhizal fungal inoculation[J]. Acta Horticulturae, 2008, 773: 63-67. |
| [10] |
YAO Q, ZHU H H, CHEN J Z. Growth responses and endogenous IAA and iPAs changes of litchi (Litchi chinensis Sonn.) seedlings induced by arbuscular mycorrhizal fungal inoculation[J]. Scientia Horticulturae, 2005, 105(1): 145-151. DOI:10.1016/j.scienta.2005.01.003 |
| [11] |
刘灵, 廖红, 王秀荣, 等. 磷有效性对大豆菌根侵染的调控及其与根构型、磷效率的关系[J]. 应用生态学报, 2008, 19(3): 564-568. LIU L, LIAO H, WANG X R, et al. Regulation effect of soil P availability on mycorrhizal infection in relation to root architecture and P efficiency of Glycine max[J]. Chinese Journal of Applied Ecology, 2008, 19(3): 564-568. |
| [12] |
YAO Q, LI X L, CHRISTIE P. Factors affecting arbuscular mycorrhizal dependency of wheat genotypes with different phosphorus efficiencies[J]. Journal of Plant Nutrition, 2001, 24(9): 1409-1419. DOI:10.1081/PLN-100106991 |
| [13] |
WANG X R, PAN Q, CHEN F X, et al. Effects of co-inoculation with arbuscular mycorrhizal fungi and rhizobia on soybean growth as related to root architecture and availability of N and P[J]. Mycorrhiza, 2011, 21(3): 173-181. |
| [14] |
WANG X R, ZHAO S P, BÜCKING H. Arbuscular mycorrhizal growth responses are fungal specific but do not differ between soybean genotypes with different phosphate efficiency[J]. Annals of Botany, 2016, 118(1): 11-21. |
| [15] |
WANG G, SHENG L, ZHAO D, et al. Allocation of nitrogen and carbon is regulated by nodulation and mycorrhizal networks in soybean/maize intercropping system[J]. Frontiers in Plant Science, 2016, 7: 1901. |
| [16] |
ZHAO S P, CHEN A, CHEN C J, et al. Transcriptomic analysis reveals the possible roles of sugar metabolism and export for positive mycorrhizal growth responses in soybean[J]. Physiologia Plantarum, 2019, 166(3): 712-728. DOI:10.1111/ppl.12847 |
| [17] |
覃金转, 王秀荣. 不同基因型大豆磷镁养分互作效应初探[J]. 中国油料作物学报, 2019, 41(2): 217-225. QIN J Z, WANG X R. Interactive effect of phosphorus and magnesium in different soybean genotypes[J]. Chinese Journal of Oil Crop Sciences, 2019, 41(2): 217-225. |
| [18] |
ZHAO J, FU J B, LIAO H, et al. Characterization of root architecture in an applied core collection for phosphorus efficiency of soybean germplasm[J]. Chinese Science Bulletin, 2004, 49(15): 1611-1620. DOI:10.1007/BF03184131 |
| [19] |
ZHANG S, ZHOU J, WANG G H, et al. The role of mycorrhizal symbiosis in aluminum and phosphorus interactions in relation to aluminum tolerance in soybean[J]. Applied Microbiology and Biotechnology, 2015, 99(23): 10225-10235. DOI:10.1007/s00253-015-6913-6 |
| [20] |
HETRICK B A D, WILSON G W T, COX T S. Mycorrhizal dependence of modern wheat varieties, landraces, and ancestors[J]. Canadian Journal of Botany, 1992, 70(10): 2032-2040. DOI:10.1139/b92-253 |
| [21] |
KIERS E T, DUHAMEL M, BEESETTY Y, et al. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis[J]. Science, 2011, 333(6044): 880-882. DOI:10.1126/science.1208473 |
| [22] |
LIAO H, WAN H Y, SHAFF J, et al. Phosphorus and aluminum interactions in soybean in relation to aluminum tolerance. Exudation of specific organic acids from different regions of the intact root system[J]. Plant Physiology, 2006, 141(2): 674-684. |
| [23] |
BAON J B, SMITH S E, ALSTON A M. Mycorrhizal responses of barley cultivars differing in P efficiency[J]. Plant and Soil, 1993, 157(1): 97-105. DOI:10.1007/BF02390231 |
| [24] |
ZHU Y G, SMITH S E, BARRITT A R, et al. Phosphorus (P) efficiencies and mycorrhizal responsiveness of old and modern wheat cultivars[J]. Plant and Soil, 2001, 237(2): 249-255. DOI:10.1023/A:1013343811110 |
| [25] |
TAMURA Y, KOBAE Y, MIZUNO T, et al. Identification and expression analysis of arbuscular mycorrhiza-inducible phosphate transporter genes of soybean[J]. Bioscience Biotechnology and Biochemistry, 2012, 76(2): 309-313. DOI:10.1271/bbb.110684 |
| [26] |
QIN L, GUO Y X, CHEN L Y, et al. Functional characterization of 14Pht1 family genes in yeast and their expressions in response to nutrient starvation in soybean[J]. PLoS One, 2012, 7(10): e47726. DOI:10.1371/journal.pone.0047726 |
 2020, Vol. 28
2020, Vol. 28



