2. 广东省生态循环农业重点实验室/农业农村部华南热带农业环境重点实验室/广东省现代生态农业与循环农业工程技术研究中心 广州 510642
2. Guangdong Provincial Key Laboratory of Eco-circular Agriculture/Key Laboratory of Agro-environment in the Tropics, Ministry of Agriculture and Rural Affairs/Guangdong Engineering Research Center for Modern Eco-agriculture and Circular Agriculture, Guangzhou 510642, China
生物入侵是全球变化问题之一, 也是导致生物多样性降低的重要因素, 其中福寿螺[Pomacea canaliculata (Lamark 1822)]是水生入侵物种的典型代表[1]。福寿螺又名大瓶螺、苹果螺, 属软体动物门、腹足纲、前鳃亚纲、腹足目、瓶螺科、瓶螺属, 原产于南美洲亚马逊河流域。福寿螺在1981年前后被引入中国大陆, 在我国南方地区快速扩散, 严重危害农作物和水生植物, 其中水稻(Oryza sativa L.)受害最重, 受害株率一般为7%~15%, 最高可达64%[2]。福寿螺还与生态系统内其他生物争夺食物、空间, 威胁本地生物生存。目前已经在广东、广西、福建、海南、云南、贵州、四川、重庆、江西、湖南、湖北、浙江等地发生危害, 并且其入侵区域还可能继续扩大[3-5]。
盐度是影响海洋和河口物种分布及生物生存的一个重要环境因素[6]。盐度的急剧变化会对生物的代谢、血淋巴渗透压和组织含水量等生理生化过程造成影响, 特别是对生活在沿海和河口水域的软体动物[7-10]。福寿螺为淡水软体动物, 但近期研究报道[11], 在一些盐水区也发现了福寿螺的分布, 但目前对于其能否在盐水区建立稳定种群并形成入侵仍不明确。福寿螺具有适应性广、抗性强、繁殖率高等特点[12], 这些特性可能有助于其向盐水区域扩散。因此, 开展福寿螺对盐度胁迫的生理生态响应研究, 将有助于掌握福寿螺向盐水环境的扩散能力。耗氧率、排氨率及氧氮比是反映螺类呼吸代谢水平的重要指标, 其变化情况反映了盐水环境对螺类正常生命活动的影响程度[13-15]。本研究探索了盐胁迫对不同大小福寿螺的耗氧率和排氨率的影响, 旨在为评价福寿螺向盐水区入侵扩散风险提供参考依据。
1 材料与方法 1.1 试验材料试验所用福寿螺于2019年6月初采集于广州市增城区华南农业大学基地(23°9′N, 113°1′E), 取回后去除其表面附着物, 挑选无损伤的螺, 按壳高分为小螺(10 mm≤壳高 < 20 mm)、中螺(20 mm≤壳高 < 30 mm)、大螺(30 mm≤壳高 < 40 mm)3组(表 1), 分别置于玻璃水缸中暂养, 暂养期间每天投食新鲜生菜(Lactuca sativa L. var. ramosa Hort.), 持续充气, 7 d后开始试验。试验盐水用市售海水晶(NaCl和矿物质)与曝气去氯自来水按比例配制而成。
| 表 1 不同大小福寿螺的形态特征 Table 1 Biological characteristics of different-size groups of Pomacea canaliculata |
试验设置盐度处理为0 g∙L–1(CK)、2.5 g∙L–1、5.0 g∙L–1、7.5 g∙L–1和10.0 g∙L–1 5个梯度, 其中0 g∙L–1为对照组。选取数量为试验用量5~8倍的福寿螺放入玻璃水缸, 以每小时2.5 g∙L–1的幅度升高盐度, 达到预定盐度后再驯化2 d, 开始试验, 试验前24 h停止投喂。试验在250 mL锥形瓶中进行, 放置福寿螺的个数分别为小螺组每瓶4个, 中螺组每瓶3个, 大螺组每瓶2个。每组每个盐度处理均有4个重复, 每个盐度处理下设4个无螺空白对照以校正“水呼吸”所造成的误差。试验采用静水式呼吸室, 水浴加热, 水温为(28±0.5) ℃。3种个体大小分3组进行测定, 每个组均从8:00开始试验。将福寿螺放入装满水的锥形瓶后立即用塑料薄膜密封锥形瓶, 2 h后(10:00)用虹吸法抽取水样进行溶解氧(DO)和氨氮(NH3-N)的测定[16]。每组试验结束后, 吸干福寿螺体表水分, 用游标卡尺测量其壳高(mm)、壳宽(mm), 用电子天平秤湿重(g), 然后取软体部分置于65 ℃烘箱内烘干48 h至恒重, 用FA1604A型(上海)电子天平称重。
1.2.2 测量方法根据国标《GB 17378. 4—2007》海洋监测规范方法, 分别采用Winkler碘量法和次溴酸钠氧化法测定水中的溶解氧(DO)和氨氮(NH3-N)含量, 按照下列公式计算福寿螺的单位干质量耗氧率(OCR)、排氨率(AER)及氧氮比(O/N)[17]:
| ${\rm{OCR}} = [({\rm{D}}{{\rm{O}}_0}--{\rm{D}}{{\rm{O}}_{\rm{T}}}) \times V]/(w \times t) $ | (1) |
| $ {\rm{AER}} = [({N_{\rm{T}}}--{N_0}) \times V]/(w \times t) $ | (2) |
| $ {\rm{O/N = }}\left( {{\rm{OCR/16}}} \right){\rm{/}}\left( {{\rm{AER/14}}} \right) $ | (3) |
式中: DO0和DOT分别为空白对照组和试验组水中溶氧浓度(mg·L-1), N0和NT为空白组和试验组水中氨氮浓度(μg·L-1), V为试验瓶内水的体积(L), w为试验螺软组织干质量(g), t为呼吸室持续时间(h)。
1.3 数据处理采用SPSS 20.0软件, 用单因素分析(One-Way ANOVA)和Duncan多重比较分析不同盐度间福寿螺耗氧率、排氨率和氧氮比的差异, 对盐度、个体大小交互作用的福寿螺耗氧率和排氨率进行双因素分析(Two-Way ANOVA), 显著水平为P < 0.05。采用逐步回归方法分析福寿螺软体干质量与耗氧率和排氨率的关系。采用Origin 9.0绘图。
2 结果与分析 2.1 盐胁迫下不同个体大小福寿螺的耗氧率和排氨率盐度、福寿螺个体大小及两者的交互作用对福寿螺的耗氧率均有显著影响(P < 0.001, 图 1)。方差分析结果显示, 盐度对福寿螺的耗氧率有显著影响(P < 0.001)。3种不同个体大小的福寿螺耗氧率均在盐度2.5 g∙L–1时达到峰值, 之后随盐度(2.5~10.0 g∙L–1)的升高而逐渐降低, 在盐度10.0 g∙L–1时达最小值。在盐度7.5 g∙L–1和10.0 g∙L–1时, 小、中、大螺的耗氧率均显著低于对照组(P < 0.05)。但在盐度5.0 g∙L–1时, 小、中、大螺的耗氧率与对照组均无显著差异。不同个体大小福寿螺的耗氧率也存在极显著差异(P < 0.001), 在同一盐度下, 福寿螺越小, 耗氧率越高。盐度和福寿螺个体大小的交互作用也对福寿螺的耗氧率有显著影响(P < 0.001)。
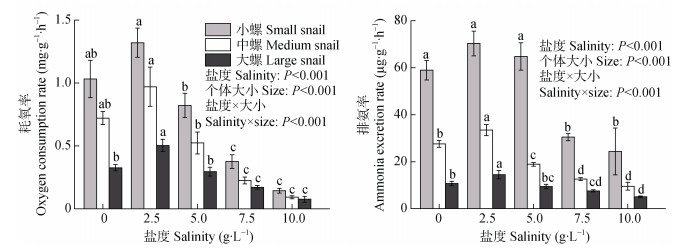
|
图 1 不同盐度和个体大小对福寿螺耗氧率和排氨率的影响 Fig. 1 Effects of salinities and sizes on oxygen consumption rate and ammonia excretion rate of Pomacea canaliculata 不同字母表示不同盐度处理间差异显著(P < 0.05)。Different lowercase letters mean significant differences among different treatments at P < 0.05 level. |
盐度对福寿螺的排氨率也有显著影响(P < 0.001), 3种个体大小的福寿螺排氨率均在盐度2.5 g∙L–1时达到峰值, 之后随盐度(2.5~10.0 g∙L–1)的升高而逐渐下降。在盐度7.5 g∙L–1和10.0 g∙L–1时, 3种个体大小的福寿螺排氨率均显著低于对照组(P < 0.05)。在盐度2.5 g∙L–1时, 中螺和大螺的排氨率明显高于对照组(P < 0.05), 而小螺与对照组无显著差异; 小螺和大螺在盐度5.0 g∙L–1时的排氨率与对照组均无显著性差异, 而中螺在盐度5.0 g∙L–1时的排氨率显著低于对照组(P < 0.05)。在同一盐度处理下, 不同个体大小福寿螺的排氨率存在显著差异(P < 0.001), 福寿螺越小, 排氨率越高。盐度和福寿螺个体大小的交互作用也对福寿螺的排氨率有显著影响(P < 0.001, 图 1)。
2.2 盐胁迫下福寿螺软体干质量与耗氧率和排氨率的关系在不同盐度处理下, 福寿螺的耗氧率(OCR)均随着其软体部干重(W)的增加而降低, 即不同大小福寿螺耗氧率高低关系表现为:小螺 > 中螺 > 大螺。福寿螺耗氧率与软体部干重之间呈负相关, 且符合幂函数关系OCR=aWb, 其中a介于0.073~0.641, 均值0.369±0.105; b介于-0.616~-0.390, 均值为-0.488± 0.042(图 2)。在盐度0 g∙L–1和5.0 g∙L–1处理下, 幂函数曲线大致从福寿螺软体干重0.24 g到1.50 g呈骤降变化, 之后随着其软体干重的增加而趋于平缓; 在盐度7.5 g∙L–1处理下, 大致从福寿螺软体干重1.00 g之后, 随软体干重的增加, 曲线趋于平缓; 而在盐度10.0 g∙L–1时, 幂函数曲线一直呈平缓趋势。

|
图 2 不同盐度下福寿螺的耗氧率(OCR)和排氨率(AER)与软体部干重(W)的回归方程 Fig. 2 Regression equations of oxygen consumption rate (OCR) and ammonia excretion rate (AER) with dry meat weight (W) of Pomacea canaliculata under different salinities |
福寿螺的排氨率(AER)与软体部干重(W)也呈负相关, 其回归方程可表示为AER=aWb, 其中a值为6.727~20.912, 平均值为14.866±2.812; b值为-0.893~-0.546, 平均值为-0.769±0.067(图 2)。在不同盐度处理下, 福寿螺的排氨率均随着软体部干重的增加而降低, 即不同大小福寿螺的排氨率大小关系表现为:小螺 > 中螺 > 大螺。在盐度0 g∙L–1~5.0 g∙L–1时, 幂函数曲线从福寿螺软体干重0.24 g到1.75 g呈骤降变化, 之后随着软体干重的增加, 曲线趋于平缓; 而在盐度7.5 g∙L–1和10.0 g∙L–1时, 从福寿螺软体干重1.00 g之后, 随软体干重的增加, 曲线趋于平缓。
2.3 盐胁迫下不同个体大小福寿螺的氧氮比由表 2可知, 在盐度为0~10.0 g∙L–1时, 福寿螺的氧氮比(O/N)范围为5.80~30.46 (表 2)。中螺的4个盐度处理组与对照组均无显著差异(P > 0.05);小螺和大螺在2.5 g∙L–1、5 g∙L–1、7.5 g∙L–1的O/N与对照组相比均无显著性差异, 但在盐度10.0 g∙L–1处理下其O/N显著低于对照组(P < 0.05)。盐度为2.5~10.0 g∙L–1时, 3种个体大小福寿螺的O/N呈下降趋势, 盐度10.0 g∙L–1时达最小值(5.80、10.23、13.26)。
| 表 2 不同个体大小的福寿螺在不同盐度下的氧氮比(O/N) Table 2 Oxygen-nitrogen ratio of Pomacea canaliculata of different sizes under different salinity conditions |
盐度的变化会导致水生动物体内外渗透压的改变, 进而影响其生理代谢活动[18]。本研究发现, 在盐度2.5 g∙L–1时, 福寿螺的耗氧率和排氨率均高于对照组, 但在盐度7.5 g∙L–1和10.0 g∙L–1时, 3种个体大小福寿螺的排氨率均显著低于对照组(P < 0.05)。一个可能的原因是, 一定限度内盐度的升高导致淡水动物机体内外渗透压失衡, 维持渗透压平衡需要消耗更多的能量, 因而导致耗氧率和排氨率增加[19-20]。但当水环境的盐度超过水生动物的耐受范围时, 会抑制水生动物的有氧代谢, 从而降低鳃的通透性以减少外界Na+和Cl-的流入, 以维持自身渗透压平衡。同时, 在高渗透压下, 水生动物主要由体内可溶性蛋白分解形成游离氨基酸为渗透调节供能; 但在高盐胁迫下, 可溶性蛋白质合成率降低[21-23]。本研究表明, 在超出7.5 g∙L–1盐度时, 福寿螺开始出现应急响应, 并逐步通过降低其代谢率, 以减少消耗, 来缓解其受到的逆境胁迫。
3.2 盐胁迫下福寿螺体重对其耗氧率和排氨率的影响体重是影响螺类耗氧率和排氨率的因素之一[24]。本研究表明, 不同大小福寿螺耗氧率和排氨率高低表现为:小螺 > 中螺 > 大螺, 这与吴文广等[16]对泥螺(Bullacta exarata)的研究一致。李加儿等[25]认为, 水生动物在生长过程中直接维持生命的组织(如肾脏、肝脏等)与非直接维持生命的组织(如肌肉、脂肪等)比率逐渐降低, 并且直接维持生命的组织代谢率高于非直接维持生命的组织代谢率, 从而导致水生动物的代谢率随着其体重的升高而降低。本研究发现, 在盐度10.0 g∙L–1处理下, 福寿螺耗氧率随体重的变化曲线一直趋于平缓, 即此时螺体的大小对其耗氧率影响不大, 这种现象表明该处理可能已经达到了胁迫福寿螺生长的盐度范围, 进而导致了福寿螺原有正常代谢的紊乱。同时, 本研究也发现, 在福寿螺驯化期间, 盐度10.0 g∙L–1处理下的福寿螺存在死亡现象, 因此, 从另一方面也印证了此盐度处理已对福寿螺的生长和生存造成了严重危害。
3.3 盐度对福寿螺氧氮比的影响氧氮比(O/N)是表示生物呼吸底物的重要标志, 用于评估外界环境对生物体的压力, O/N值大表示生物体代谢所消耗的能量多数由脂肪和碳水化合物提供, 较少部分由蛋白质提供[26]。有研究表明, 随着周围环境的变化, 水生软体动物的代谢底物也会发生变化; 当O/N < 7时, 生物机体以蛋白质代谢为主; 当7 < O/N < 24时, 以脂肪和碳水化合物及蛋白质共同代谢为主; 当O/N > 24时, 生物机体以脂肪和碳水化合物代谢为主导[27]。在本试验对照组中, 福寿螺的O/N为15~27, 这与田悦等[28]发现正常福寿螺的O/N在7~24的研究结果基本一致。在盐度2.5 g∙L–1时, 福寿螺的O/N最高, 表明此时脂肪和碳水化合物代谢占比最高; 在盐度7.5 g∙L–1处理下, 3种不同大小福寿螺的O/N在7~24, 表明此时以蛋白质及脂肪和糖类共同代谢为主; 在盐度10.0 g∙L–1处理下, 福寿螺的O/N最小, 其中中螺和大螺的O/N在7~24, 以蛋白质及脂肪和糖类共同代谢为主; 小螺的O/N < 7, 以蛋白质代谢为主, 可见, 小螺受盐度10.0 g∙L–1胁迫的影响比中螺和大螺更强烈。有研究表明, 蛋白质代谢水平过高, 使生物体内蛋白质过量消耗, 难以积累, 从而影响其正常生长, 最终会导致生物个体死亡[29]。由此可初步推断, 小螺的耐盐阈值大致为7.5 g∙L–1, 中、大螺可在盐度10.0 g∙L–1以内的水环境中生存一定时间。
本研究发现, 在盐度7.5 g∙L–1处理下, 3种不同大小的福寿螺的耗氧率和排氨率均明显低于对照组, 而3种个体大小的福寿螺的O/N均与对照无显著差异, 即在同一盐度下3个指标存在不一致的响应结果表现。一个可能的原因是, 虽然在盐度7.5 g∙L–1处理下福寿螺的耗氧率和排氨率均同时降低, 但由于O/N值是耗氧率和排氨率的比值, 故二者的相对变化值并不一定同步下降(即其O/N值与对照不一定产生差异), 鉴于此种情况, 并结合其他相关研究的做法[30-32], 使用O/N作为评估生物体对环境压力耐受与响应的指标, 可能更为综合和全面。
3.4 福寿螺向盐水环境入侵的风险分析河口区受潮汐、上游径流等的影响, 盐度变化幅度大[33]。以珠江河口为例, 丰水期多年平均盐度为9.95 g∙L–1, 平水期多年平均盐度为18.55 g∙L–1, 枯水期多年平均盐度为24.43 g∙L–1[34]。杨淞等[35]研究表明, 盐胁迫对福寿螺(壳高20~25 cm)48 h的半致死浓度约为15 g∙L–1(黑壳福寿螺为15.96 g∙L–1, 黄壳福寿螺为15.63 g∙L–1), 超过丰水期的多年平均盐度。本研究结果显示, 中螺和大螺可在盐度10.0 g∙L–1胁迫下生存一定时间, 因此, 可以初步推测随着潮汐或丰枯水期的变化, 中螺和大螺可短期或间歇性地生存在一定的盐水环境中, 特别是在河口的丰水期。同时, 福寿螺具有两栖呼吸能力, 可攀爬逃逸盐水环境, 可依附生活在沿海滩涂出露水面以上的生境或湿地植物[如红树(Rhizophora apiculata)林植物]的茎干上。另一方面, 福寿螺在盐水环境中经过驯化可适应更高的盐度环境。么宗利等[36]研究表明, 经过盐驯化6 d的尼罗罗非鱼(Oreochromis niloticus)和以色列红罗非鱼(O. mossambicus × O. niloticus)耐盐能力明显提高; 同时, 也有成功入侵河口盐水区的淡水螺的报道, 如新西兰泥螺(Potamopyrgus antipodarum)已成功扩散到圣米歇尔山、波罗的海、诺福克等地的半盐水和盐水区, 最高耐受盐度可达28 g∙L–1[37]。综合上述分析可见, 福寿螺可间歇性、短期生活在一定的盐水环境中, 而且通过长期的驯化和适应, 有可能产生向更高盐度环境入侵的风险, 今后对此需进一步加大关注。然而, 需要说明的是, 本研究毕竟是室内短期模拟试验的结果, 因此, 福寿螺在沿海咸淡水、盐水生境地区的实际入侵表现和风险, 还有待开展长期的野外调查和动态监测, 并进行深入系统的野外定位研究。
4 结论福寿螺的耗氧率、排氨率存在显著的盐胁迫差异和个体大小差异, 且盐度和个体大小的交互作用显著; 高盐度胁迫下福寿螺的氧氮比出现明显下降。福寿螺有向盐度2.5 g∙L–1、5.0 g∙L–1、7.5 g∙L–1水体入侵的风险。中螺和大螺的耐受盐胁迫能力强于小螺, 有向盐度10.0 g∙L–1区域入侵的潜力。不同个体大小福寿螺对盐胁迫的响应差异, 可为进一步研究其向半盐水区扩散机制、种群扩增策略、风险评估和早期防控提供参考。
| [1] |
陈宝明, 彭少麟, 吴秀平, 等. 近20年外来生物入侵危害与风险评估文献计量分析[J]. 生态学报, 2016, 36(20): 6677-6685. CHEN B M, PENG S L, WU X P, et al. A bibliometric analysis of researches on topics related to the ecological damage caused by and risk assessments of exotic invasive species from 1995 to 2014[J]. Acta Ecologica Sinica, 2016, 36(20): 6677-6685. |
| [2] |
李小慧, 胡隐昌, 宋红梅, 等. 中国福寿螺的入侵现状及防治方法研究进展[J]. 中国农学通报, 2009, 25(14): 229-232. LI X H, HU Y C, SONG H M, et al. Invasion and monitoring methods of Pomacea canaliculata for in China[J]. Chinese Agricultural Science Bulletin, 2009, 25(14): 229-232. |
| [3] |
杨叶欣, 胡隐昌, 李小慧, 等. 福寿螺在中国的入侵历史、扩散规律和危害的调查分析[J]. 中国农学通报, 2010, 26(5): 245-250. YANG Y X, HU Y C, LI X H, et al. Historical invasion, expansion process and harm investigation of Pomacea canaliculate in China[J]. Chinese Agricultural Science Bulletin, 2010, 26(5): 245-250. |
| [4] |
茅光耀, 郭云海, 张仪, 等. 福寿螺生态适应性相关基因研究进展[J]. 中国寄生虫学与寄生虫病杂志, 2018, 36(6): 666-672. MAO G Y, GUO Y H, ZHANG Y, et al. Research progress on genes related to ecological adaptability of Pomacea canaliculata[J]. Chinese Journal of Parasitology and Parasitic Diseases, 2018, 36(6): 666-672. |
| [5] |
LEVINTON J, DOALL M, RALSTON D, et al. Climate change, precipitation and impacts on an estuarine refuge from disease[J]. PLoS One, 2011, 6(4): e18849. DOI:10.1371/journal.pone.0018849 |
| [6] |
DELISLE P F, ROBERTS JR M H. The effect of salinity on cadmium toxicity to the estuarine mysid Mysidopsis bahia:Role of chemical speciation[J]. Aquatic Toxicology, 1988, 12(4): 357-370. DOI:10.1016/0166-445X(88)90062-8 |
| [7] |
MCFARLAND K, DONAGHY L, VOLETY A K. Effect of acute salinity changes on hemolymph osmolality and clearance rate of the non-native mussel, Perna viridis, and the native oyster, Crassostrea virginica, in Southwest Florida[J]. Aquatic Invasions, 2013, 8(3): 299-310. DOI:10.3391/ai.2013.8.3.06 |
| [8] |
LAGADE V M, TAWARE S S, MULEY D V. Seasonal variation in oxygen:Nitrogen ratio of Soletellina diphos of Bhatye estuary, Ratnagiri coast, India[J]. Journal of Environmental Biology, 2013, 34(1): 123-126. |
| [9] |
TAWARE S S, TAWARE V M, TAWARE D V. Oxygen consumption rate of the estuarine psammobiid clam Soletellina diphos (Linnaeus) under various environmental conditions[J]. Indian Journal of Geo-Marine Science, 2012, 41(5): 468-472. |
| [10] |
KAMMERER B D, CECH JR J J, KÜLTZ D. Rapid changes in plasma cortisol, osmolality, and respiration in response to salinity stress in tilapia (Oreochromis mossambicus)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2010, 157(3): 260-265. |
| [11] |
KWONG K L, WONG P K, LAU S S S, et al. Determinants of the distribution of apple snails in Hong Kong two decades after their initial invasion[J]. Malacologia, 2008, 50(1): 293-302. DOI:10.4002/0076-2997-50.1.293 |
| [12] |
郭靖, 章家恩. 福寿螺入侵机制的研究进展[J]. 生态学杂志, 2014, 33(3): 806-815. GUO J, ZHANG J E. Research progress on invasion mechanisms of Pomacea canaliculata[J]. Chinese Journal of Ecology, 2014, 33(3): 806-815. |
| [13] |
焦海峰, 严巧娜, 郑丹, 等. 温度和盐度对埋栖性双壳类泥蚶(Tegillarca granosa)呼吸、排泄的影响[J]. 海洋与湖沼, 2015, 46(6): 1333-1338. JIAO H F, YAN Q N, ZHENG D, et al. Effects of temperature and salinity on oxygen consumption and ammonia excretion of muddy shellfish Tegillarca granosa[J]. Oceanologia et Limnologia Sinica, 2015, 46(6): 1333-1338. |
| [14] |
SALVATO B, CUOMO V, DI MURO P, et al. Effects of environmental parameters on the oxygen consumption of four marine invertebrates:A comparative factorial study[J]. Marine Biology, 2001, 138(4): 659-668. DOI:10.1007/s002270000501 |
| [15] |
DAS T, PAL A K, CHAKRABORTY S K, et al. Thermal tolerance, growth and oxygen consumption of Labeo rohita fry (Hamilton, 1822) acclimated to four temperatures[J]. Journal of Thermal Biology, 2005, 30(5): 378-383. DOI:10.1016/j.jtherbio.2005.03.001 |
| [16] |
吴文广, 张继红, 方建光, 等. 盐度对不同规格泥螺耗氧率和排氨率的影响[J]. 生态学杂志, 2013, 32(9): 2457-2461. WU W G, ZHANG J H, FANG J G, et al. Effects of salinity on oxygen consumption and ammonia excretion rate of different sizes of Bullacta exarata[J]. Chinese Journal of Ecology, 2013, 32(9): 2457-2461. |
| [17] |
NIE H T, CHEN P, HUO Z M, et al. Effects of temperature and salinity on oxygen consumption and ammonia excretion in different colour strains of the Manila clam, Ruditapes philippinarum[J]. Aquaculture Research, 2016, 48(6): 2778-2786. |
| [18] |
刘勇, 施坤涛, 张少华, 等. 双壳贝类呼吸代谢的研究进展[J]. 南方水产, 2007, 3(4): 65-69. LIU Y, SHI K T, ZHANG S H, et al. Advancement of respiratory metabolism study in bivalve mollusus[J]. South China Fisheries Science, 2007, 3(4): 65-69. DOI:10.3969/j.issn.2095-0780.2007.04.011 |
| [19] |
孙陆宇, 温晓蔓, 禹娜, 等. 温度和盐度对中华圆田螺和铜锈环棱螺标准代谢的影响[J]. 中国水产科学, 2012, 19(2): 275-282. SUN L Y, WEN X M, YU N, et al. Influence of water temperature and salinity on standard metabolism of Cipangopaludina cathayensis and Bellamya aeruginosa[J]. Journal of Fishery Sciences of China, 2012, 19(2): 275-282. |
| [20] |
VLAŠIĆ M, GLAVIĆ N, BOLOTIN J, et al. Influence of salinity on physiological response of the bearded horse mussel Modiolus barbatus and Noah's ark shell Arca noae[J]. Ekológia (Bratislava), 2018, 37(4): 345-357. DOI:10.2478/eko-2018-0026 |
| [21] |
GIACOMIN M, DAL PONT G, EOM J, et al. The effects of salinity and hypoxia exposure on oxygen consumption, ventilation, diffusive water exchange and ionoregulation in the Pacific hagfish (Eptatretus stoutii)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2019, 232: 47-59. |
| [22] |
MATSUSHIMA O, KHAN H R, SALEUDDIN A S M. Haemolymph protein as a source for free amino acid accumulation in the pulmonate Helisoma trivolvis during hypertonic stress[J]. Journal of Experimental Zoology, 1991, 257(2): 141-149. DOI:10.1002/jez.1402570202 |
| [23] |
李二超, 陈立侨, 曾嶒, 等. 盐度对凡纳滨对虾体组织蛋白质积累、氨基酸组成和转氨酶活性的影响[J]. 水生生物学报, 2009, 33(3): 532-538. LI E C, CHEN L Q, ZENG C, et al. Effects of salinity on protein accumulation, amino acid composition and transaminase activity in tissues of Litopenaeus vannamei[J]. Acta Hydrobiologica Sinica, 2009, 33(3): 532-538. |
| [24] |
刘建勇, 绍杰, 卓健辉. 盐度对方斑东风螺耗氧率和排氨率的影响[J]. 热带海洋学报, 2005, 24(4): 35-40. LIU J Y, SHAO J, ZHUO J H. Effect of salinity on respiration and excretion of Babylonia areolate[J]. Journal of Tropical Oceanography, 2005, 24(4): 35-40. DOI:10.3969/j.issn.1009-5470.2005.04.006 |
| [25] |
李加儿, 刘士瑞, 区又君, 等. 浅色黄姑鱼幼鱼耗氧率、排氨率及窒息点的初步研究[J]. 海洋学报, 2008, 30(5): 165-170. LI J E, LIU S R, OU Y J, et al. A preliminary study on oxygen consumption rate, ammonia excretion rate and asphyxiation point of fry of chu's croaker Nibea coibor[J]. Acta Oceanologica Sinica, 2008, 30(5): 165-170. DOI:10.3321/j.issn:0253-4193.2008.05.022 |
| [26] |
WIDDOWS J. Combined effects of body size, food concentration and season on the physiology of Mytilus edulis[J]. Journal of the Marine Biological Association of the United Kingdom, 1978, 58(1): 109-124. DOI:10.1017/S0025315400024449 |
| [27] |
PERSONLE R J, MAHE N K, LE B N, et al. Effects of temperature on growth and metabolism in a Mediterranean population of European sea bass, Dicentrarchus labrax[J]. Aquaculture Amsterdam, 2004, 237(1/4): 269-280. |
| [28] |
田悦, 吕天星, 杨菀钊, 等. 苦葛皂苷对福寿螺耗氧率及排氨率的影响[J]. 浙江大学学报:农业与生命科学版, 2017, 43(5): 608-614. TIAN Y, LYU T X, YANG W Z, et al. Effects of pedunsaponin on oxygen consumption rate and ammonia excretion rate of Pomacea canaliculata[J]. Journal of Zhejiang University:Agric. & Life Sci., 2017, 43(5): 608-614. |
| [29] |
张旭峰, 杨大佐, 周一兵, 等. 温度、盐度对香螺幼螺耗氧率和排氨率的影响[J]. 大连海洋大学学报, 2014, 29(3): 251-255. ZHANG X F, YANG D Z, ZHOU Y B, et al. Impacts of temperature and salinity on oxygen consumption rate and ammonia excretion rate in juvenile whelk Neptunea cumingii[J]. Journal of Dalian Ocean University, 2014, 29(3): 251-255. |
| [30] |
刘建勇, 陈园媛, 曹伏君, 等. 盐度对不同规格九孔鲍耗氧量和排氨率的影响[J]. 广东海洋大学学报, 2019, 39(5): 129-134. LIU J Y, CHEN Y Y, CAO F J, et al. Effects of salinity on oxygen consumption rate and ammonia excretion rate of different size in Haliotis diversicolor supertexta[J]. Journal of Guangdong Ocean University, 2019, 39(5): 129-134. |
| [31] |
王资生, 彭斌. 温度和规格对扁玉螺耗氧率和排氨率的影响[J]. 盐城工学院学报:自然科学版, 2003, 16(4): 53-57. WANG Z S, PENG B. Effects of temperature and body size on oxygen consumption rate and ammonia excretion rate of Neverita didyma[J]. Journal of Yancheng Institute of Technology:Natural Science, 2003, 16(4): 53-57. |
| [32] |
黄孝锋, 赵峰, 王妤, 等. 盐度对中华绒螯蟹仔蟹标准代谢的影响[J]. 中国水产科学, 2016, 23(5): 1157-1163. HUANG X F, ZHAO F, WANG Y, et al. Effect of salinity on standard metabolism of juvenile Chinese mitten crab, Eriocheir sinensis[J]. Journal of Fishery Sciences of China, 2016, 23(5): 1157-1163. |
| [33] |
章文, 刘丙军, 辛彦博, 等. 珠江河口区盐度变化周期特征分析——以磨刀门水道为例[J]. 热带地理, 2013, 33(1): 28-33. ZHANG W, LIU B J, XIN Y B, et al. Analysis of the periodic characteristics of salinity variation in the pearl river estuary-A case study of the Modaomen waterway[J]. Tropical Geography, 2013, 33(1): 28-33. |
| [34] |
贾后磊, 谢健, 吴桑云, 等. 近年来珠江口盐度时空变化特征[J]. 海洋湖沼通报, 2011(2): 142-146. JIA H L, XIE J, WU S Y, et al. Temporal and spatial variations of salinity in Pearl River Estuary in recent years[J]. Transactions of Oceanology and Limnology, 2011(2): 142-146. DOI:10.3969/j.issn.1003-6482.2011.02.020 |
| [35] |
杨淞, 钟敬仁, 赵柳兰, 等. 盐度胁迫对入侵生物福寿螺的急性毒性效应[J]. 华南农业大学学报, 2015, 36(5): 31-35. YANG S, ZHONG J R, ZHAO L L, et al. Acute toxicity effects of salinity stress on the invasive golden apple snails[J]. Journal of South China Agricultural University, 2015, 36(5): 31-35. |
| [36] |
么宗利, 李思发, 李学军, 等. 尼罗罗非鱼和以色列红罗非鱼耐盐驯化初步报告[J]. 上海海洋大学学报, 2003, 12(2): 97-101. YAO Z L, LI S F, LI X J, et al. A primary study on the acclimation to salt-water of Nile tilapia and Israel strain red tilapia[J]. Journal of Shanghai Fisheries University, 2003, 12(2): 97-101. DOI:10.3969/j.issn.1004-7271.2003.02.001 |
| [37] |
ALONSO A, CASTRO-DÍEZ P. What explains the invading success of the aquatic mud snail Potamopyrgus antipodarum (Hydrobiidae, Mollusca)?[J]. Hydrobiologia, 2008, 614(1): 107-116. DOI:10.1007/s10750-008-9529-3 |
 2020, Vol. 28
2020, Vol. 28



