2. 天津大学地球系统科学学院 天津 300072;
3. 华南农业大学资源环境学院 广州 510642
2. School of Earth System Science, Tianjin University, Tianjin 300072, China;
3. College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China
磷是作物生长发育必需的营养元素之一。农作物对于磷肥的当季利用率很低, 一般为10%~20%[1-2], 大部分磷被固定在土壤中, 无法被作物所利用。但是为追求高效生产, 农业生产者往往会过量投入磷肥, 加剧了磷在农业土壤中的累积。从土壤磷水平看, 1980—2007年, 我国土壤Olsen磷平均含量从7.4 mg∙kg–1增长到24.7 mg∙kg–1, 已超过我国大多数作物高产所需有效磷的临界值(20 mg∙kg–1) [3]。土壤中积累的磷可能通过侵蚀、地表径流和淋溶等方式进入地表水和地下水环境[4], 引起水体富营养化问题。
铁氧化矿物广泛存在于土壤中, 由于其表面羟基含量高、比表面积大等特点, 容易吸附磷等污染物[5-7]。有研究表明, 磷肥施用初期, 无机磷会大量吸附在铁矿物上[8]。由于比表面积大, 水铁矿对污染物的吸附能力往往比其他铁矿物更强[9-10]。作为土壤中典型的胶体物质, 吸附污染物后的水铁矿可以在土壤中长距离迁移[11], 而这种迁移是以水铁矿的稳定性作为前提。胡敏酸(HA)是天然有机质中重要的活性成分, 也是调控污染物和胶体环境行为的重要因子。它可以吸附在各种胶体颗粒表面, 如高岭土、羟基磷灰石纳米颗粒和金属氧化物纳米颗粒等[12-15]。因电荷零点在pH 8.2~8.7, 水铁矿胶体在通常情况下带正电荷[16]。HA电荷零点pH小于3, 在通常情况下表现为带负电荷。因而在pH < 9的水环境中, HA可通过静电作用吸附在水铁矿胶体表面, 从而改变水铁矿胶体的表面电性, 使其在液相中保持稳定[17]。同时, 体系中pH和离子强度也会对HA的吸附及水铁矿的稳定产生重要影响[14, 17-20], 高离子强度和与胶体电荷零点接近的pH都不利于胶体稳定。
和HA类似, 带负电的磷酸根可以与水铁矿胶体表面的羟基发生配位交换反应, 并以化学键的方式被吸附, 从而增加胶体表面负电荷的量; 当负电荷量较大时, 胶体间的静电斥力使水铁矿胶体分散性增强[20]。越来越多的研究发现, 胶体, 特别是含铁胶体, 可促进磷的迁移[21-24]。同样地, 在土壤中有一定迁移能力的水铁矿胶体也可能作为磷迁移的载体, 导致磷污染的扩散。但是有关于水铁矿吸附磷后形成磷-水铁矿胶体能力, 以及这种胶体稳定性的报道较少。本研究采用吸附试验, 利用吸附动力学和等温吸附模型, 明确水铁矿对磷的吸附特征; 在此基础上, 研究pH、离子强度和HA如何影响磷在液相、水铁矿胶体和水铁矿固相上的分布, 通过DLVO理论预测水铁矿胶体结合态磷的稳定性和迁移能力, 以期为磷淋失的风险评估提供理论支撑。
1 材料与方法 1.1 水铁矿的制备二线水铁矿(2-line)的制备方法是将40 g Fe(NO3)3∙9H2O(中国医药集团有限公司)溶于500 mL的Milli-Q超纯水中, 滴加4 mol∙L–1 NaOH(中国医药集团有限公司)至pH为7.5, 充分振荡后过滤, 收集沉淀物质, 用Milli-Q超纯水振荡清洗至上清液电导率小于10 μS∙cm-1[5, 20]。所得含水的水铁矿固体经冷冻干燥后, 用球磨仪磨细备用。之前研究结果表明, 该水铁矿的X射线衍射图谱与两线水铁矿一致[20], 其比表面积为227.9 m2∙g–1[5]。
1.2 吸附动力学和吸附等温试验使用NaH2PO4∙2H2O(中国医药集团有限公司)配制浓度为1 000 mg∙L–1的磷储备液, 后续试验稀释后使用。准确称取0.1 g水铁矿固体置于50 mL离心管中, 并向离心管中加入50 mg∙L–1磷溶液, 调节试验背景离子强度设置为100 mmol∙L–1 NaCl, 并用10 mmol∙L–1 NaOH和HCl将体系pH调节至7.0, 保证最终液体体积为25 mL。离心管用N2吹扫5 min后立即加盖放入恒温摇床中, 在恒温25 ℃和180 r∙min–1条件下振荡, 并在0.1~72 h时取样, 每个时间点设4个重复。样品过0.1 μm滤膜后, 用钼蓝比色法在800 nm下用紫外可见分光光度计(UV- 2700, Shimadzu, Japan)分析磷浓度[25]。
吸附等温试验中, 准确称取0.2 g水铁矿固体置于50 mL离心管中, 初始磷浓度设置为5 mg∙L–1、20 mg∙L–1、50 mg∙L–1、100 mg∙L–1和200 mg∙L–1, 振荡时间为48 h。背景离子强度、pH和其他试验操作与动力学试验一致。
1.3 不同pH下离子强度和胡敏酸(HA)对磷吸附的影响使用HA固体(中国医药集团有限公司)溶于一定量0.01 mol×L-1 NaOH溶液中, 加超纯水稀释, 制备5 000 mg∙L–1 HA储备液备用。在pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0的9个梯度下研究水铁矿吸附磷的变化。称取0.1 g水铁矿固体置于50 mL离心管中, 加入100 mg∙L–1磷溶液, 加入相应浓度的NaCl将背景离子强度调至1 mmol∙L–1、10 mmol∙L–1和100 mmol∙L–1 NaCl; 在HA浓度为100 mg∙L–1的条件下, 加入相应浓度的NaCl将背景离子强度调至10 mmol∙L–1和100 mmol∙L–1 NaCl, 调节pH后保证最终液体体积为25 mL。基本试验条件同前, 振荡48 h后静置1 h, 取上层悬浮液5 mL过0.1 μm滤膜后测定磷浓度, 记为液相磷浓度(PL), 由此可计算出磷的总吸附量; 另取5 mL用HCl将悬浮水铁矿溶解后, 测量磷浓度和铁离子浓度, 该磷浓度与液相磷浓度的差值为胶体相磷含量(PC), 通过该磷浓度与加入磷浓度的差值计算固相吸附磷的含量(PS), 通过铁离子浓度计算胶体态水铁矿的量; 再次取5 mL悬浮液用纳米粒度电位仪(Zetasizer Nano ZS, Malvern, U. K.)测定其中水铁矿胶体粒径和zeta电位。
1.4 数学模型 1.4.1 吸附模型用假一级动力学模型[公式(1)]和假二级动力学模型[公式(2)]对磷在水铁矿表面的吸附动力学结果进行拟合, 模型公式如下:
| ${q_t} = {q_{{\rm{e1}}}}\left( {1 - {{\rm{e}}^{ - {k_1}t}}} \right)$ | (1) |
| $\frac{t}{{{q_t}}} = \frac{t}{{{q_{{\rm{e2}}}}}} + \frac{1}{{{k_2}q_{{\rm{e}}2}^2}}$ | (2) |
式中: qe1和qe2分别为假一级动力学模型和假二级动力学模型的平衡吸附量(mg∙g–1); qt为在时间t(h)时的吸附量(mg∙g–1); k1(h–1)和k2分别为假一级动力学模型和假二级动力学模型的速率常数[g∙(mg∙h)–1]。
用Langmuir[公式(3)]和Freundilich[公式(4)]吸附等温模型对磷在水铁矿表面的等温吸附结果进行拟合, 两种模型公式如下:
| ${Q_{\rm{e}}} = \frac{{{Q_{\rm{m}}}b{C_{\rm{e}}}}}{{1 + b{C_{\rm{e}}}}}$ | (3) |
| ${Q_{\rm{e}}} = {K_{\rm{F}}}C_{\rm{e}}^{1/n}$ | (4) |
式中: Qe为吸附介质的平衡吸附量(mg∙g–1); Qm表示单层最大吸附量(mg∙g–1); Ce是溶液中剩余的磷浓度(mg∙L–1); b为Langmuir模型吸附能相关常数(∙L–1); KF是吸附能力常数[(mg∙g–1)∙(L∙mg–1)–n]; n是Freundlich模型吸附能相关常数, 当n>1时, 说明磷容易吸附在吸附介质上[5]。
1.4.2 DLVO理论根据DLVO理论, 胶体的凝聚与分散取决于双电层重叠时, 纳米颗粒体系的受力情况(ETOT), 其值等于胶体间的静电力(EEDL)和范德华引力(EVDW)之和, 可由公式(5)计算。
| ${E_{{\rm{TOT}}}} = {E_{{\rm{VDW}}}} + {E_{{\rm{EDL}}}}$ | (5) |
利用公式(6)和公式(7)可分别计算胶体之间的范德华引力和静电力。
| ${E_{{\rm{VDW}}}} = - \frac{{A{r_1}{r_2}}}{{6h\left( {{r_1} + {r_2}} \right)}}{\left[ {1 - \frac{{5.32h}}{{\rm{ \mathit{ λ} }}}\ln \left( {1 + \frac{{\rm{ \mathit{ λ} }}}{{5.32h}}} \right)} \right]^{ - 1}}$ | (6) |
| ${E_{{\rm{EDL}}}} = \frac{{2{\rm{ \mathit{ π} }}{r_1}{r_2}{n_\infty }{\rm{k}}T}}{{\left( {{r_1} + {r_2}} \right){\kappa ^2}}}\left( {\psi _1^2 + \psi _2^2} \right)\left\{ {\frac{{2{\psi _1}{\psi _2}}}{{\psi _1^2 + \psi _2^2}}\ln \left[ {\frac{{1 + \exp \left( { - \kappa h} \right)}}{{1 - \exp \left( { - \kappa h} \right)}}} \right] + \ln \left[ {1 - \exp \left( { - 2\kappa h} \right)} \right]} \right\}$ | (7) |
式中: A为Hamaker常数(J), 与纳米颗粒极化率、单位体积内原子数等性质有关; r1和r2为体系中相互作用的胶体半径(nm), 本研究中r1=r2; h表示胶体间距离(nm); λ是相互作用的特征波长, 设置为100 nm; ψ1和ψ2为胶体stern电势(mV), 在低浓度体系中通常用zeta电位代替, 本研究中ψ1=ψ2; n∞为离子数量密度(m–3); k是波尔兹曼常数(1.38×10–23 J∙K–1); T表示绝对温度(298 K); κ为德拜-休克尔参数(m–1), 与离子强度有关, 可由公式(8)得到。
| $\kappa = 3.28 \times {\left( I \right)^{1/2}} \times {10^9}$ | (8) |
式中: I表示离子强度(mol∙L–1)。
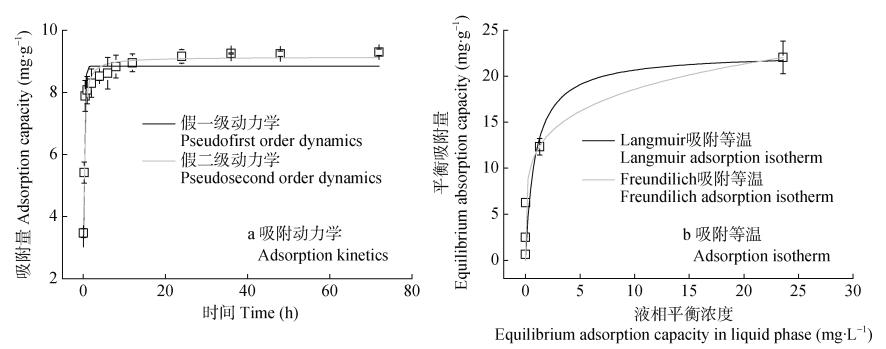
2 结果与分析 2.1 水铁矿对磷的吸附特征试验结果表明, 在初始阶段, 磷迅速吸附在水铁矿上, 其吸附量随时间延长而增加, 在前30 min后速度逐渐减慢, 24 h后基本趋于稳定(图 1a)。这可能是由于随着吸附的进行, 水铁矿表面吸附位点减少, 且磷浓度降低, 吸附传质动力逐渐减小。其他研究也表明在试验开始20 min时水铁矿对磷的吸附率已达98.1%[6]。将吸附动力学结果分别用假一级动力学模型和假二级模型进行拟合, 拟合相关系数如表 1所示。结果表明, 相比于假一级动力学模型(R2=0.945), 假二级动力学模型拟合结果(R2=0.964)较好, 更适用于描述整个吸附动力学过程。这表明磷在水铁矿上的吸附过程并非仅受外部传质阻力的影响, 而是存在多种吸附机理, 包括液膜扩散、内部扩散和化学吸附[26]。初始阶段, 磷在水铁矿表面快速吸附; 之后, 吸附速率受内扩散速率影响; 最后, 吸附和解吸达到平衡[27]。
|
图 1 磷在水铁矿上吸附的动力学(a)和吸附等温(b)模型 Fig. 1 Adsorption kinetics (a) and adsorption isotherm (b) models of phosphorus adsorption on ferrihydrite |
| 表 1 磷在水铁矿上吸附的动力学和吸附等温模型拟合参数 Table 1 Fitting parameters for kinetics and adsorption isothermal models of phosphorus adsorption on ferrihydrite |
在不同磷初始浓度下, 水铁矿对磷的吸附变化如图 1b所示。随着初始磷浓度的增加, 水铁矿对磷的吸附量也增加。在初始浓度为5 mg∙L–1、20 mg∙L–1和50 mg∙L–1时, 体系中的磷几乎被完全吸附; 当初始浓度继续增高至100~200 mg∙L–1时, 水铁矿对磷的吸附逐渐达到饱和。吸附结果用Langmuir和Freundlich吸附等温模型拟合, 如图 1b所示, 相关拟合参数如表 1所示。拟合结果表明, Freundlich模型(R2=0.970)的拟合效果好于Langmuir模型(R2=0.842), 表明水铁矿对磷的吸附为多层吸附, 这可能是由于水铁矿微孔发达且表面具有更高的不均一性导致的[28]。从水铁矿对含氧阴离子的配位体交换吸附模式[29]上也可以看出, 该吸附为多层吸附, 且较高n值(5.03)表明吸附较容易进行。从Langmuir模型参数中可得, 水铁矿对磷的最大理论吸附量Qm为22.55 mg∙g–1, 明显高于针铁矿对磷的吸附量(3~5 mg∙g–1)[15, 30]。
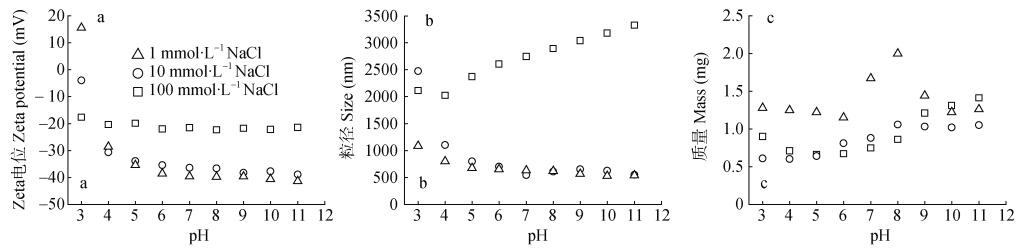
2.2 不同pH和离子强度下磷吸附态水铁矿胶体的zeta电位和粒径变化吸附试验结束后将离心管静置1 h, 上层悬浮液中所含水铁矿胶体的粒径和zeta电位测定结果如图 2所示。由于磷的吸附加载了负电荷, 绝大部分条件下水铁矿的zeta电位为负值[20]。体系pH升高, 水铁矿胶体表面的负电荷进一步增加, 因而zeta电位逐渐从15.6 mV降低至-41.6 mV(图 2a)。在中低浓度背景(1 mmol∙L–1和10 mmol∙L–1 NaCl)下, 水铁矿胶体zeta电位绝对值高于高浓度背景(100 mmol∙L–1 NaCl)10~20 mV。这是由于离子强度的增加会压缩胶体双电子层的扩散层, 使扩散层厚度减小, 从而表现为zeta电位绝对值降低[20]。姜军等[31]对土壤胶体的研究也指出, 土壤胶体的zeta电位的绝对值随电解质浓度的增加而降低。
|
图 2 不同pH和离子强度下水铁矿胶体zeta电位(a)、粒径(b)和质量(c)变化 Fig. 2 Changes in zeta potential (a), particle size (b), and mass (c) of ferrihydrite colloid under different pH and ionic strength |
水铁矿胶体的粒径随背景离子浓度的增加而增加, 尤其是在高浓度下(100 mmol∙L–1 NaCl)尤为明显(2026~3327 nm)。高离子强度下的凝聚作用导致大颗粒水铁矿胶体的形成[32], 当zeta电位绝对值降低时, 胶体体系不稳定而发生凝聚。而在1 mmol∙L–1和10 mmol∙L–1 NaCl背景下水铁矿胶体粒径差别较小(图 2b), 由于中低离子强度下水铁矿胶体负zeta电位逐渐降低, 其粒径也逐渐降低(从2474 nm降低至528 nm)。
低离子强度下(1 mmol∙L–1 NaCl)体系可以产生更多的水铁矿胶体, 约为1.15~2.00 mg。其中pH 7.0~9.0时, 水铁矿胶体量最大(1.44~2.00 mg) (图 2c)。而中高离子强度下(10 mmol∙L–1和100 mmol∙L–1 NaCl), 产生的水铁矿胶体相对较少, 为0.60~1.41 mg (图 2c)。虽然10 mmol∙L–1 NaCl条件下, 胶体负zeta电位的绝对值较大、粒径较小, 但一定的离子强度不利于水铁矿胶体的产生。
2.3 不同pH和离子强度下磷吸附和多相分布的变化随着pH的升高, 水铁矿对磷的总吸附量逐渐减少, pH 3.0时, 总吸附量约为24.90 mg·g–1, 表明绝大部分的磷被水铁矿吸附; 而当pH为11.0时, 磷的总吸附量下降至6.59~11.59 mg·g–1(图 3a)。这是由于pH升高, 水铁矿表面的正电荷减少, 不利于磷酸根离子和水铁矿表面羟基间发生配体交换[7]。碱性条件下, 氢氧根离子与磷酸根离子也会发生吸附位点的竞争从而降低磷的吸附。Chitrakar等[33]的研究也表明, 磷在针铁矿和四方纤铁矿上的吸附也有类似规律。在pH 3.0时, 由于磷的大量吸附, 无法看出离子强度对磷在水铁矿上吸附的影响; 在pH>3.0时, 水铁矿对磷的吸附量随着离子强度的增加而增加(100 mmol∙L–1 NaCl处理>10 mmol∙L–1 NaCl处理> 1 mmol∙L–1 NaCl处理)。相邻离子强度间吸附量差值约为1.5~2.5 mg·g–1。王慧等[34]也发现磷在针铁矿和赤铁矿表面的吸附量随离子强度的增加而增加。

|
图 3 不同pH和离子强度下水铁矿吸附磷能力(a)及磷在水铁矿固相、胶体相和液相中的分布(b) Fig. 3 Adsorption of phosphorus on ferrihydrite (a) and the distribution of phosphorus in solid, colloidal, and liquid phases of ferrihydrite (b) under different pH and ionic strength PL、PC和PS分别为液相磷、胶体相磷和固相吸附磷。PL, PC, and PS represent phosphorus fractions in solution, colloid, and solid, respectively. |
磷在水铁矿胶体上的吸附比例随着pH的升高而增加(图 3b)。在pH为3.0时, 不同离子强度背景下水铁矿胶体对磷吸附比例仅为1.1%~1.7%;而pH为7.0~9.0时, 中低离子强度下(1 mmol∙L–1和10 mmol∙L–1 NaCl)水铁矿胶体吸附比例增加至7.1%~18.3%, 胶体结合态磷的量相当可观。随着pH上升, 水铁矿胶体所带负电荷增加, 吸附带负电的磷酸根离子难度增大, 然而水铁矿胶体对磷的吸附量却明显增加, 这也表明水铁矿胶体对磷吸附的主要机理, 并不仅是依靠静电作用, 化学吸附才是主要的吸附机理[26]。此外, 水铁矿胶体在中低离子强度和高pH下的分散特性也是胶体吸附磷增加的原因, 胶体间分散而不容易发生聚集, 导致更多比表面积高的小粒径胶体吸附更多的磷。对于中等离子强度(10 mmol∙L–1 NaCl), 虽然其产生的水铁矿胶体的量不及低离子强度(10 mmol∙L–1 NaCl), 但是较好的胶体分散条件和中等的磷吸附能力(总吸附量)使其吸附的磷的比例最高(1.6%~18.4%)。可见水铁矿胶体总量并不是磷吸附量的唯一决定因素。
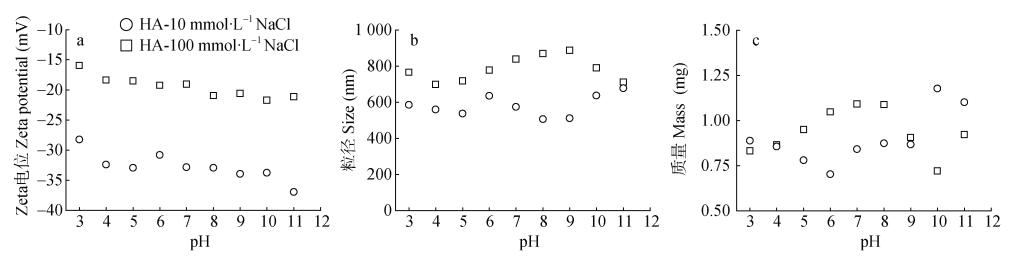
2.4 不同pH和离子强度下吸附磷和胡敏酸(HA)之后的水铁矿胶体的zeta电位和粒径变化100 mg∙L–1 HA存在导致所有条件下水铁矿胶体的zeta电位均为负值, 并保持相对的稳定; 高离子强度下(100 mmol∙L–1 NaCl)水铁矿胶体的zeta电位为-16.0~21.8 mV, 中等离子条件下(10 mmol∙L–1 NaCl)为-28.2~37.0 mV(图 4a)。但碱性条件下的zeta电位没有比无HA条件下进一步降低(图 2a和4a)。由于高离子强度下稳定的zeta电位, HA存在时水铁矿胶体粒径明显下降(从2026~3327 nm下降至699~887 nm, 图 4b)。而中高离子强度下(10和100 mmol∙L–1 NaCl), 产生的水铁矿胶体的量相对稳定(0.70~1.18 mg)(图 4c), 相比HA不存在时(0.60~1.41 mg, 图 2c), 总体上略有减少。磷的吸附已经使水铁矿悬浊液的分散程度达到较好的状态, HA没能进一步增强分散性, 反而微弱增加了体系中的异质凝聚。
|
图 4 不同pH和离子强度下吸附磷和HA之后的水铁矿胶体zeta电位(a)、粒径(b)和质量(c)变化 Fig. 4 Effect of humic acid on the zeta potential (a), particle size (b), and mass (c) of ferrihydrite colloid under different pH and ionic strength |
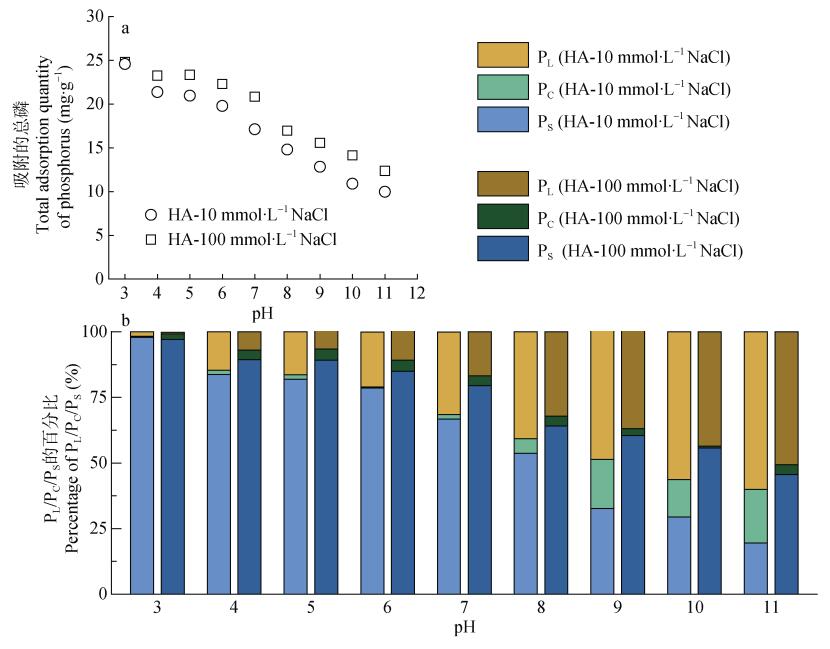
HA存在时, 水铁矿固相对磷的总吸附量从24.59~24.80 mg·g–1 (pH 3.0)下降至9.97 mg·g–1(pH 11.0, 10 mmol∙L–1 NaCl)和12.35 mg·g–1 (pH 11.0, 100 mmol∙L–1 NaCl) (图 5a), 此变化趋势与无HA处理相同(图 3a)。pH变化过程中, 水铁矿对磷的总吸附量与无HA时相比平均增加0.6~0.7 mg·g–1(图 3a和图 5a)。Weng等[15]对HA存在时针铁矿对磷的吸附研究中发现, HA的存在会影响磷在针铁矿表面的结合形式, 导致部分双齿配合会转变为单齿配合。这可能是本研究中水铁矿表面磷吸附量增加的原因。水铁矿胶体吸附磷的比例变化趋势与无HA时也十分相似。当pH大于7.0时, 中等离子强度(10 mmol∙L–1 NaCl)磷在水铁矿胶体上的吸附比例很大(5.5%~20.4%)。
|
图 5 不同pH和离子强度下胡敏酸对水铁矿吸附磷(a)及磷在水铁矿固相、胶体相和液相中分布(b)的影响 Fig. 5 Effect of humic acie on the adsorption of phosphorus on ferrihydrite (a) and the distribution of phosphorus in solid, colloidal, and liquid phases of ferrihydrite (b) under different pH and ionic strength PL、PC和PS分别为液相磷、胶体相磷和固相吸附磷。PL, PC, and PS represent phosphorus fractions in solution, colloid, and solid, respectively. |
基于DLVO理论, 本研究计算了磷-水铁矿胶体之间的相互作用能随距离的变化。除个别低pH外, 1 mmol∙L–1和10 mmol∙L–1 NaCl以及100 mg∙L–1 HA存在时10 mmol∙L–1 NaCl条件下, 胶体之间具有较明显的一级势垒(118.6~513.1 kt)(图 6a, 6b和6d)。胶体凝聚的一个重要途径就是突破一级势垒, 而较高的一级势垒使胶体体系处于比较稳定的状态。胶体间的一级势垒主要是由胶体之间的静电斥力主导的[20], 因此较大绝对值的负zeta电位对胶体的稳定性起着决定性作用。由于pH控制胶体的粒径和zeta电位, 因此同样控制胶体之间的作用力。在稳定体系中, 一级势垒随pH的升高而升高, 胶体分散性逐渐增强。在高离子强度下(100 mmol∙L–1 NaCl), 由于胶体的双电层被压缩, zeta电位绝对值较小, 静电斥力较弱; 而粒径主导的范德华引力相对较大, 因此胶体之间难以出现一级势垒(图 6c)。虽然HA存在时, 高pH条件下胶体间出现了一级势垒, 但此势垒较低(20.6~25.5 kt), 难以保证胶体长期处于稳定状态。

|
图 6 pH、离子强度和胡敏酸水铁矿胶体之间DLVO作用力的影响 Fig. 6 Effect of pH, ionic strength, and humic acid on DLVO force between ferrihydrite colloid |
众多研究表明, 带负电荷的水铁矿胶体可在土壤或含水层等带负电的含水介质中长距离迁移[11, 14, 19, 35]。在这些研究中, 水铁矿胶体带负电的原因多是由于HA等有机质的吸附引起的。和吸附HA相似, 本研究证实了水铁矿吸附磷之后也能改变其表面电性, 使其带负电, 从而有利于其在天然含水介质中稳定和迁移。稳定性较好的小粒径胶体颗粒不容易被含水介质滤除, 从而得以进行长距离的迁移[36]。越来越多的研究发现, 磷在自然界中的移动受胶体迁移的促进[21-24], 这些结果也从侧面证明了磷和水铁矿胶体共迁移的可能性。在实际农业活动中, 磷肥的过量施用可能会使大量的磷酸根离子吸附在铁矿物上, 促进土壤孔隙水中形成稳定的、带负电的铁矿物胶体, 这种磷-铁矿物复合胶体的迁移很可能成为磷迁移的另一种形式。本研究定性预测了不同pH、离子强度和HA条件下, 磷-水铁矿胶体的产生和迁移能力, 可为胶体促进下磷淋失风险评估提供理论和数据支撑。但对于复杂的土壤体系, 共存离子的螯合作用和沉淀作用也可能对磷-铁矿物复合胶体归趋产生重要影响, 需要进一步考察。
假二级动力学模型更适合用于描述磷在水铁矿上的吸附过程(R2=0.964), 吸附受液膜扩散、内部扩散和化学吸附等过程控制。Freundlich模型(R2=0.970)对等温吸附的拟合效果较好, 水铁矿对磷的吸附为多层吸附。从Langmuir模型参数中可得, 水铁矿对磷的最大理论吸附量Qm为22.55 mg∙g–1。
水铁矿对磷的吸附随pH的升高而降低, 随离子强度的升高而升高。然而, 低离子强度和高pH有利于反应体系中水铁矿胶体的释放。HA存在时, 磷在水铁矿上的总吸附量略有增加。在碱性且离子强度不高(1~10 mmol∙L–1)条件下, 有约5%~20%的磷会与水铁矿胶体结合。
无论胡敏酸是否存在, 碱性土壤环境中, 中低离子强度条件下, 磷-水铁矿胶体之间的静电斥力较大, 胶体稳定性较好, 有一定的迁移能力。
| [1] |
HOLFORD I C R. Soil phosphorus:its measurement, and its uptake by plants[J]. Australian Journal of Soil Research, 1997, 35(2): 227-240. DOI:10.1071/S96047 |
| [2] |
SATTARI S Z, BOUWMAN A F, GILLER K E, et al. Residual soil phosphorus as the missing piece in the global phosphorus crisis puzzle[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(16): 6348-6353. DOI:10.1073/pnas.1113675109 |
| [3] |
LI H, HUANG G, MENG Q, et al. Integrated soil and plant phosphorus management for crop and environment in China. A review[J]. Plant and Soil, 2011, 349(1/2): 157-167. |
| [4] |
VON WANDRUSZKA R. Phosphorus retention in calcareous soils and the effect of organic matter on its mobility[J]. Geochemical Transactions, 2006, 7(1): 6. DOI:10.1186/1467-4866-7-6 |
| [5] |
马玉玲, 马杰, 陈雅丽, 等. 水铁矿及其胶体对砷的吸附与吸附形态[J]. 环境科学, 2018, 39(1): 179-186. MA Y L, MA J, CHEN Y L, et al. Arsenic adsorption and its species on ferrihydrite and ferrihydrite colloid[J]. Environmental Science, 2018, 39(1): 179-186. |
| [6] |
崔蒙蒙, 刘锋, 黄天寅, 等. 水铁矿吸附磷酸根的影响因素[J]. 环境工程学报, 2017, 11(4): 2285-2290. CUI M M, LIU F, HUANG T Y, et al. Influence factors of ferrihydrite adsorbing phosphate radical[J]. Chinese Journal of Environmental Engineering, 2017, 11(4): 2285-2290. |
| [7] |
ANTELO J, ARCE F, FIOL S. Arsenate and phosphate adsorption on ferrihydrite nanoparticles. Synergetic interaction with calcium ions[J]. Chemical Geology, 2015, 410: 53-62. DOI:10.1016/j.chemgeo.2015.06.011 |
| [8] |
MA Y L, MA J, PENG H, et al. Effects of iron, calcium, and organic matter on phosphorus behavior in fluvo-aquic soil:Farmland investigation and aging experiments[J]. Journal of Soils and Sediments, 2019, 19(12): 3994-4004. DOI:10.1007/s11368-019-02354-y |
| [9] |
DAS S, HENDRY M J, ESSILFIE-DUGHAN J. Adsorption of selenate onto ferrihydrite, goethite, and lepidocrocite under neutral pH conditions[J]. Applied Geochemistry, 2013, 28: 185-193. DOI:10.1016/j.apgeochem.2012.10.026 |
| [10] |
SAJIH M, BRYAN N D, LIVENS F R, et al. Adsorption of radium and barium on goethite and ferrihydrite:A kinetic and surface complexation modelling study[J]. Geochimica et Cosmochimica Acta, 2014, 146: 150-163. DOI:10.1016/j.gca.2014.10.008 |
| [11] |
MA J, GUO H M, WENG L P, et al. Distinct effect of humic acid on ferrihydrite colloid-facilitated transport of arsenic in saturated media at different pH[J]. Chemosphere, 2018, 212: 794-801. DOI:10.1016/j.chemosphere.2018.08.131 |
| [12] |
SAXENA K, BRIGHU U, CHOUDHARY A. Coagulation of humic acid and kaolin at alkaline pH:Complex mechanisms and effect of fluctuating organics and turbidity[J]. Journal of Water Process Engineering, 2019, 31: 100875. DOI:10.1016/j.jwpe.2019.100875 |
| [13] |
WANG D J, BRADFORD S A, HARVEY R W, et al. Transport of ARS-labeled hydroxyapatite nanoparticles in saturated granular media is influenced by surface charge variability even in the presence of humic acid[J]. Journal of Hazardous Materials, 2012, 229/230: 170-176. DOI:10.1016/j.jhazmat.2012.05.089 |
| [14] |
MA J, GUO H M, LEI M, et al. Enhanced transport of ferrihydrite colloid by chain-shaped humic acid colloid in saturated porous media[J]. Science of the Total Environment, 2018, 621: 1581-1590. DOI:10.1016/j.scitotenv.2017.10.070 |
| [15] |
WENG L P, VAN RIEMSDIJK W H, HIEMSTRA T. Humic nanoparticles at the oxide-water interface:Interactions with phosphate ion adsorption[J]. Environmental Science & Technology, 2008, 42(23): 8747-8752. |
| [16] |
KOSMULSKI M. Compilation of PZC and IEP of sparingly soluble metal oxides and hydroxides from literature[J]. Advances in Colloid and Interface Science, 2009, 152(1/2): 14-25. |
| [17] |
KOSMULSKI M. IEP as a parameter characterizing the pH-dependent surface charging of materials other than metal oxides[J]. Advances in Colloid and Interface Science, 2012, 171/172: 77-86. DOI:10.1016/j.cis.2012.01.005 |
| [18] |
ANGELICO R, CEGLIE A, HE J Z, et al. Particle size, charge and colloidal stability of humic acids coprecipitated with ferrihydrite[J]. Chemosphere, 2014, 99: 239-247. DOI:10.1016/j.chemosphere.2013.10.092 |
| [19] |
LIAO P, LI W L, WANG D J, et al. Effect of reduced humic acid on the transport of ferrihydrite nanoparticles under anoxic conditions[J]. Water Research, 2017, 109: 347-357. DOI:10.1016/j.watres.2016.11.069 |
| [20] |
王智巧, 马杰, 陈雅丽, 等. 不同环境条件下水铁矿和针铁矿纳米颗粒稳定性[J]. 环境科学, 2020, 41(5): 2292-2300. WANG Z Q, MA J, CHEN Y L, et al. Stability of ferrihydrite and goethite nanoparticles under different environmental conditions[J]. Environmental Science, 2020, 41(5): 2292-2300. |
| [21] |
BAKEN S, REGELINK I C, COMANS R N J, et al. Iron-rich colloids as carriers of phosphorus in streams:A field-flow fractionation study[J]. Water Research, 2016, 99: 83-90. DOI:10.1016/j.watres.2016.04.060 |
| [22] |
MISSONG A, HOLZMANN S, BOL R, et al. Leaching of natural colloids from forest topsoils and their relevance for phosphorus mobility[J]. Science of the Total Environment, 2018, 634: 305-315. DOI:10.1016/j.scitotenv.2018.03.265 |
| [23] |
PANG L P, LAFOGLER M, KNORR B, et al. Influence of colloids on the attenuation and transport of phosphorus in alluvial gravel aquifer and vadose zone media[J]. Science of the Total Environment, 2016, 550: 60-68. DOI:10.1016/j.scitotenv.2016.01.075 |
| [24] |
VANDEVOORT A R, LIVI K J, ARAI Y. Reaction conditions control soil colloid facilitated phosphorus release in agricultural Ultisols[J]. Geoderma, 2013, 206: 101-111. DOI:10.1016/j.geoderma.2013.04.024 |
| [25] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2016. BAO S D. Soil and Agricultural Chemistry Analysis[M]. Beijing: China Agriculture Press, 2016. |
| [26] |
王慧.铁氧化物及其胡敏酸复合体对磷酸盐的吸附研究[D].武汉: 华中农业大学, 2015 WANG H. Phosphate adsorption on iron oxides and iron oxides-humic acid complexes[D]. Wuhan: Huazhong Agricultural University, 2015 |
| [27] |
ANTELO J, ARCE F, AVENA M, et al. Adsorption of a soil humic acid at the surface of goethite and its competitive interaction with phosphate[J]. Geoderma, 2007, 138(1/2): 12-19. |
| [28] |
陈雯, 刘玲, 周建伟. 三种氧化铁吸附水环境中砷的试验研究[J]. 环境科学与技术, 2009, 32(1): 63-67. CHEN W, LIU L, ZHOU J W. Experimental study on adsorption of arsenic in aqueous system with three iron oxides[J]. Environmental Science & Technology, 2009, 32(1): 63-67. |
| [29] |
KOOPAL L K. Mineral hydroxides:From homogeneous to heterogeneous modelling[J]. Electrochimica Acta, 1996, 41(14): 2293-2305. DOI:10.1016/0013-4686(96)00059-X |
| [30] |
DENG Y X, LI Y T, LI X J, et al. Influence of calcium and phosphate on pH dependency of arsenite and arsenate adsorption to goethite[J]. Chemosphere, 2018, 199: 617-624. DOI:10.1016/j.chemosphere.2018.02.018 |
| [31] |
姜军, 徐仁扣. 离子强度对三种可变电荷土壤表面电荷和Zeta电位的影响[J]. 土壤, 2015, 47(2): 422-426. JIANG J, XU R K. Effects of ionic strengths on surface charge and ζ potential of three variable charge soils[J]. Soil, 2015, 47(2): 422-426. |
| [32] |
PETOSA A R, JAISI D P, QUEVEDO I R, et al. Aggregation and deposition of engineered nanomaterials in aquatic environments:Role of physicochemical interactions[J]. Environmental Science & Technology, 2010, 44(17): 6532-6549. |
| [33] |
CHITRAKAR R, TEZUKA S, SONODA A, et al. Phosphate adsorption on synthetic goethite and akaganeite[J]. Journal of Colloid and Interface Science, 2006, 298(2): 602-608. |
| [34] |
王慧, 易珊, 付庆灵, 等. 铁氧化物-胡敏酸复合物对磷的吸附吸附[J]. 植物营养与肥料学报, 2012, 18(5): 1144-1152. WANG H, YI S, FU Q L, et al. Phosphorus adsorption of iron oxides-humic acid compounds[J]. Plant Nutrition and Fertilizer Science, 2012, 18(5): 1144-1152. |
| [35] |
QIAN X Y, MA J, WENG L P, et al. Influence of agricultural organic inputs and their aging on the transport of ferrihydrite nanoparticles:From enhancement to inhibition[J]. Science of the Total Environment, 2020, 719: 137440. |
| [36] |
WANG D J, JIN Y, JAISI D P. Effect of size-selective retention on the cotransport of hydroxyapatite and goethite nanoparticles in saturated porous media[J]. Environmental Science & Technology, 2015, 49(14): 8461-8470. |
 2021, Vol. 29
2021, Vol. 29



