2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
在农业生产中, 合理施用氮肥在保障粮食作物稳产、增产中起着重要作用。然而, 随着集约化农业发展进程的加快, 过量施用氮肥的现象日益增加, 由此引起的土壤硝酸盐累积、地下水硝酸盐污染、温室气体排放以及土壤酸化等问题日趋严重[1]。华北平原农田区作为我国主要的粮食主产区之一, 氮肥年施用量高达500 kg(N)∙hm-2∙a-1[2], 远超作物“最适的”氮肥需求量[286 kg(N)∙hm-2∙a-1][3]。目前, 该地区农业氮肥施用已造成0~12 m土壤剖面硝酸盐的大量累积, 成为潜在的污染源, 最终通过强降雨或灌溉进入地下水, 造成污染[4]。已有研究表明典型厚包气带农田区浅层地下水中硝酸盐污染超标率高达50%, 而深层地下水中硝酸盐的污染程度也在逐年加剧[5]。因此, 如何削减厚包气带土壤硝酸盐污染是集约化农田区面临的最重要问题。
包气带是指地表到地下水之间的非饱和带, 既是土壤硝酸盐淋失的通道, 也是土壤硝酸盐累积、转化和削减的场所。其中, 土壤硝酸盐自修复作用是削减厚包气带土壤累积硝酸盐的重要途径。土壤中的反硝化微生物, 可将土壤中累积的硝酸盐或亚硝酸盐还原为气态产物(N2O、NO和N2)[6], 又经土壤孔隙消散到大气中, 完成厚包气带土壤硝酸盐污染的自修复过程, 是阻控厚包气带土壤硝酸盐淋失的有效途径。研究表明, 反硝化细菌约占土壤微生物总数的5%[7], 但并不是所有的反硝化细菌都具有完全反硝化能力, 有些反硝化细菌在反硝化过程中会产生N2O等中间产物。N2O会对臭氧层造成破坏, 是导致全球变暖现象出现的主要温室气体之一[8], 它吸收热量的能力是CO2的300倍[9]。因此筛选具有完全反硝化能力的菌株, 将累积的硝酸盐最终还原为N2, 对削减包气带土壤累积的硝酸盐具有重要的应用价值。
目前, 国内外关于反硝化微生物的报道多来自于表层土壤[10-11], 例如王惠芬等[12]通过采集表层3~5 cm的土壤分离出6株具有反硝化能力菌株。陈寒玉等[13]从蔬菜大棚表层0~20 cm的土壤分离出1株反硝化细菌并进行土壤脱氮效果研究。Falk等[14]从表层0~10 cm的土壤筛选出490株细菌, 其中8株菌株携带nirK功能基因。尽管包气带微生物具有提高反硝化活性的潜力, 但目前对厚包气带及含水层土壤中反硝化微生物的研究相对较少。此外, 土壤微生物的反硝化过程受土壤含水量、温度、硝酸盐浓度以及可利用碳等因素的影响, 其中土壤pH对微生物反硝化过程尤为重要[15]。有研究表明, 过量施氮肥会导致土壤pH降低, 造成土壤N2O排放速度加快[15-16]。Šimek等[17]研究表明在酸性土壤中反硝化作用生成的N2O/N2的比例高于碱性土壤。
本研究依托中国科学院栾城农业生态系统试验站, 从农田包气带及含水层土壤中筛选到62株细菌。采用16S rRNA基因序列分析对菌株进行初步鉴定, 同时选取代表性菌株对其生长和反硝化特性进行初步分析, 旨在为微生物强化治理厚包气带土壤硝酸盐污染的应用提供菌种资源和理论依据。
1 材料与方法 1.1 样品采集本研究依托中国科学院栾城农业生态系统试验站, 该试验站位于河北省石家庄市栾城区(37°53′N, 114°41′E), 海拔50.1 m, 属暖温带半湿润季风气候, 土壤类型以潮褐土为主。长期施氮肥定位试验始于1997年, 供试土壤采集于长期施氮量为600 kg(N)∙hm-2∙a-1的处理。土壤样品采集于2016年6月, 利用Geoprobe (Geoprobe Model 54D, 美国)土壤深层采样机钻取0~150 m的土壤样品, 根据土壤质地, 选取代表性土层进行微生物分离。土壤样品分为13.3~16.0 m (L1)、16.0~20.0 m (L2)、30.2~ 39.0 m (L3)、44.0~50.0 m (L4)、50.0~54.0 m (L5)、65.0~70.0 m (L6)、70.0~80.0 m (L7)、81.0~91.0 m (L8)、91.0~96.0 m (L9)、107.0~110.0 m (L10)、117.0~120.0 m (L11)、120.0~126.7 m (L12)、129.0~ 130.3 m (L13)和141.0~150.0 m (L14)共14个土层。分别将上述各土壤剖面土柱样品混匀后装入自封袋, 并置于冰上, 运回实验室进行微生物筛选工作。
1.2 反硝化细菌的筛选与鉴定 1.2.1 培养基固体TSA培养基[18]:胰蛋白胨15.0 g, 大豆蛋白胨5.0 g, 氯化钠5.0 g, 琼脂15.0 g, 加蒸馏水至1.0 L。
液体TSB培养基[18]:胰蛋白胨15.0 g, 大豆蛋白胨5.0 g, 氯化钠5.0 g, 加蒸馏水至1.0 L。
固体LB培养基:胰蛋白胨10.0 g, 酵母粉5.0 g, 氯化钠5.0 g, 琼脂15.0 g, 加蒸馏水至1.0 L。
土壤浸提液培养基:牛肉膏3.0 g, 胰蛋白胨5.0 g, 琼脂15.0 g, 土壤浸汁1.0 L。
所有培养基均调节pH至7.2~7.4, 121 ℃、30 min高压蒸汽灭菌。
1.2.2 反硝化细菌的分离与纯化采用平板稀释涂布法分离反硝化细菌:称取5.0 g新鲜土壤加入无菌水20 mL, 28 ℃, 180 r∙min-1摇床振荡1 h后, 取出静置。取上清液并用无菌水进行稀释, 稀释梯度为10-2和10-3。将稀释后的土壤上清液分别涂布在含有KNO3(2 mmol∙L-1)的TSA培养基、LB培养基和土壤浸提液培养基中, 置于厌氧培养袋中于28 ℃恒温培养箱中培养。根据菌落颜色、形态等挑选单菌落, 并经多次划线纯化后, 将纯化后的单菌落接种于液体培养基中, 过夜培养后, 采用甘油水溶液(50%)保存于-80 ℃冰箱中。
1.3 细菌的鉴定 1.3.1 分子生物学鉴定对于细菌16S rRNA基因的扩增, 选用细菌的通用引物对27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)[19]。PCR扩增体系50 μL, 包括2×GoldStar-Mix (康为世纪, 北京) 25 μL, 正反向引物各0.5 μL (10 μM), DNA模板1 μL, 灭菌超纯水23 μL。PCR扩增程序如下: 95 ℃预变性5 min; 95 ℃变性1 min, 55 ℃退火1 min; 72 ℃延伸2 min, 30个循环; 72 ℃延伸10 min。PCR扩增产物由生工生物工程股份有限公司测序完成, 测序结果在NCBI网站进行BLAST在线比对, 并使用MEGA 4.0[20]软件构建系统发育树。
1.3.2 反硝化功能测定预培养阶段: 250 mL三角瓶中加入50 mL 1/10 TSB液体培养基, 分别接种纯化后的菌株, 接菌量为1 mL。置于磁力搅拌器上, 700 r∙min-1, 28 ℃恒温培养。培养10 h后, 采用紫外可见分光光度计(UV- 6100S, 上海)测定菌液在600 nm处的吸光度值(OD600), 并确保该值小于0.5。
反硝化功能测定: 120 mL血清瓶中加入50 mL 1/10 TSB培养基(含KNO3 2 mmol∙L-1), 使用丁基胶塞和中空铝盖进行密封。利用真空抽洗气装置将血清瓶内的空气置换为氦气, 并添加1%的氧气, 加快反硝化细菌的增殖速度。按照吸光值×接种量= 0.5的原则, 将菌液接种于血清瓶内, 立即将血清瓶置于气体自动采样培养装置[21], 700 r∙min-1, 28 ℃恒温培养, 采用气相色谱仪(Agilent 7890A, 美国)测定血清瓶内的N2O和N2的浓度, 每隔2 h进行一次采样。
1.3.3 形态特征检测细菌电镜照片采用逐点成像的方法, 将样品图像特征按顺序成比例的转化为图像信号。具体过程为预先向培养皿中放入尺寸大小不同的盖玻片, 加入适量TSB液体培养基并接种目的菌种, 密封后28 ℃恒温培养至对数生长期。移液器缓缓移除菌液, 只保留盖玻片和菌团, 加入10 mL PBS溶液(NaCl 8 g∙L-1; KCl 0.2 g∙L-1; Na2HPO4 1.44 g∙L-1; KH2PO4 0.24 g∙L-1, pH 7.4)清洗菌体。加15 mL戊二醛溶液(2.5%)进行室温避光固定。再用乙醇脱水后, 即刻用临界点干燥仪(Leika EM CPD300, 德国)干燥1.5 h。最后将干燥后的盖玻片固定在铜台, 使用真空镀膜仪(Leika EM SCD050, 德国)喷金处理后置于扫描电镜(Phenom ProX, 荷兰)的样品台模块, 按照高倍聚焦、低倍成像的顺序进行观察并拍照保存。
1.3.4 细菌运动性检测采用半固体穿刺法对细菌运动性进行检测。50 mL离心管中加入45 mL半固体培养基, 灭菌牙签蘸取菌液后, 刺入半固体培养基中, 拔出牙签, 过夜培养。使用透射光源目测的方式观察细菌运动性, 若观察到细菌仅生长在穿刺线上, 且存在明显的边缘界限, 则表示细菌不具有运动特性; 反之, 若观察到细菌沿着穿刺线向其四周生长扩散并呈现云雾状, 则表示细菌具有运动性。
1.4 pH对反硝化细菌功能的影响120 mL血清瓶中加入50 mL 1/10 TSB培养基, 添加KNO3终浓度为2 mmol∙L-1, 分别通过磷酸缓冲液调节pH为5.8、6.2、6.6、7.0、7.4和7.8, 接种具有完全反硝化能力的菌株L103, 接菌量为1 mL, 将血清瓶置于气体自动采样培养装置[21], 700 r∙min-1, 28 ℃恒温培养, 使用气相色谱仪(Agilent 7890A, 美国)测定血清瓶内的N2O和N2的浓度, 每隔2 h进行一次采样。
2 结果与分析 2.1 分离纯化的反硝化菌株本试验共筛选得到62株潜在的反硝化菌株, 16S rRNA基因序列构建的系统发育树结果如图 1所示, 筛选到的62株菌株分别与变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)中的9个属, 即与不动细菌属(Acinetobacter, 35株)、假单胞菌属(Pseudomonas, 15株)、阴沟肠杆菌属(Enterobacter, 3株)、丛毛单胞菌属(Comamonas, 3株)、微球菌属(Micrococcus, 2株)、芽孢杆菌属(Bacillus, 1株)、类芽孢杆菌属(Paenibacillus, 1株)、副球菌属(Paracoccus, 1株)以及氢噬胞菌属(Hydrogenophaga, 1株)具有较高的同源性。根据所构建的系统发育树的结果, 挑选其中7株亲缘关系较远的菌株(L37、L71、L96、L103、L104、L133和L13)进行后续反硝化功能研究。
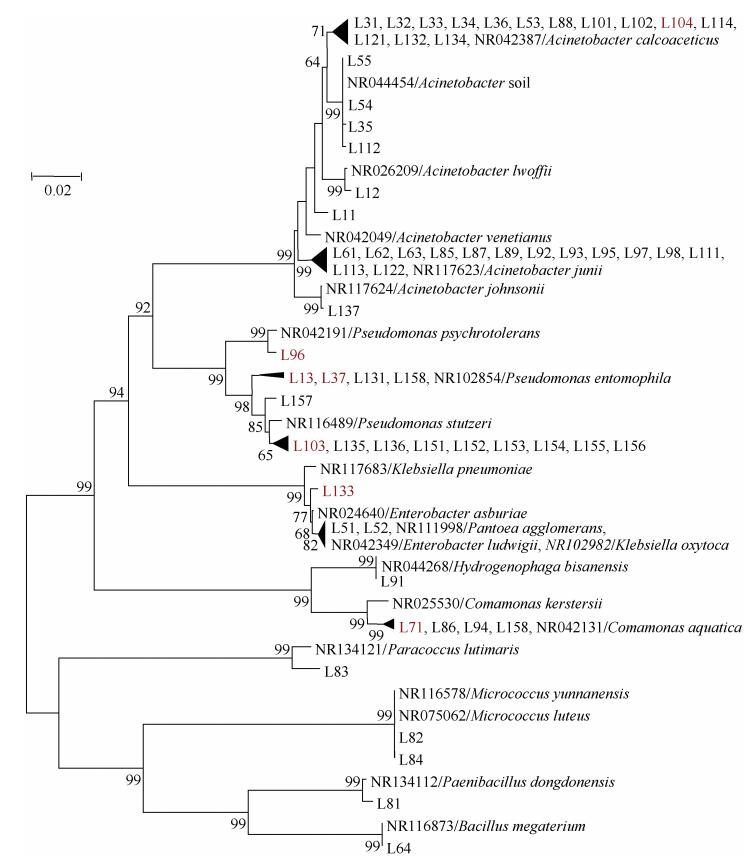
|
图 1 基于16S rRNA基因序列的筛选得到62株潜在反硝化菌株的系统进化树 Fig. 1 Phylogenetic tree of screened 62 potential denitrifying strains based on 16S rRNA gene sequences analysis |
选取菌株L37、L71、L96、L103、L104、L133和L13进行反硝化功能试验。结果表明, 在厌氧条件下, 菌株L37、L96、L104和L133均不能产生N2O和N2, 初步推测这些菌株不具备反硝化能力。菌株L71、L13和L103具有反硝化功能(图 2)。其中菌株L71在第4 h开始产生N2O, N2O产生速率从第8 h开始匀速增长, 第18 h反应结束。菌株L13在第3 h开始产生N2O, N2O产生速率从第5 h开始匀速增长, 第8 h反应结束。此外, 菌株L103是唯一能够在反硝化过程中产生N2的反硝化细菌, 从第4 h开始产生N2O, 第9 h达峰值, 随后N2O浓度迅速下降, 到第10 h N2O浓度为0;而N2在第7 h开始产生, 第10 h N2产量达峰值。结果表明, 菌株L103具备完全反硝化能力, 经计算得到其反硝化速率高达1.62~2.36 g(KNO3)·d-1·L-1。

|
图 2 菌株L71、L13和L103的反硝化潜势 Fig. 2 Denitrification potentials of the selected strains L71, L13 and L103 |
电镜观察结果表明, 反硝化菌株L71、L13和L103均为杆状细菌, 长度分别为1.0 μm、1.5 μm和1.5 μm, 且都不具有鞭毛(图 3)。菌株运动性试验结果表明(表 1), 菌株L71和L13仅在穿刺物的位置上生长, 与半固体培养基存在明显界限, 说明菌株L71和L13没有运动能力。而菌株L103则沿着穿刺物中心向其四周呈现云雾状扩散, 与培养基界限不明显, 表明菌株L103具有运动能力。
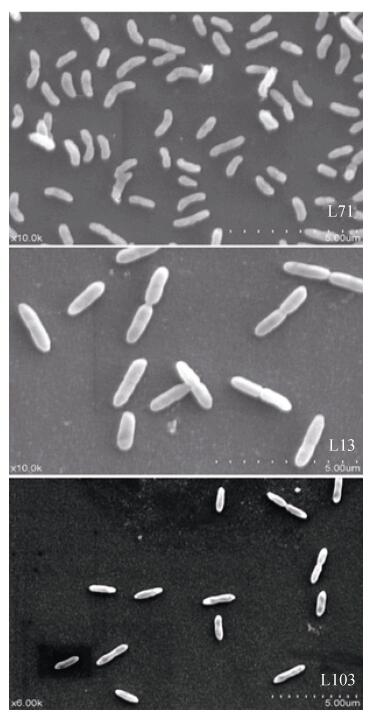
|
图 3 菌株L71、L13和L103的细菌形态特征 Fig. 3 Morphological characteristics of the selected strains L71, L13 and L103 |
| 表 1 菌株L71、L13和L103的生物学特性 Table 1 Biological features of the selected strains L71, L13 and L103 |
菌株L103在pH 5.8、6.2、6.6、7.0、7.4和7.8条件下的反硝化功能结果如表 2所示。在pH 7.8条件下反硝化速率最大, 最大反硝化速率随着pH的降低而降低。在pH 6.2和pH 5.8条件下菌株L103的反硝化活性受到抑制。因此挑选pH 6.6和pH 7.4条件下, 添加1%的氧气, 进一步探究菌株L103在反硝化过程中NO、N2O、N2和O2的变化情况(图 4)。结果表明, 在pH 7.4的条件下, O2在第12 h时完全耗尽, 第6 h开始产生NO、N2O和N2。NO在第8 h时达到峰值, 随后NO浓度降低, 到第10 h, 浓度降为0。N2O在第10 h达到峰值, 之后浓度降低, 在第12 h时产量为0。而N2在第8 h产生速率逐渐加快, 之后保持稳定, 直到第12 h时浓度不再增加。在pH 6.6的条件下, O2在第20 h时完全耗尽, NO的峰值出现在第28 h。N2O则在第10 h和第45 h出现峰值, 最大峰值出现在第45 h, 之后浓度快速下降, 到第55 h时浓度为0。N2则是在第28 h时才开始产生, 并在第58 h时达到峰值。上述结果可以表明, 与pH 7.4相比, 菌株在pH 6.6的条件下反硝化活性受到抑制。
| 表 2 菌株L103在不同pH下将KNO3还原成N2所需时间及最大反硝化速率 Table 2 Time consumed to reduce KNO3 to N2 and max denitrification rate of the strain L103 at different pH |
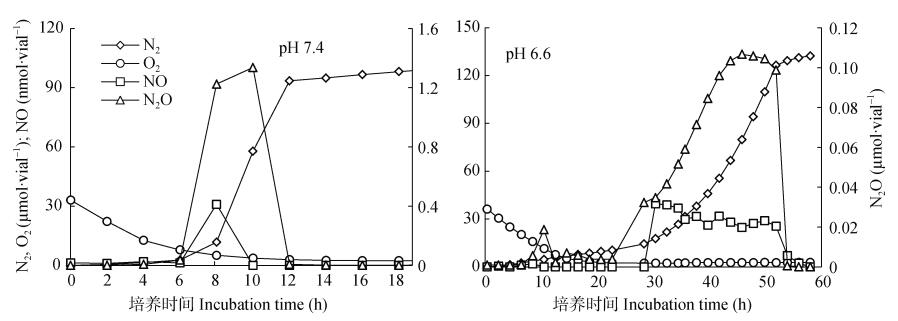
|
图 4 菌株L103在pH 7.4和pH 6.6下的反硝化潜势 Fig. 4 Denitrification potential of the strain L103 at pH 6.6 and pH 7.4 |
本研究从华北平原长期施氮肥的农田厚包气带土壤及含水层中共筛选到62株潜在的反硝化细菌, 测序结果表明这62株菌株分别与变形菌门、放线菌门、厚壁菌门中的9个属具有较高的同源性。深层包气带土壤中环境因子和微生物群落结构与表层土壤存在很大差异[22]。尽管表层土壤中人为施肥、动植物残体的分解、根系分泌物的产生等因素, 使得表层土壤中富含微生物所需的有机碳等营养元素, 但由于土壤吸附、微生物分解以及作物根系吸收等, 表层土壤中富含的养分很难进入深层土壤中, 这就导致深层土壤环境变得更为贫瘠, 微生物丰度和多样性也变得很低。研究表明, 变形菌门在各种土壤环境中占主导地位, 包括养分受限的环境[22]; 厚壁菌门能够产生孢子, 可抵御恶劣的环境条件[23-24]。此外发现筛选到的这62株菌株中, 35株菌株和15株菌株分别与不动杆菌属及假单胞菌属具有很高的同源性, 这与不动杆菌属[24]和假单胞菌属[22]在反硝化过程中起关键作用的报道一致。Chen等[22]通过反硝化潜势的测定以及反硝化功能基因的定量试验也证实了包气带土壤中反硝化微生物的存在。
集约化农田往往依靠施加大量氮肥和灌溉来提高作物产量, 未被植物利用的氮素会在土壤中累积, 进而通过淋溶进入到地下水, 对地下水水质安全造成威胁[25]。而深层土壤中存在的反硝化微生物可通过微生物的反硝化过程, 完成土壤硝酸盐的自修复, 对削减深层包气带土壤累积的硝酸盐、保障地下水安全具有重要的作用。同时, 包气带土壤微生物的反硝化作用受到多种因素的影响, 比如反硝化微生物的丰度及土壤有机碳、硝态氮和氧气含量等。其中, 土壤有机碳是驱动反硝化作用进行的能源物质, 决定了土壤中反硝化作用的强弱, 是限制深层土壤反硝化作用的关键因素[22]。此外, 自然界中并不是所有的反硝化细菌都具有完全反硝化能力, 土壤中存在完全和不完全反硝化细菌[26], 这些不完全反硝化细菌在反硝化过程中会产生NO、N2O等中间产物, 是环境中N2O主要的排放源[27-28]。在本研究中也发现, 菌株L71和L13是不完全反硝化菌株, 只能将硝酸盐底物还原为N2O。只有菌株L103能够进行完全反硝化能力, 可以将硝酸盐底物完全还原为N2, 其反硝化速率高达1.62~2.36 g (KNO3)·d-1·L-1, 具备实际应用潜力。进一步根据菌株L103的全基因组测序结果表明, 该菌株含有反硝化过程的4个步骤所必需的4种反硝化功能基因[29], 此结果与细菌的反硝化潜势测定结果相吻合。
与此同时, 长期施氮肥引起的土壤酸化问题也日益严重[30]。土壤酸化会加快农田土壤N2O的排放速度, 加剧温室气体的影响[15-17]。本试验中菌株L103在不同pH条件下反硝化潜势的结果表明, 在培养过程中菌株L103的反硝化过程受到pH的影响, 低pH影响反硝化速率, 尤其是N2O还原为N2的速率。有研究发现氮相关功能微生物比较适宜生存在中性或弱碱性环境中[31]。也有研究表明土壤pH可影响反硝化酶Nos的活性, 当pH>7时, 反硝化酶Nos的活性增强, 而当pH < 7时, 反硝化酶Nos的活性降低, 而其他反硝化酶活性增强, 从而导致反硝化过程产生更多的N2O[32]。
综上所述, 本研究结果对理解微生物在土壤硝酸盐污染反硝化自修复过程中的作用机制、利用微生物资源增强包气带土壤硝酸盐污染的自修复过程, 从而削减农田土壤硝酸盐积累具有重要的指导意义。但目前对于反硝化细菌的实际应用还处于探索阶段, 更多的机制和高效反硝化细菌的工程应用尚待深入研究。
| [1] |
ERISMAN J W, GALLOWAY J N, SEITZINGER S, et al. Consequences of human modification of the global nitrogen cycle[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 2013, 368(1621): 20130116. DOI:10.1098/rstb.2013.0116 |
| [2] |
胡春胜, 张玉铭, 秦树平, 等. 华北平原农田生态系统氮素过程及其环境效应研究[J]. 中国生态农业学报, 2018, 26(10): 1501-1514. HU C S, ZHANG Y M, QIN S P, et al. Nitrogen processes and related environmental effects on agro-ecosystem in the North China Plain[J]. Chinese Journal of Eco-Agriculture, 2018, 26(10): 1501-1514. |
| [3] |
JU X T, XING G X, CHEN X P, et al. Reducing environmental risk by improving N management in intensive Chinese agricultural systems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(9): 3041-3046. DOI:10.1073/pnas.0813417106 |
| [4] |
梁慧雅, 王仕琴, 魏守才. 华北山前平原典型厚包气带硝态氮分布累积规律[J]. 土壤, 2017, 49(6): 1179-1186. LIANG H Y, WANG S Q, WEI S C. Nitrate distribution and accumulation in deep unsaturated zone soils in piedmont of North China Plain[J]. Soils, 2017, 49(6): 1179-1186. |
| [5] |
马洪斌, 李晓欣, 胡春胜. 中国地下水硝态氮污染现状研究[J]. 土壤通报, 2012, 43(6): 1532-1536. MA H B, LI X X, HU C S. Status of nitrate nitrogen contamination of groundwater in China[J]. Chinese Journal of Soil Science, 2012, 43(6): 1532-1536. |
| [6] |
ZUMFT W G. Cell biology and molecular basis of denitrification[J]. Microbiology and Molecular Biology Reviews, 1997, 61(4): 533-616. DOI:10.1128/.61.4.533-616.1997 |
| [7] |
HENRY S, BRU D, STRES B, et al. Quantitative detection of the nosZ gene, encoding nitrous oxide reductase, and comparison of the abundances of 16S rRNA, narG, nirK, and nosZ genes in soils[J]. Applied and Environmental Microbiology, 2006, 72(8): 5181-5189. DOI:10.1128/AEM.00231-06 |
| [8] |
CANFIELD D E, GLAZER A N, FALKOWSKI P G. The evolution and future of earth's nitrogen cycle[J]. Science, 2010, 330(6001): 192-196. DOI:10.1126/science.1186120 |
| [9] |
CICERONE R J. Analysis of sources and sinks of atmospheric nitrous oxide (N2O)[J]. Journal of Geophysical Research:Atmospheres, 1989, 94(D15): 18265-18271. DOI:10.1029/JD094iD15p18265 |
| [10] |
王海涛, 郑天凌, 杨小茹, 等. 土壤反硝化的分子生态学研究进展及其影响因素[J]. 农业环境科学学报, 2013, 32(10): 1915-1924. WANG H T, ZHENG T L, YANG X R, et al. Molecular ecology research progress for soil denitrification and research status for its influencing factors[J]. Journal of Agro-Environment Science, 2013, 32(10): 1915-1924. |
| [11] |
方晶晶, 马传明, 刘存富. 反硝化细菌研究进展[J]. 环境科学与技术, 2010, 33(6E): 206-210. FANG J J, MA C M, LIU C F. The advance of study on denitrifying bacteria[J]. Environmental Science & Technology, 2010, 33(6E): 206-210. |
| [12] |
王惠芬, 温展, 张秋玲, 等. 土壤中反硝化细菌的分离与脱氮性能初步研究[J]. 环保科技, 2018, 24(6): 19-24. WANG H F, WEN Z, ZHANG Q L, et al. A preliminary study on the screening of denitrifiers and their denitrification performance in soil[J]. Environmental Protection and Technology, 2018, 24(6): 19-24. |
| [13] |
陈寒玉, 靳慧征, 靳慧霞. 一株好氧反硝化细菌的筛选及对土壤脱氮效果研究[J]. 中国农学通报, 2018, 34(20): 55-62. CHEN H Y, JIN H Z, JIN H X. Screening of an aerobic denitrification strain and its nitrogen removal characteristics for soil[J]. Chinese Agricultural Science Bulletin, 2018, 34(20): 55-62. |
| [14] |
FALK S, LIU B B, BRAKER G. Isolation, genetic and functional characterization of novel soil nirK-type denitrifiers[J]. Systematic and Applied Microbiology, 2010, 33(6): 337-347. |
| [15] |
LIU B B, MORKVED P T, FROSTEGÅRD Å, et al. Denitrification gene pools, transcription and kinetics of NO, N2O and N2 production as affected by soil pH[J]. FEMS Microbiology Ecology, 2010, 72(3): 407-417. |
| [16] |
QU Z, WANG J G, ALMØY T, et al. Excessive use of nitrogen in Chinese agriculture results in high N2O/(N2O+N2) product ratio of denitrification, primarily due to acidification of the soils[J]. Global Change Biology, 2014, 20(5): 1685-1698. |
| [17] |
ŠIMEK M, COOPER J E. The influence of soil pH on denitrification:Progress towards the understanding of this interaction over the last 50 years[J]. European Journal of Soil Science, 2010, 53(3): 345-354. |
| [18] |
LYCUS P, BØTHUN L, BERGAUST L, et al. Phenotypic and genotypic richness of denitrifiers revealed by a novel isolation strategy[J]. The ISME Journal, 2017, 11(10): 2219-2232. |
| [19] |
BAKER G C, SMITH J J, COWAN D A. Review and re-analysis of domain-specific 16S primers[J]. Journal of Microbiological Methods, 2003, 55(3): 541-555. |
| [20] |
TAMURA K, DUDLEY J, NEI M, et al. MEGA4:Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599. |
| [21] |
MOLSTAD L, DÖRSCH P, BAKKEN L R. Robotized incubation system for monitoring gases (O2, NO, N2O, N2) in denitrifying cultures[J]. Journal of Microbiological Methods, 2007, 71(3): 202-211. |
| [22] |
CHEN S M, WANG F H, ZHANG Y M, et al. Organic carbon availability limiting microbial denitrification in the deep vadose zone[J]. Environmental Microbiology, 2018, 20(3): 980-992. |
| [23] |
ONYENWOKE R U, BRILL J A, FARAHI K, et al. Sporulation genes in members of the low G+C Gram-type-positive phylogenetic branch (Firmicutes)[J]. Archives of Microbiology, 2004, 182(2): 182-192. |
| [24] |
STONE M M, KAN J J, PLANTE A F. Parent material and vegetation influence bacterial community structure and nitrogen functional genes along deep tropical soil profiles at the Luquillo Critical Zone Observatory[J]. Soil Biology and Biochemistry, 2015, 80: 273-282. |
| [25] |
马林, 柏兆海, 胡春胜. 科技部"十三五"农业面源和重金属污染农田综合防治与修复技术研发重点专项"农田氮磷淋溶损失污染与防控机制研究"项目正式启动[J]. 中国生态农业学报, 2016, 24(11): 1575-1576. MA L, BAI Z H, HU C S. Research on mechanisms of nitrogen and phosphorus leaching loss and control of farmland[J]. Chinese Journal of Eco-Agriculture, 2016, 24(11): 1575-1576. |
| [26] |
SAMESHIMA-SAITO R, CHIBA K, MINAMISAWA K. Correlation of denitrifying capability with the existence of nap, nir, nor and nos genes in diverse strains of soybean bradyrhizobia[J]. Microbes and Environments, 2006, 21(3): 174-184. |
| [27] |
MINAMIKAWA K, NISHIMURA S, SAWAMOTO T, et al. Annual emissions of dissolved CO2, CH4, and N2O in the subsurface drainage from three cropping systems[J]. Global Change Biology, 2010, 16(2): 796-809. |
| [28] |
PHILIPPOT L, HALLIN S, SCHLOTER M. Ecology of denitrifying prokaryotes in agricultural soil[J]. Advances in Agronomy, 2007, 96: 249-305. |
| [29] |
LIU M S, CHEN S M, WANG S Q, et al. High-quality draft genome sequence of Pseudomonas songnenensis L103, a denitrifier isolated from a 100-meter-deep aquifer in a heavily nitrogen-fertilized agricultural area[J]. Microbiology Resource Announcements, 2019, 8(36): e00373-19. |
| [30] |
GUO J H, LIU X J, ZHANG Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010. |
| [31] |
STEVENS R J, LAUGHLIN R J, MALONE J P. Soil pH affects the processes reducing nitrate to nitrous oxide and di-nitrogen[J]. Soil Biology and Biochemistry, 1998, 30(8/9): 1119-1126. |
| [32] |
RICHARDSON D, FELGATE H, WATMOUGH N, et al. Mitigating release of the potent greenhouse gas N2O from the nitrogen cycle-could enzymic regulation hold the key?[J]. Trends in Biotechnology, 2009, 27(7): 388-397. |
 2021, Vol. 29
2021, Vol. 29



