大气中CO2浓度持续上升, 预计到21世纪中期将达到550 μmol∙mol−1, 到21世纪末将达到700 μmol∙mol−1 (RCP4.5)[1]。极端天气事件(如: 干旱)于此同时发生。干旱严重影响了农业生产, 尤其对半干旱地区雨养农业造成威胁。对于C3作物, 大气CO2浓度升高所引发的“CO2肥效”作用, 常常抑制光呼吸、促进光合生产、对生长发育过程产生一定影响, 进而提高作物生产力。而对于C4作物, 大气CO2浓度增大往往引发作物气孔导度减小, 进而减小作物蒸腾, 有利于提高作物水分利用效率[2-4]。干旱往往抑制作物光合生产、生长发育以及产量形成。研究发现大气CO2浓度升高能减小干旱对作物[如: 小麦(Triticum aestivum)、玉米(Zea mays)和大豆(Glycine max)]生产所引发的不利影响[5-8]。CO2浓度升高使得作物碳固定能力增强, 光呼吸强度降低, 从而提高了作物光合速率, 增加植物净同化率, 进而使根系生物量增多, 增强植物对养分的吸收能力, 进而增强其抗旱性[6-7]。
对于C3和C4作物, 大气CO2浓度升高的“肥效”作用对干旱胁迫下作物光合作用负效应的补偿机制不同。其中, 升高大气CO2浓度常常直接减轻干旱对C3作物光合速率的负效应[9-10]。武海霞等[9]研究发现, 大气CO2浓度升高可以直接缓解轻度水分亏缺对冬小麦净光合速率造成的不利影响, 但随着水分胁迫的增强, 高CO2的“肥效”作用逐渐降低甚至完全消失。对于C4作物, 大气CO2浓度升高常常并不能直接改善作物光合速率, 因为C4作物玉米在目前的大气CO2浓度下是饱和的[11]。但是, 升高的大气CO2浓度会引起C4植物玉米、高粱(Sorghum bicolor)、甘蔗(Saccharum officinarum)及谷子(Setaria italica)等气孔导度的降低, 从而降低了蒸腾速率, 减少了叶片蒸腾量, 间接改善植物水分状态, 促进光合生产过程[3]。研究表明大气CO2浓度升高会降低C4植物玉米和高粱的蒸腾速率, 减少其对土壤水分的需求量, 进而改善水分利用效率和减轻干旱的负效应[12]。Li等[2]研究表明, 升高CO2浓度使谷子所有生育期净光合速率增加, 2014年谷子气孔导度除孕穗期外均增加, 但2015年均减小。升高CO2浓度, 蒸腾速率变化与气孔导度相似, 水分利用率均增加。
干旱胁迫会降低作物光系统Ⅱ的光化学效率, 影响作物体内活性氧自由基代谢和脂膜流动性。作物常常通过增加体内抗氧化物酶活性[如: 过氧化物酶(POD)]来清除活性氧[13], 或者增加可溶性糖和氨基酸含量(如: 脯氨酸等)来调节细胞渗透势[14-15], 进而达到应对干旱胁迫的目的。研究表明升高CO2浓度和干旱的交互作用能够增加大豆抗氧化能力[8], 增强其抗旱性。而其他研究发现升高CO2浓度并不能改善干旱下大豆POD酶活性[8]。关于干旱胁迫对C4植物的影响, 谷子会通过调整其形态发育及生理生化过程来适应干旱。干旱胁迫使灌浆期谷子净光合速率、气孔导度及蒸腾速率都出现极显著下降, 水分利用率得到极显著提高, 渗透调节物质可溶性糖和还原糖含量极显著增加[16]。干旱使糜子(Panicum miliaceum)孕穗期净光合速率、气孔导度及蒸腾速率出现极显著降低, 水分利用率显著升高。干旱使叶片可溶性糖含量极显著提高, 但POD活性无显著变化[17]。
谷子(Setaria italica)属禾本科(Gramineae)狗尾草属(Setaria)植物, 是典型的C4植物, 耐干旱、耐贫瘠、营养价值高、富含多种人体所需微量元素、适应性广, 主要栽种在半干旱的雨养农业区, 是我国主要的粮草兼用作物之一[18-20]。目前已有升高CO2浓度和干旱分别对谷子影响的相关研究, 但是升高CO2浓度和干旱交互作用影响的研究多为C3作物, 二者交互作用对谷子影响的研究还少有报道。另外, 已有研究表明在正常水分供给条件下大气CO2升高能够提高谷子光合作用和水分利用效率[2, 12]。目前我们仍不清楚升高CO2浓度是否能够进一步改善谷子的抗旱性, 有必要明确谷子光合作用以及抗旱相关生理过程对高大气CO2浓度和干旱互作的响应机制, 为谷子应对气候变化提供理论依据。
1 材料与方法 1.1 试验地点及材料试验于开顶式气候室内进行, 该气候室位于山西省晋中市太谷区山西农业大学试验基地(37.42°N, 112.58°E)。气候室包括2个开顶气室, 分别为对照环境CO2+环境温度和升CO2+环境温度2个处理, 每个气室面积4 m×8 m, 高3.2 m。供试谷子品种为‘原平小谷’, 栽种在收纳箱(60 cm×40 cm×35 cm)内, 箱底留5个排水孔。供试土壤类型为褐潮土, pH为8.5, 有机质含量12.3 g∙kg-1, 总氮含量0.81 g∙kg-1, 总磷含量0.69 g∙kg-1, 总钾含量14.5 g∙kg-1。土壤经充分过筛混匀后分装于收纳箱中, 每箱土深28 cm。每个气室种8箱, 每箱种10穴, 每穴播3~5粒种子, 施尿素和磷酸二铵各20 g∙kg-1。出苗后, 定苗为每穴1苗。2015年6月17日播种, 10月4日收获, 全生育期共109 d。
1.2 试验设计试验设置两个大气CO2浓度, 分别为当前大气CO2浓度(CK, 400 μmol∙mol−1)和高大气CO2浓度(ECO2, 600 μmol∙mol−1), 气室CO2浓度通过CO2控制系统(邯郸冀南新区盛炎电子科技有限公司研发)自动控制。两个土壤水分处理分别为干旱(45%~55%田间持水量, 中度干旱胁迫)和正常水分(70%~80%田间持水量)[21]。分别于当前和高大气CO2浓度两个气室进行试验, 两个气室各设4盆干旱处理谷子和4盆正常水分处理谷子, 并排放置4行, 每行各放置1盆干旱处理和1盆正常水分处理谷子。每日通过智能土壤墒情速测仪(SU-SW型, 北京盟创伟业科技有限公司, 中国)监测每盆谷子土壤湿度。每日上午、下午各测定1次, 换算为田间持水量, 使水分处理保持在设定范围。
1.3 试验方法 1.3.1 气体交换参数测定分别在谷子的孕穗期(播种后50 d)和灌浆期(播种后80 d)进行气体交换参数测定。每盆选取代表性植株2株, 每处理选8株。每株选取完全展开的旗叶, 用便携式光合仪(LI-COR 6400, Lincoln Neb, USA)在晴天上午9:00—11:30进行光合测定[22], 测定指标包括净光合速率(PN)、气孔导度(gs)和蒸腾速率(E), 然后计算水分利用效率(WUE), 计算公式为:
| $ {\rm{WUE = }}{P_{\rm{n}}}/E $ | (1) |
测定时使用内置红蓝LED光源, 光量子通量密度(PPFD)设定为1400 μmol∙m-2∙s-1, 叶室温度设定为25 ℃。
1.3.2 叶绿素荧光参数测定将便携式光合仪LI-COR 6400的叶夹更换为叶绿素荧光叶夹, 分别在谷子孕穗期和灌浆期, 每盆选取代表性植株2株, 每处理选8株。每株选取旗叶测定叶绿素荧光参数。于晴天上午8:00—12:00测定光处理下样叶荧光参数并做好标记, 然后将标记的样叶用锡箔纸包好, 进行20 min左右暗处理, 以保证叶片完全的暗适应, 然后测定相应荧光参数。测定的荧光参数包括初始荧光(Fo)、最大荧光(Fm)、光下最小荧光(Fo′)和光下最大荧光(Fm′), 并计算实际光化学效率(ΦPSⅡ)、电子传递效率(ETR)、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)等叶绿素荧光参数, 计算公式为:
| $ {{\mathit{\Phi }_{{\rm{PSII}}}} = \left( {F_{\rm{m}}^\prime \times {F_{\rm{s}}}} \right)/{F_{\rm{m}}}} $ | (2) |
| $ {{\rm{ETR}} = {\rm{PPFD}} \times {\mathit{\Phi }_{{\rm{PSII}}}} \times 0.85 \times 0.5} $ | (3) |
| $ {qP = \left( {F_{\rm{m}}^\prime - {F_{\rm{s}}}} \right)/\left( {F_{\rm{m}}^\prime F_{\rm{o}}^\prime } \right)} $ | (4) |
| $ {{\rm{NPQ}} = {F_{\rm{m}}}/F_{\rm{m}}^\prime - 1} $ | (5) |
在谷子孕穗期进行测定, 每盆选取代表性植株2株, 每处理共8株, 每株取完全展开的旗叶。叶绿素用丙酮∶乙醇∶蒸馏水(4.5∶4.5∶1)的混合液提取, 再用分光光度计(722N, 上海仪电分析仪器有限公司, 中国)分别在波长645 nm、663 nm和652 nm下测定吸光值, 进行叶绿素含量(Chla和Chlb)及类胡萝卜素(Car)含量测定。用愈创木酚比色法测定POD活性, 用酸性茚三酮比色法测定脯氨酸含量[23], 用3, 5-二硝基水杨酸法测定还原糖含量, 蒽酮-硫酸法测定可溶性总糖含量、淀粉含量和纤维素含量[24-25]。
1.4 数据处理数据整理、图表绘制用Microsoft Excel, 使用SPSS 21进行ANOVA方差分析。采用最小极差法(LSD)在0.05的显著水平进行多重比较分析。
2 结果与分析 2.1 CO2浓度升高降低干旱条件下叶片光合色素含量从图 1可知, 孕穗期, CO2浓度升高显著减少谷子叶片类胡萝卜素(Car)含量, 干旱显著升高叶绿素a (Chla)、叶绿素b (Chlb)和Car含量。二者交互作用下, Chla、Chlb和Car含量相比单一干旱处理分别降低44.94%、52.17%和46.15%, 说明CO2对干旱造成的光合色素增加有一定的缓解作用。CO2浓度和干旱交互作用对Chla和Chlb含量影响极显著, 对Car含量影响显著。
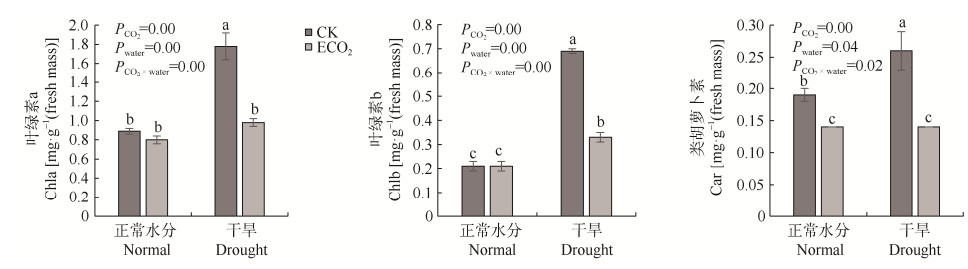
|
图 1 大气CO2浓度升高和干旱对谷子孕穗期光合色素含量的影响 Fig. 1 Effects of elevated CO2 concentration and drought on photosynthetic pigments contents of foxtail mille at booting stage CK: 当前大气CO2浓度(400 μmol∙mol−1); ECO2: 升高CO2浓度(600 μmol∙mol−1)。不同小写字母表示差异达P < 5%显著水平。CK: ambient CO2 concentration (400 μmol∙mol−1); ECO2: elevated CO2 concentration (600 μmol∙mol−1). Different lowercase letters indicate significant differences at P < 5% level. |
CO2浓度升高和干旱处理对净光合速率(Pn)没有表现出明显的交互效应(图 2A)。在孕穗期, 干旱处理显著降低谷子Pn, ECO2处理对谷子Pn影响不显著; 在灌浆期, ECO2处理显著增加了干旱处理条件下的Pn, 而干旱处理显著降低Pn, ECO2处理减轻了干旱对谷子Pn的负效应, 其中, ECO2导致正常水分处理下谷子Pn增加19.0%, 干旱处理下谷子Pn增加87.7%。
CO2浓度升高和水分处理显著影响谷子气孔导度(gs)和蒸腾速率(E), 但二者对gs和E的影响没有表现出明显的交互作用。在孕穗期, 干旱处理显著减少谷子的gs和E; ECO2处理导致正常水分处理下谷子gs减少66.7%, 而干旱处理下减少77.7%, 表明ECO2加剧了干旱处理下谷子气孔关闭。在灌浆期, ECO2处理显著减少正常水分处理下谷子的gs和E, 并没有影响干旱处理下gs和E, 干旱处理显著减少谷子的gs和E(图 2B和2C)。
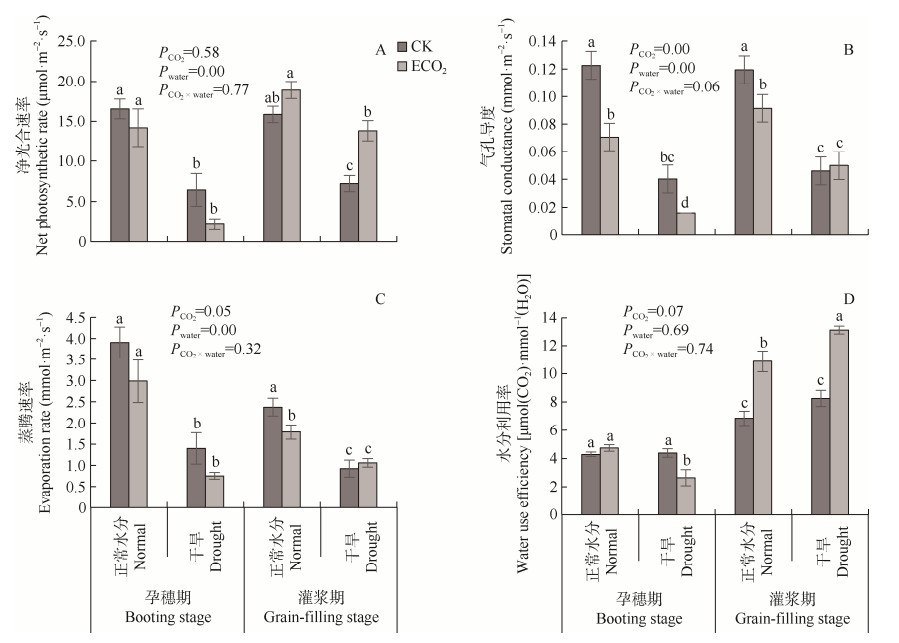
|
图 2 大气CO2浓度升高与干旱对谷子气体交换参数的影响 Fig. 2 Effects of elevated CO2 concentration and drought on gas exchange parameters of foxtail millet CK: 当前大气CO2浓度(400 μmol∙mol−1); ECO2: 升高CO2浓度(600 μmol∙mol−1)。不同小写字母表示同一生育期不同处理间差异达P < 5%显著水平。CK: ambient CO2 concentration (400 μmol∙mol−1); ECO2: elevated CO2 concentration (600 μmol∙mol−1). Different lowercase letters indicate significant differences among treatments at the same growth stage at P < 5% level. |
CO2浓度处理和水分处理及二者交互作用对水分利用率(WUE)的影响不显著。孕穗期, ECO2显著降低了干旱条件下谷子的WUE, 正常水分处理下影响不显著; 灌浆期, 正常水分条件下ECO2使谷子WUE增加37.1%, 而干旱条件下ECO2使谷子WUE增加39.2%, 表明相比正常水分处理, 高CO2浓度更多地改善了干旱下谷子的WUE(图 2D)。
2.3 干旱显著降低谷子叶片PSⅡ光化学效率, 灌浆期高CO2缓解该作用孕穗期, ECO2显著减少了正常水分处理下谷子的光系统Ⅱ实际光化学量子产量(ΦPSⅡ)、表观电子传递效率(ETR)和光化学淬灭系数(qP), 而对干旱处理无显著影响(表 1)。ECO2显著降低正常水分处理下光系统Ⅱ有效光化学量子产量(Fv'/Fm'), 而在干旱处理下则显著升高该值。没有显著影响光系统Ⅱ最大光化学量子产量(Fv/Fm)和非光化学淬灭系数(NPQ)。但干旱处理显著降低谷子除NPQ以外所有荧光动力学参数值。ECO2处理和水分处理对谷子Fv'/Fm'、ΦPSⅡ、ETR和qP表现出显著的交互效应。相比于正常水分处理下的CK, ECO2和干旱交互作用导致谷子的Fv'/Fm'、ΦPSⅡ、ETR和qP分别显著减少13.9%、69.6%、68.7%和64.1%。
| 表 1 大气CO2浓度升高和干旱对谷子叶绿体荧光参数的影响 Table 1 Effects of elevated CO2 concentration and drought on chloroplast fluorescence parameters of foxtail millet |
灌浆期, 干旱处理显著降低除NPQ外所有荧光参数值, 水分处理对所有荧光参数值影响极显著。干旱导致CK处理下谷子的Fv/Fm、Fv'/Fm'、ΦPSⅡ、ETR和qP分别显著降低6.8%、29.3%、56.5%、57.6%和39.3%, NPQ显著升高26.7%; ECO2处理下谷子的Fv'/Fm'、ΦPSⅡ、ETR和qP分别显著降低21.4%、42.1%、42.4%和26.1%, NPQ显著升高33.7%(P < 0.05)。因此, 高CO2可缓解干旱对谷子光系统Ⅱ光化学效率造成的不利影响(表 1)。
2.4 干旱增加谷子叶片POD活性和脯氨酸、可溶性糖和淀粉含量, 高CO2浓度降低纤维素含量孕穗期, ECO2处理没有显著影响谷子脯氨酸、可溶性糖和淀粉含量, 显著减少纤维素含量和正常水分处理下POD活性。干旱极显著升高POD活性(ECO2处理下)和脯氨酸、可溶性糖、淀粉(CK处理下)和纤维素含量(ECO2处理下)。干旱使ECO2处理下POD活性和纤维素含量分别显著升高70.8%和20.7%, 使脯氨酸含量在CK与ECO2处理下分别升高152.4%和313.0%, 使可溶性糖含量在CK与ECO2处理下分别升高86.6%和67.5%, 使CK处理下淀粉含量显著升高106.1%(图 3)。

|
图 3 大气CO2浓度升高和干旱对孕穗期谷子POD活性及脯氨酸、可溶性糖、淀粉和纤维素含量的影响 Fig. 3 Effects of elevated CO2 concentration and drought on POD activity and contents of proline, soluble sugar, starch and cellulose of foxtail millet at booting stage 不同小写字母表示差异达P < 5%显著水平。Different lowercase letters indicate significant differences at P < 5% level. |
有研究表明在正常水分供给条件下大气CO2升高能够提高谷子光合作用和水分利用效率[2, 12], 但目前尚不清楚大气CO2浓度升高是否能够进一步改善谷子的抗旱性。本研究表明大气CO2浓度升高减少干旱条件下谷子叶片光合色素含量, 促进孕穗期谷子气孔关闭, 减轻灌浆期干旱对谷子净光合速率负效应并增加其水分利用率。干旱处理显著降低谷子除NPQ以外所有荧光动力学参数值, 灌浆期升高CO2可以缓解该作用。CO2浓度升高可通过改善谷子的PSⅡ光化学效率和提高抗氧化酶活性来增强谷子的抗旱性。
植物叶片中的光合色素是一类含氮化合物。本研究中, 干旱处理显著升高3种光合色素含量, 但在干旱和CO2浓度升高交互作用下, 3种色素增加程度明显缓解。近年来, 大量研究表明CO2浓度升高会导致植物氮含量下降, 进而导致植物叶片光合色素含量下降[26]。刘济明等[27]研究表明, 随干旱处理时间的延长, 米槁(Cinnamomum migao)叶绿素a含量呈上升趋势, 重度干旱时其值达最高, 叶绿素b呈现先升高后下降的趋势, 类胡萝卜素呈现缓慢升高趋势, 这与本研究结果一致。干旱条件下, 光合色素含量增加, 可能是由于植物为了抵御干旱造成的损伤而采取的措施, 通过增加光合色素含量来捕获更多光能[27]。同时, 正常水分处理下, 高CO2浓度对光合色素含量无显著影响(孕穗期), 这与谷子孕穗期净光合速率结果完全一致。
CO2浓度升高常常导致C4作物(如: 玉米和高粱)气孔减少, 从而减少蒸腾, 改善作物或者土壤水分状况, 最终缓解干旱胁迫。本研究中, 在灌浆期, CO2浓度升高对干旱处理下谷子气孔和蒸腾的改变没有影响, 却明显减轻了干旱对净光合速率的负效应。主要原因是相比于正常水分处理, CO2浓度升高导致干旱处理下谷子的光系统Ⅱ光化学效率进一步改善, 从而对净光合速率产生了影响。该结果与大豆的研究结果较一致[8]。在孕穗期, CO2浓度升高并没有显著增加净光合速率, 可能是由于CO2浓度升高加剧了气孔关闭(图 2B)。这也暗示着孕穗期谷子的光合作用更像C3作物[2]。干旱下高CO2浓度常常促进C4作物(如玉米和高粱)水分利用效率的进一步改善[28], 这与本研究结果较一致。在当前研究中, CO2浓度升高显著增加干旱条件下谷子的水分利用效率, 与净光合速率变化密切相关。
叶绿素荧光参数变化可以反映植物叶绿体PSⅠ和PSⅡ(主要是PSⅡ)的光能吸收利用、传递及耗散过程[29]。本研究中, 灌浆期升高CO2, Fv'/Fm'与Fv/Fm变化趋势一致, 均有不同程度增加, 其原因可能是升高CO2浓度提高了谷子的光能利用效率, 促进了光系统中光合色素对光能的捕获率, 同时减弱了干旱胁迫对植株的损伤。孕穗期ΦPSⅡ、ETR和qP变化一致, 升高CO2浓度和水分胁迫下均表现为下降, 而NPQ则表现上升。表明在高CO2浓度或者水分胁迫条件下, 谷子PSⅡ反应中心开放程度减小, 同时开启了保护机制, 以减少胁迫对其损伤。灌浆期ΦPSⅡ、ETR和qP的变化基本与孕穗期一致, 但CO2对其影响不显著, 且胁迫程度也有所减轻, 水分胁迫成为限制谷子生长的主要因素。可能是谷子已经对高CO2环境产生了适应, 但干旱依然是其胁迫因素。
正常水分处理下, CO2浓度升高使POD活性显著降低, 而在干旱处理下, CO2浓度升高使其有升高趋势, 并且CO2与水分交互作用对POD活性影响极显著。这表明在干旱条件下, CO2浓度升高可能会增加叶片活性氧清除, 从而减轻叶片细胞损伤。李清明等[30]对黄瓜(Cucumis sativus)叶片抗氧化酶活性研究结果表明, 干旱条件下, 高CO2可以增加多种抗氧化酶活性。本研究中, 升高CO2和干旱均使可溶性糖含量和淀粉含量上升。CO2升高会提高谷子光合作用, 促进有机物合成, 从而提高谷子叶片可溶性糖和淀粉含量[16, 31]。而干旱使植物体遭受胁迫, 植物通过提高可溶性糖等渗透调节物质, 减轻胁迫对植物体的伤害[16]。
本研究只测定了谷子部分生育期气体交换参数、叶绿体荧光参数及抗旱生理特性相关指标, 今后有待开展更深入的研究, 以明确谷子对高CO2和干旱互作的响应机制。
4 结论CO2浓度升高能够减轻干旱对PSⅡ光化学效率(如: Fv'/Fm', ΦPSⅡ, ETR)的负效应, 从而减轻干旱对净光合速率的不利影响, 最终提高谷子的水分利用效率, 且高CO2浓度可以增加过氧化物酶活性, 增强活性氧的清除, 从而达到保护叶片的作用。因此, 高CO2浓度能够通过改善谷子的光系统Ⅱ光化学效率和提高抗氧化酶活性来增强谷子的抗旱性。这些结果将为应对气候变化的谷子适应性策略(如: 育种)提供指导性意见。
| [1] |
GRAY V. Climate change 2007:The physical science basis summary for policymakers[J]. Energy & Environment, 2007, 18(3/4): 433-440. |
| [2] |
LI P, LI B Y, SENEWEERA S, et al. Photosynthesis and yield response to elevated CO2, C4 plant foxtail millet behaves similarly to C3 species[J]. Plant Science, 2019, 285: 239-247. DOI:10.1016/j.plantsci.2019.05.006 |
| [3] |
曾长立, 王晓明, 张福锁, 等. 浅析C3植物和C4植物对大气中CO2浓度升高条件下的反应[J]. 江汉大学学报, 2001, 18(3): 6-14. ZENG C L, WANG X M, ZHANG F S, et al. Some views on the responses of C3 plant and C4 plant to the atmospheric concentration of CO2 elevated[J]. Journal of Jianghan University, 2001, 18(3): 6-14. DOI:10.3969/j.issn.1006-639X.2001.03.002 |
| [4] |
郝兴宇, 李萍, 林而达, 等. 大气CO2浓度升高对谷子生长发育与光合生理的影响[J]. 核农学报, 2010, 24(3): 589-593. HAO X Y, LI P, LIN E D, et al. Effects of air CO2 enrichment on growth and photosynthetic physiology of millet[J]. Journal of Nuclear Agricultural Sciences, 2010, 24(3): 589-593. |
| [5] |
王美玉, 赵天宏, 张巍巍, 等. CO2浓度升高与温度、干旱相互作用对植物生理生态过程的影响[J]. 干旱地区农业研究, 2007, 25(2): 99-103. WANG M Y, ZHAO T H, ZHANG W W, et al. Effects of interactions between elevated CO2 concentration and temperature, drought on physio-ecological processes of plants[J]. Agricultural Research in the Arid Areas, 2007, 25(2): 99-103. DOI:10.3321/j.issn:1000-7601.2007.02.021 |
| [6] |
姜帅, 居辉, 吕小溪, 等. CO2浓度升高与水分互作对冬小麦生长发育的影响[J]. 中国农业气象, 2013, 34(4): 403-409. JIANG S, JU H, LV X X, et al. Interactive effects of elevated carbon dioxide and water on the growth and development of winter wheat[J]. Chinese Journal of Agrometeorology, 2013, 34(4): 403-409. DOI:10.3969/j.issn.1000-6362.2013.04.005 |
| [7] |
廖建雄, 王根轩. 干旱、CO2和温度升高对春小麦光合、蒸发蒸腾及水分利用效率的影响[J]. 应用生态学报, 2002, 13(5): 547-550. LIAO J X, WANG G X. Effects of drought, CO2 concentration and temperature increasing on photosynthesis rate, evapotranspiration, and water use efficiency of spring wheat[J]. Chinese Journal of Applied Ecology, 2002, 13(5): 547-550. DOI:10.3321/j.issn:1001-9332.2002.05.008 |
| [8] |
WANG A P, LAM S K, HAO X Y, et al. Elevated CO2 reduces the adverse effects of drought stress on a high-yielding soybean (Glycine max (L.) Merr.) cultivar by increasing water use efficiency[J]. Plant Physiology and Biochemistry, 2018, 132: 660-665. DOI:10.1016/j.plaphy.2018.10.016 |
| [9] |
武海霞, 郭丽丽, 郝立华, 等. 水分和CO2浓度对冬小麦气孔特征、气体交换参数和生物量的影响[J]. 作物学报, 2018, 44(10): 1570-1576. WU H X, GUO L L, HAO L H, et al. Effects of water and CO2 concentration on stomatal traits, leaf gas exchange, and biomass of winter wheat[J]. Acta Agronomica Sinica, 2018, 44(10): 1570-1576. |
| [10] |
王修兰, 徐师华, 梁红. CO2浓度增加对C3、C4作物生育和产量影响的实验研究[J]. 中国农业科学, 1998, 31(1): 56-62. WANG X L, XU S H, LIANG H. The experimental study of the effects of CO2 concentration enrichment on growth, development and yield of C3 and C4 crops[J]. Scientia Agricultura Sinica, 1998, 31(1): 56-62. |
| [11] |
QIAO Y F, MIAO S J, LI Q, et al. Elevated CO2 and temperature increase grain oil concentration but their impacts on grain yield differ between soybean and maize grown in a temperate region[J]. Science of the Total Environment, 2019, 666: 405-413. DOI:10.1016/j.scitotenv.2019.02.149 |
| [12] |
HAO X Y, LI P, LI H Y, et al. Elevated CO2 increased photosynthesis and yield without decreasing stomatal conductance in broomcorn millet[J]. Photosynthetica, 2017, 55(1): 176-183. DOI:10.1007/s11099-016-0226-6 |
| [13] |
刘敏轩, 张婷, 师志刚, 等. 干旱胁迫对冀谷34幼苗生理特性的影响[J]. 河北农业科学, 2018, 22(2): 6-11. LIU M X, ZHANG T, SHI Z G, et al. Effect of drought stress on physiological characteristics of foxtail millet variety Jigu 34[J]. Journal of Hebei Agricultural Sciences, 2018, 22(2): 6-11. |
| [14] |
BENCZE S, BAMBERGER Z, JANDA T, et al. Physiological response of wheat varieties to elevated atmospheric CO2 and low water supply levels[J]. Photosynthetica, 2014, 52(1): 71-82. DOI:10.1007/s11099-014-0008-y |
| [15] |
张文, 智慧, 柳斌辉, 等. 谷子孕穗期一些生理性状与品种抗旱性的关系[J]. 华北农学报, 2011, 26(3): 128-133. ZHANG W, ZHI H, LIU B H, et al. Relationship between drought tolerance ability and some physiological characteristics of foxtail millet at booting stage[J]. Acta Agriculturae Boreali-sinica, 2011, 26(3): 128-133. |
| [16] |
袁蕊, 郝兴宇, 胡晓雪, 等. 干旱对谷子灌浆期光合生理及生长发育的影响[J]. 山西农业大学学报: 自然科学版, 2017, 37(6): 396-401. YUAN R, HAO X Y, HU X X, et al. Effects of drought on photosynthetic physiology and growth of millet during grain filling[J]. Journal of Shanxi Agricultural University: Natural Science Edition, 2017, 37(6): 396-401. DOI:10.3969/j.issn.1671-8151.2017.06.005 |
| [17] |
刘紫娟, 李萍, 宗毓铮, 等. 干旱胁迫对糜子生理及产量的影响[J]. 山西农业科学, 2016, 44(9): 1279-1283. LIU Z J, LI P, ZONG Y Z, et al. Effects of drought on physiology and yield in broomcorn millet[J]. Journal of Shanxi Agricultural Sciences, 2016, 44(9): 1279-1283. DOI:10.3969/j.issn.1002-2481.2016.09.12 |
| [18] |
李红英, 程鸿燕, 郭昱, 等. 谷子抗旱机制研究进展[J]. 山西农业大学学报: 自然科学版, 2018, 38(1): 6-10. LI H Y, CHENG H Y, GUO Y, et al. Progress in the mechanisms of drought tolerance in foxtail millet[J]. Journal of Shanxi Agricultural University: Natural Science Edition, 2018, 38(1): 6-10. |
| [19] |
刘紫娟, 李萍, 宗毓铮, 等. 大气CO2浓度升高对谷子生长发育及玉米螟发生的影响[J]. 中国生态农业学报, 2017, 25(1): 55-60. LIU Z J, LI P, ZONG Y Z, et al. Effect of elevated[CO2] on growth and attack of Asian corn borers (Ostrinia furnacalis) in foxtail millet (Setaria italica)[J]. Chinese Journal of Eco-Agriculture, 2017, 25(1): 55-60. |
| [20] |
严加坤, 吴晓红, 赵旭阳. 不同年代谷子品种响应干旱胁迫的生理机制[J]. 陕西农业科学, 2018, 64(12): 64-69. YAN J K, WU X H, ZHAO X Y. Physiological mechanism of millet varieties in different ages in response to drought stress[J]. Shaanxi Journal of Agricultural Sciences, 2018, 64(12): 64-69. DOI:10.3969/j.issn.0488-5368.2018.12.019 |
| [21] |
贾斯淳, 王娜, 郝兴宇, 等. 不同干旱胁迫处理对大豆品种生长及逆境生理的影响[J]. 华北农学报, 2019, 34(5): 137-144. JIA S C, WANG N, HAO X Y, et al. Effects of different drought stresses on growth and physiological properties of soybean[J]. Acta Agriculturae Boreali-sinica, 2019, 34(5): 137-144. |
| [22] |
陈芬, 余高, 陈容, 等. 减磷配施有机肥对辣椒生长及光合荧光特性的影响[J]. 西北农林科技大学学报: 自然科学版, 2021(7): 1-12. CHEN F, YU G, CHEN R, et al. Effects of reduced application of chemical phosphorus combined with organic fertilizer on growth and photosynthetic fluorescence characteristics of Capsicums annuum L[J]. Journal of Northwest A & F University: Natural Science Edition, 2021(7): 1-12. |
| [23] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 164-165, 260-261. LI H S. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 164-165, 260-261. |
| [24] |
李强, 唐微, 石园园, 等. 蒽酮-硫酸法和3, 5-二硝基水杨酸法测定杜仲水提液多糖含量[J]. 食品工业科技, 2010, 31(10): 370-371. LI Q, TANG W, SHI Y Y, et al. Determination of polysaccharide in water extraction from Eucommia ulmoides Oliver by 3, 5-dinitrosalicylic acid (DNS) method and anthrone-sulfuric method[J]. Science and Technology of Food Industry, 2010, 31(10): 370-371. |
| [25] |
邱献锟, 刘宪虎, 许明子, 等. 水稻大粒种质淀粉积累特性研究[J]. 安徽农业科学, 2010, 38(13): 6668-6672. QIU X K, LIU X H, XU M Z, et al. Study on starch accumulation characteristics on large seed of rice[J]. Journal of Anhui Agricultural Sciences, 2010, 38(13): 6668-6672. |
| [26] |
宝俐, 董金龙, 李汛, 等. CO2浓度升高和氮素供应对黄瓜叶片光合色素的影响[J]. 土壤, 2016, 48(4): 653-660. BAO L, DONG J L, LI X, et al. Effects of elevated CO2, N concentration and N forms on photosynthetic pigments concentration and composition[J]. Soils, 2016, 48(4): 653-660. |
| [27] |
刘济明, 李佳, 文爱华, 等. 米槁幼苗光合色素与光合特征对干旱胁迫的响应[J]. 江苏农业科学, 2019, 47(9): 171-174. LIU J M, LI J, WEN A H, et al. Responses of photosynthetic pigment and photosynthetic characteristics of Cinnamomum migao to drought stress[J]. Jiangsu Agricultural Sciences, 2019, 47(9): 171-174. |
| [28] |
ALLEN JR L H, KAKANI V G, VU J C V, et al. Elevated CO2 increases water use efficiency by sustaining photosynthesis of water-limited maize and sorghum[J]. Journal of Plant Physiology, 2011, 168(16): 1909-1918. |
| [29] |
王兰兰, 李琦, 宋晓卉, 等. 环境条件对植物叶绿素荧光参数影响研究进展[J]. 沈阳师范大学学报: 自然科学版, 2019, 37(4): 362-367. WANG L L, LI Q, SONG X H, et al. Effects of environmental conditions on chlorophyll fluorescence parameters of plants[J]. Journal of Shenyang Normal University: Natural Science Edition, 2019, 37(4): 362-367. |
| [30] |
李清明, 刘彬彬, 艾希珍. CO2浓度倍增对干旱胁迫下黄瓜幼苗膜脂过氧化及抗氧化系统的影响[J]. 生态学报, 2010, 30(22): 6063-6071. LI Q M, LIU B B, AI X Z. Effects of doubled CO2 concentration on lipid peroxidation and antioxidant system of cucumber seedlings under drought stresses[J]. Acta Ecologica Sinica, 2010, 30(22): 6063-6071. |
| [31] |
VIJAYALAKSHMI T, VARALAXMI Y, JAINENDER S, et al. Physiological and biochemical basis of water-deficit stress tolerance in pearl millet hybrid and parents[J]. American Journal of Plant Sciences, 2012, 3(12): 1730-1740. |
 2021, Vol. 29
2021, Vol. 29



