2. 四川农业大学林学院 成都 611130;
3. 农业部西南山地农业 环境重点实验室 成都 610066;
4. 四川省农业科学院植物保护研究所 成都 610066
2. College of Forestry, Sichuan Agricultural University, Chengdu 611130, China;
3. Key Laboratory of Southwest Mountain Agricultural Environment of the Ministry of Agriculture, Chengdu 610066, China;
4. Institute of Plant Protection, Sichuan Academy of Agricultural Sciences, Chengdu 610066, China
叶面微生物(phylloplane microorganism)是指直接以叶面作栖息生境的各种类型微生物, 包括细菌、真菌、病毒和原生生物等, 其中细菌的数量最为丰富, 可达106~107 cells∙cm−2(leaf)[1]。它们不仅受植物种类、海拔梯度[2]、生境条件[3]和季节差异[4]等因素影响, 还会受到植物叶片性质的影响, 例如叶的生长周期、叶的形态结构、叶的化学组成和分泌物以及叶的空间位置等[5-6]。巨大山茱萸(Swida controversa)冠层内叶面微生物结构受叶龄、叶层高度、叶层厚度以及距主干的距离等因素影响[7]; 柑橘黄龙病株(citrus huanglongbing)不同方位(东、西、南、北)叶片的细菌分布量也存在显著差异[8]; 草莓(Fragaria ananassa cv. Elsanta)在大田生长条件下, 叶片表现为下部叶片的细菌数量要多于上部叶片, 而在温室条件下上部叶片的细菌数量要多于下部叶片[9]。随着叶面微生物研究的深入, 叶部病害发生与叶面微生物群落结构和多样性进行了关联。紫茎泽兰(Eupatorium adenophorum)健康叶和病叶的微生物物种组成和多样性差异明显, 健康叶比病叶显示出更高的细菌多样性, 健康和患病的叶面微生物群落之间的系统发生结构有很大不同[10]; ‘金冠’苹果(Malus domestica)感染褐斑病的病叶和未感染褐斑病的健叶片的叶面微生物类群和相对出现频率差别较大[11]; 南瓜白粉病[12]和茶白星病[13]在不同病情等级下的叶面微生物群落结构和多样性存在差异。这些报道表明宿主植物的健康与微生物群落结构、数量和多样性密切相关。桑树(Morus alba)的桑轮纹病在中国、日本、美国、印度等热带、亚热带和温带地区频发, 影响了世界蚕业的发展。我国台湾[14]、云南昭通[15]、江西修水[16]、浙江淳安[17]、广西百色[18]和四川眉山等地方对该病害的发病规律及特征进行了相关报道, 调查发现, 病原菌桑膝节霉[19](Gonatophragmium mori)着生在桑叶的下表面, 冠层下部的叶片发病最为严重, 病斑较多且大, 冠层上部叶片发病较轻或者无发病, 病斑较少而小[20]。针对这一现象, 本研究提出了“桑轮纹病发生时冠层内桑叶的叶表面微生物群落结构发生改变, 并且桑叶表面细菌群落结构对冠层内垂直空间的响应存在显著差异”的假设。为论证这一假设, 并同时挖掘潜在的病原菌的拮抗细菌, 本研究以桑轮纹病株不同冠层高度的叶片为研究对象, 利用高通量测序技术对冠层下部叶片的下表面(LB)和上表面(LS)、冠层上部叶片的下表面(UB)和上表面(US)的微生物16S rDNA的V3-V4区和ITS rDNA的ITS1-2区进行测序分析, 揭示微生物群落结构、功能和多样性在上下冠层叶片上下表面的差异, 对快速筛选控制桑轮纹病病原菌(Gonatophragmium)潜在的拮抗微生物有重要的指导意义。
1 材料与方法 1.1 样本采集与处理采样时间为2018年9月31日, 采样地点在四川省眉山市青神县黄桷村桑园(103°41'29″~ 103°59'31″E、29°42'30″~29°55'33″N), 海拔高度349 m。桑树品种为‘湘7920’。桑园占地面积约20 000 m2 (200 m×100 m), 划分为4个面积大致相等的样地(100 m×50 m)。每个样地选取10株发病桑树, 用经酒精消毒后的剪刀分别在每株树冠层的上部(距离地表 1.3 m以上)和下部(距离地表 0.6~1.3 m)的东、南、西、北、中各方位各取1片, 每张叶片单独装于无菌取样袋中, 总计100张桑叶。上部叶片的发病程度大致为无病斑或1个病斑左右, 病斑面积占整个叶面积的0~10%; 下部叶片的发病程度大致为3个病斑以上, 病斑面积占整个叶面积的11%~40%。将样本放入低温保藏箱, 并迅速带回实验室, 置于4 ℃的冰箱中保存、备用。
在超净工作台上, 棉球浸泡1%次氯酸钠溶液后均匀擦拭叶片上表面, 用无菌水均匀擦拭叶片上表面, 再棉球浸泡于75%乙醇中后均匀擦拭叶片上表面, 以上操作重复3次。按上述方式消毒处理后, 置于无菌均质袋中, 该处理后的样品用于检测叶片下表面细菌群落, 命名为: 冠层下部叶片的下表面(LB)和冠层上部叶片的下表面(UB)。按照上述方法处理叶片的下表面, 该处理后的样品用于检测叶片上表面细菌群落, 命名为: 冠层下部叶片的上表面(LS)和冠层上部叶片的上表面(US)。
1.2 样本DNA提取、扩增及纯化参考罗路云等[12]方法收集桑叶叶片表面的微生物, 再按照E.Z.N.ATM Mag-Bind Soil DNA kit试剂盒(http://omegabiotek.com/store/product/soil-dna-kit/)的使用说明书进行DNA提取, 并用琼脂糖凝胶电泳检测。以样品DNA为模板, 选用细菌16S rRNA基因的通用引物341F和805R[21]和真菌ITSrDNA基因的通用引物ITS1和ITS2-Rev[22]进行第1次扩增, 引入Illumina桥式PCR兼容引物进行第2轮扩增, 最后利用Qubit 2.0 DNA检测试剂盒回收产物。高通量测序所使用的引物如表 1所示。
| 表 1 高通量测序使用的引物 Table 1 High throughput sequencing primers |
用CASAVA碱基识别分析将原始图像数据转化为原始测序序列(raw reads)。首先用Cutadapt (v.1.2.1)软件去除3'端测序引物接头, 再用PEAR[23] (v.0.9.6)软件将成对reads拼接成一条序列, 然后用barcode标签序列识别并区分各样本的数据, 最后利用Prinseq[24] (v.0.20.4)软件对各样本数据进行质量剪切, 得到有效数据(clean reads)。利用Usearch[25] (v.5.2.236)软件去除嵌合体及非特异性扩增序列, 得到高质量数据(filtered reads)。
1.3.2 统计分析聚类分析: 用Usearch[25] (v.5.2.236)软件在97%的相似水平下将各样本的有效序列聚类成为可操作分类单元OTUs (operational taxonomic units), 然后根据各样本OTU丰度计算beta多样性距离矩阵进行层次聚类(hierarchical clustering)分析, 再使用非加权组平均法UPGMA (unweighted pair group method with arithmetic mean)算法构建树状结构。
多样性指数分析: 使用97%相似度的OTU, 利用Mothur软件[26] (v.1.30.1)做rarefaction分析和计算各样本的多样性指数(Chao1、ACE、Shannon和Simpson), 然后用SPSS (v.24.0)软件对试验数据进行分析, 采用单因素方差分析(One-way ANOVA)和多重比较(LSD)法进行差异显著性检验和多重比较分析(α=0.05), 图表中的数据均为平均值±标准偏差(mean±SD)。
物种分类分析: 用RDP classifier[27] (v.2.12)软件的Naïve Bayesian assignment算法将样本进行物种分类, 依次为门(phylum)、纲(class)、目(order)、科(family)和属(genus)5个层次进行物种分类。基于STAMP (v.2.1.3)[28]功能物种分类结果和PICRUST[29]功能2级分类结果, 比较样本或组间丰度差异, 找出样本或组间丰度存在显著差异的物种分类和功能分类, 默认筛选条件为P < 0.05。
相关性分析: 用SPSS (v.24.0)软件对试验数据进行分析, 采用双变量相关分析[12] (bivariate correlation)法求出相关系数R值并进行差异显著性检验(α=0.05)。
2 结果与分析 2.1 测序序列长度分析由测序序列长度结果(表 2)可见, 所有样本共测得原始测序序列948 283条, 有效序列871 232条。为了保证信息分析质量, 去除嵌合体及非特异性扩增序列得高质量序列853 053条, 平均序列长度420.42 bp。
| 表 2 不同冠层位置桑叶叶片上下表面细菌序列长度统计表 Table 2 Sequence length statistics of bicteria in upper and lower surfaces of leaves from different parts of canopy of mulberry |
由图 1可见, 所有样本共检测到1054 OTUs。重合的细菌OTUs 29个, 占总数的2.75%; LB、LS、UB和US叶片表面特异的细菌OTUs分别为275、210、349和307, 分别占其丰度的24.00%、17.66%、31.22%和27.12%。共有OTUs较少, 独有OTUs较多, 表明各样本间的细菌群落结构差异较大。基于OTU丰度对所有样本进行聚类分析(图 1)显示: LS和US聚为一类, LB和UB聚为一类, 表明冠层内上表面和下表面之间的差异显著高于冠层上部和冠层下部之间的差异。
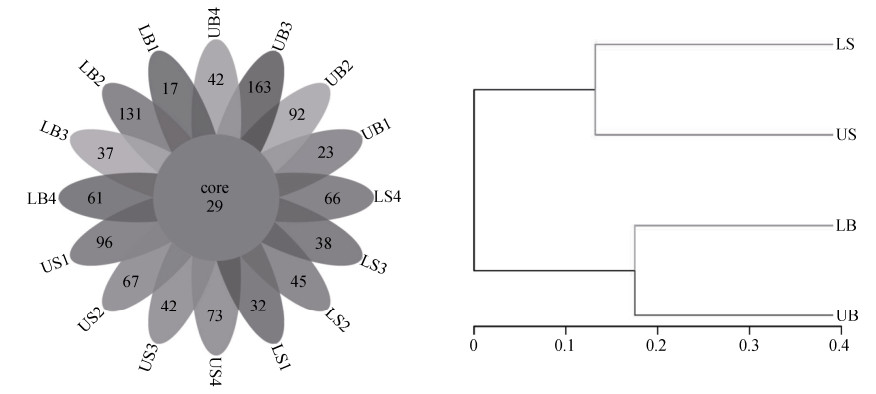
|
图 1 不同冠层位置桑叶叶片上下表面细菌OTU丰度的样本韦恩图和聚类树图 Fig. 1 Venn diagram and cluster tree of bacteria based on OTU number of upper and lower surfaces of leaves from different parts of canopy of mulberry LB: 冠层下部叶片的下表面; LS: 冠层下部叶片的上表面; UB: 冠层上部叶片的下表面; US: 冠层上部叶片的上表面。LB: lower surface of leaf from lower canopy; LS: upper surface of leaf from lower canopy; UB: lower surface of leaf from upper canopy; US: upper surface of leaf from upper canopy. |
对各样本的细菌群落进行丰富度指数(Chao1指数、ACE指数)和均匀度指数(Shannon指数、Simpson指数)分析(表 3), Chao1指数表现为UB > LB > LS > US, 各样本间的差异不显著; ACE指数表现为LB > UB > LS > US, LB和US之间的差异显著; Shannon指数表现为US > LS > UB > LB, LB与LS、UB和US都差异显著; Simpson指数表现为LB > UB > LS > US, US与UB和LB差异显著。冠层上部叶片和下部叶片的均匀度指数(Shannon)差异显著, 冠层上部叶片是冠层下部叶片的1.26倍。叶片上表面的均匀度指数(Shannon)差异显著, 上表面是下表面的1.49倍。数据表明: 冠层上部叶片细菌分布均匀度高于冠层下部, 叶片上表面的细菌分布均匀度高于下表面。
| 表 3 不同冠层位置桑叶叶片上下表面细菌群落丰富度和多样性 Table 3 Bacterial community richness and diversity on upper and lower surfaces of leaves from different parts of canopy of mulberry |
所有样本检测出的细菌分属于35个门、61个纲、90个目、190个科和555个属。从各分类水平上物种相对丰度表(表 4)可知, 在门和纲水平上, 各样本的优势菌群为变形菌门(Proteobacteria, 89.06%)和γ-变形菌纲(Gammaproteobacteria, 72.69%)。变形菌门在LB、LS、UB和US中所占比例分别为99.29%、88.04%、91.22%和78.52%; γ-变形菌纲在LB、LS、UB和US中所占比例分别为94.99%、67.53%、77.77%和52.82%。在目水平上, 肠杆菌目(Enterobacteriales, 45.39%)是LB、LS和UB的优势菌目, 其相对丰度在各样本中所占比例分别为84.10%、43.80%和48.65%; 黄色单胞杆菌目(Xanthomonadales, 13.82%)是US的优势菌目, 相对丰度在样本中所占比例为24.62%。在属水平上, 泛菌属(Pantoea, 19.70%)是LB和UB的优势菌属, 其相对丰度在各样本中所占比例分别为38.04%和25.31%; 寡养单胞菌属(Stenotrophomonas, 12.53%)是US的优势菌属, 其相对丰度在样本中所占比例为23.73%; 沙雷氏菌属(Serratia, 8.79%)是LS的优势菌, 其相对丰度在样本中所占比例为18.00%。
| 表 4 不同冠层位置桑叶叶片上下表面细菌各分类水平上数量排名前10物种相对丰度在各样本中所占比例 Table 4 Proportions of relative abundances of top ten items at each taxonomic level of bacteria on upper and lower surfaces ofleaves from different parts of canopy of mulberry |
从属水平上两两间丰度存在显著差异的物种分类可见表 5。在冠层下部, 上表面和下表面存在显著差异的物种有勒克氏菌属(Leclercia)、薄层菌属(Hymenobacter)、金黄杆菌属(Chryseobacterium)和地嗜皮菌属(Geodermatophilus), 上表面所占比例分别为9.10%、93.33%、99.20%和93.83%, 下表面所占比例分别为90.90%、6.67%、0.80%和6.17%。在冠层上部, 上表面和下表面存在显著差异的物种有鞘氨醇单胞菌属(Sphingomonas)、异常球菌属(Deinococcus)和勒克氏菌属, 上表面所占比例分别为79.76%、82.00%和0, 下表面所占比例分别为20.24%、18.00%和100.00%。可知, 上表面的薄层菌属、金黄杆菌属、地嗜皮菌属、鞘氨醇单胞菌属和异常球菌属的丰度都显著高于下表面, 然而勒克氏菌属的丰度显著低于下表面。无论是在冠层上部还是在冠层下部, 下表面的勒克氏菌属丰度显著高于上表面, 上表面和下表面所占比例分别为5.00%和95.00%。在属分类水平上数量排名前10物种中, 冠层上部叶片上表面和下表面存在显著差异的菌属是鞘氨醇单胞菌属, 冠层下部叶片上表面和下表面存在显著差异的菌属是金黄杆菌属, 这两个菌属都表现为上表面的丰度大于下表面。
| 表 5 不同冠层位置桑叶叶片上下表面两两间细菌丰度存在显著差异(P < 0.05)的属 Table 5 Genus significantly different (P < 0.05) among upper and lower surfaces of leaves from different parts of canopy of mulberry |
首先对已有测序微生物基因组的基因功能的构成进行分析, 然后通过16S测序获得的物种构成推测样本中功能基因的构成, 从而分析不同样本和分组之间在功能上的差异(表 6), 默认筛选条件为P < 0.05。从两两样品间丰度存在差异的功能分类可知, 在冠层下部, 上表面次生代谢物的生物合成、运输和分解代谢以及脂质运输和代谢功能比下表面强, 然而细胞运动比下表面弱; 在冠层上部, 上表面的细胞壁生物发生功能比下表面强, 然而氨基酸的运输和代谢功能比下表面弱。冠层下部细菌菌群的碳水化合物和氨基酸的运输和代谢基因功能比冠层上部强, 然而脂质的运输和代谢基因功能比冠层上部弱。
| 表 6 不同冠层位置桑叶叶片上下表面两两间丰度存在显著差异(P < 0.05)的细菌功能分类 Table 6 Functional classification with significant differences (P < 0.05) among upper and lower surfaces of leaves from different parts of canopy of mulberry |
冠层下部叶片的下表面(LB)和上表面(LS)、冠层上部叶片的下表面(UB)和上表面(US) Gonatophragmium属的相对丰度分别为5.76%和0.84%、0.57%和0.54%, 与在属水平上排名前100细菌菌属的相对丰度进行相关性分析, 相关性显著(P < 0.05)的菌属是芽孢杆菌属(Bacillus)、不粘柄菌属(Asticcacaulis)和苯基杆菌属(Phenylobacterium), 相关系数分别为−0.87、−0.84和−0.79。冠层下部叶片的下表面(LB)和上表面(LS)、冠层上部叶片的下表面(UB)和上表面(US) Gonatophragmium属的多样性指数与细菌群落的多样性指数进行相关性分析, 结果表明, 病原菌与细菌群落的均匀度指数(Shannon指数和Simpson指数)有一定的相关性, 相关系数分别为−0.31和0.21, 但是相关性不显著; 病原菌与细菌群落的丰富度指数(ACE指数和Chao1指数)基本不相关, 相关系数分别为0.03和0.13。
3 讨论 3.1 桑叶表面细菌群落结构在冠层内垂直空间的分异群落的均匀度反映群落的稳定性和生境特性, 均匀度指数越高群落物种多样性就越高, 群落越稳定, 生境越适于群落生存[30-31]。冠层上部叶片和冠层下部叶片的均匀度指数(Shannon)差异显著, 冠层上部叶片是冠层下部叶片的1.26倍。这种差异可能与叶片发病程度和周期的差异有关, 冠层上部叶片发病较轻或者无发病, 病斑较少而小, 处于发病的前期; 冠层下部叶片发病最为严重, 病斑较多且大, 处于发病的中期。叶片从发病前期到中期, 其细菌群落多样性表现为逐渐下降的趋势。罗路云等[12]研究发现不同南瓜白粉病病情等级下细菌群落多样性和群落结构都存在差异, 随着病情等级的提高多样性呈现先降后升的趋势。另一方面可能由生境差异造成, 冠层上部光照强温度高, 通风透光; 然而冠层下部光照弱温度低, 通风透光差, 相对湿度较高, 冠层上部的生境更利于大多数细菌的生存。在属分类水平上数量排名前10物种中, 冠层下部叶片下表面(LB)和冠层上部叶片下表面(UB)细菌相对丰度存在显著差异的菌属是鞘氨醇单胞菌属, UB的相对丰度是LB的2.44倍。鞘氨醇单胞菌属具有耐受极端贫营养条件、环境适应性强和降解多种有机污染物[32][如氯化外源性物质, 二恶因和多环芳烃(PAHs)]的特征[33]。该菌可有效地抵抗多种植物病原菌, 比如对引起黄萎病的真菌大丽轮枝功(Verticillium dahliae)有拮抗作用[34]; 对水稻病原体的感染起到有效的抵抗作用[35], 从而促进植物的生长。冠层上部叶片的鞘氨醇单胞菌属相对丰度较高, 而上部叶片发病程度较轻或者无发病, 这可能是因为鞘氨醇单胞菌属增强了桑叶的抗病性。
3.2 桑叶上表面和下表面细菌菌群的分异桑叶叶片上表面和下表面的细菌均匀度指数(Shannon)差异显著, 上表面是下表面的1.49倍。这可能与病原菌菌丝着生在叶片的位置有关, 当病原菌定殖在叶片下表面后, 微生物之间对营养物质的竞争加剧, 营养物质的竞争是叶际微生物之间重要的相互关系[36], 从而影响微生物的多样性。在属分类水平上数量排名前10物种中, 冠层上部叶片上表面和下表面存在显著差异的菌属是鞘氨醇单胞菌属, 冠层下部叶片上表面和下表面存在显著差异的菌属是金黄杆菌属, 这两个菌属都表现为上表面的丰度大于下表面。鞘氨醇单胞菌属和金黄杆菌属均为非发酵革兰阴性杆菌, 无芽胞, 菌落为黄色, 接触酶阳性, 专性需氧。这可能与生境差异有关, 上表面的氧气含量更高, 需氧细菌的相对丰度就越大。
3.3 泛菌属(Pantoea)可能对桑轮纹病的发生有协同或者伴生作用本研究对桑轮纹病发生区冠层上部和下部叶片上表面和下表面细菌菌群的相对丰度进行分析, 结果表明叶片表面的优势属是泛菌属。冠层下部叶片的下表面(LB)和上表面(LS)、冠层上部叶片的下表面(UB)和上表面(US)泛菌属的相对丰度分别为38.04%和13.86%、25.31%和7.69%, 病原菌(Gonatophragmium)的相对丰度分别为5.76%和0.84%、0.57%和0.54%, 泛菌属与病原菌属呈正相关关系。泛菌属是革兰阴性粗短杆菌, 也是一种腐生菌或植物病斑上的次生菌[37], 广泛存在于植物表面, 会引起植物腐烂。国内外研究表明, 泛菌属细菌会引起很多植物病害的发生, 例如菠萝泛菌(P. ananatis)和分散泛菌(P. dispersa)是玉米新型细菌性褐腐病[38]、加州高粱叶斑病[39]的病原物; 成团泛菌(P. agglomerans)引起玉米叶疫病和维管束枯萎病[40]、玉米细菌干茎腐病[41]、棉花细菌性烂铃病[42]和香蕉叶鞘腐败病[43]等病害。泛菌属的部分菌株还是桑树病害的条件致病菌, 例如桑叶穿孔病的病叶叶面分离到成团泛菌和菠萝泛菌[44]; 桑枯萎病的病原菌属于肠杆菌科的肠杆菌属(Enterobacter)、克雷白氏杆菌属(Klebsiella)和泛菌属[45]。泛菌属可能对桑轮纹病的发生有协同或者伴生作用, 但它是否为桑轮纹病的条件致病菌, 仍需进一步的研究。
3.4 芽孢杆菌属(Bacillus)可能对病原菌存在着某种程度的拮抗作用病原菌的相对丰度与在属分类水平上排名前100细菌菌属的相对丰度进行相关性分析发现, 相关性最大的菌属是芽孢杆菌, 相关系数为−0.87。在叶片发病的时候, 相应的协同发病菌种数量增加, 拮抗菌种的数量可能降低, 推测该菌属可能对病原菌存在着某种程度的拮抗作用。芽孢杆菌是好氧或兼性厌氧、能产生抗逆性芽孢的革兰氏阳性菌, 也是桑树内生细菌的优势种群[46], 广泛分布于水体、土壤、空气和动物肠道等。它通过竞争性排阻[47]、诱导植株产生抗病性[48]和拮抗作用等机制抑制植物病原菌生长, 提高宿主植物的抗病抗逆能力[49]来促进植物自身的生长。其中, 拮抗作用主要是通过生成抑菌活性物质[50]来抑制植物病害, 生防芽孢杆菌产生的拮抗物质包括脂肽类化合物和聚酮类化合物[51]。近几年从桑树的叶、茎和果实分离到的芽孢杆菌属的部分菌株对桑青枯病、桑疫病、桑椹菌核病、桑断枝烂叶病的病原菌都有一定的拮抗作用。从健康桑叶中分离到的多粘芽孢杆菌(B. polymyxa)对桑青枯病菌和桑疫病菌有一定的抑菌效果[52]。从健康植株的茎中分离到的特基拉芽孢杆菌(B. tequilensis)[53]和甲基营养型芽孢杆菌(B. methylotrophicus)[54]对桑椹菌核病有很强的抑菌作用, 贝莱斯芽孢杆菌(B. velezens)对桑断枝烂叶病菌抑菌作用稳定且显著[51]。从健康桑椹果中分离到的贝莱斯芽孢杆菌对桑椹菌核病有很强的抑菌作用[55]。本文利用高通量测序技术检测到芽孢杆菌属与病原菌存在显著的负相关关系, 所以可以尝试从芽孢杆菌属中筛选出用于桑轮纹病害生物防治的菌株, 芽孢杆菌属对桑轮纹病的抑制效果还需要进一步研究。高通量测序具有高效率、高速和成本低的优势, 但是该方法受样品采集和处理过程的差异、扩增引物对不同细菌扩增的偏好性[56]、分析方法局限性等因素的限制, 无法精确地反映样品中实际的菌群结构。
4 结论桑轮纹病发生区冠层上部和下部叶片上表面和下表面细菌多样性、结构组成和功能存在差异。在多样性上, 冠层上部叶片细菌分布均匀度高于冠层下部, 冠层内叶片上表面的细菌分布均匀度高于下表面。在结构组成上, 冠层上部叶片的上表面(US)和下表面(UB)的优势菌群分别为寡养单胞菌属(Stenotrophomonas)和泛菌属(Pantoea); 冠层下部叶片的上表面(LS)和下表面(LB)的优势菌群分别为沙雷氏菌属(Serratia)和泛菌属。在功能预测上, 细菌群落的运输和代谢潜力有明显差异, 包含碳水化合物、次生代谢物、氨基酸和脂质。在相关性上, 冠层内叶片表面菌属芽孢杆菌属、不粘柄菌属和苯基杆菌属的相对丰度与病原菌的相对丰度负相关性显著, 相关性最大的为芽孢杆菌属, 系数为−0.87。
| [1] |
LINDOW S E, BRANDL M T. Microbiology of the phyllosphere[J]. Applied and Environmental Microbiology, 2003, 69(4): 1875-1883. DOI:10.1128/AEM.69.4.1875-1883.2003 |
| [2] |
CORDIER T, ROBIN C, CAPDEVIELLE X, et al. The composition of phyllosphere fungal assemblages of European beech (Fagus sylvatica) varies significantly along an elevation gradient[J]. New Phytologist, 2012, 196(2): 510-519. DOI:10.1111/j.1469-8137.2012.04284.x |
| [3] |
UNTERSEHER M, SIDDIQUE A B, BRACHMANN A, et al. Diversity and composition of the leaf mycobiome of beech (Fagus sylvatica) are affected by local habitat conditions and leaf biochemistry[J]. PLoS One, 2016, 11(4): e0152878. DOI:10.1371/journal.pone.0152878 |
| [4] |
COPELAND J K, YUAN L J, LAYEGHIFARD M, et al. Seasonal community succession of the phyllosphere microbiome[J]. Molecular Plant-Microbe Interactions, 2015, 28(3): 274-285. DOI:10.1094/MPMI-10-14-0331-FI |
| [5] |
REDFORD A J, FIERER N. Bacterial succession on the leaf surface: A novel system for studying successional dynamics[J]. Microbial Ecology, 2009, 58(1): 189-198. DOI:10.1007/s00248-009-9495-y |
| [6] |
HUNTER P J, HAND P, PINK D, et al. Both leaf properties and microbe-microbe interactions influence within-species variation in bacterial population diversity and structure in the lettuce (Lactuca species) phyllosphere[J]. Applied and Environmental Microbiology, 2010, 76(24): 8117-8125. DOI:10.1128/AEM.01321-10 |
| [7] |
OSONO T, MORI A. Distribution of phyllosphere fungi within the canopy of giant dogwood[J]. Mycoscience, 2004, 45(3): 161-168. DOI:10.1007/S10267-003-0167-3 |
| [8] |
刘波, 郑雪芳, 孙大光, 等. 柑橘黄龙病株不同部位内生细菌群落结构的多样性[J]. 生态学报, 2011, 31(24): 7325-7342. LIU B, ZHENG X F, SUN D G, et al. The community structure of endophytic bacteria in different parts of huanglongbing-affected citrus plants[J]. Acta Ecologica Sinica, 2011, 31(24): 7325-7342. |
| [9] |
KRIMM U, ABANDA-NKPWATT D, SCHWAB W, et al. Epiphytic microorganisms on strawberry plants (Fragaria ananassa cv. Elsanta): Identification of bacterial isolates and analysis of their interaction with leaf surfaces[J]. FEMS Microbiology Ecology, 2005, 53(3): 483-492. DOI:10.1016/j.femsec.2005.02.004 |
| [10] |
ZHOU Z X, JIANG H, YANG C, et al. Microbial community on healthy and diseased leaves of an invasive plant Eupatorium adenophorum in Southwest China[J]. The Journal of Microbiology, 2010, 48(2): 139-145. DOI:10.1007/s12275-010-9185-y |
| [11] |
张庆, 朱继熹, 冷怀琼. 苹果叶表附生微生物区系及其有益菌的研究Ⅱ、有益芽孢杆菌的筛选、初步鉴定和电镜观察[J]. 云南农业大学学报, 1997, 12(3): 147-152. ZHANG Q, ZHU J X, LENG H Q. A preliminary studies on the epiphytic microorganism of the apple phylloplane and the beneficial microorganism Ⅱ. The sift identification, and scanning elemicroscope observation on the beneficial microorganisms[J]. Journal of Yunnan Agricultural University, 1997, 12(3): 147-152. |
| [12] |
罗路云, 张卓, 金德才, 等. 南瓜白粉病不同病情等级下叶际细菌群落结构和多样性[J]. 植物病理学报, 2017, 47(5): 688-695. LUO L Y, ZHANG Z, JIN D C, et al. Phyllosphere bacterial diversities and community structures on pumkin with different severities of powdery mildew[J]. Acta Phytopathologica Sinica, 2017, 47(5): 688-695. |
| [13] |
周凌云, 向芬, 刘红艳, 等. 茶白星病不同病情等级下叶际细菌群落多样性与功能预测[J]. 茶叶通讯, 2019, 46(1): 24-31. ZHOU L Y, XIANG F, LIU H Y, et al. Function prediction and phyllosphere bacterial diversities on leave with different severities of tea white scab disease[J]. Tea Communication, 2019, 46(1): 24-31. |
| [14] |
西山达郎, 秋山文司, 周垂桓. 甲基托布津对桑轮纹病的防治效果[J]. 国外农学蚕业, 1984(3): 43-44. XISHAN D L, QIUSHAN W S, ZHOU C H. Preventive effect of thiophanate-methyl on mulberry ringworm[J]. China Sericulture, 1984(3): 43-44. |
| [15] |
章一鸣, 赵雁, 吴庭观, 等. 桑树轮纹病病原菌的分离鉴定及其生物学特性研究[J]. 西部林业科学, 2014, 43(3): 51-56. ZHANG Y M, ZHAO Y, WU T G, et al. Isolation and biological characteristics of pathogenic fungus causing ring rot on mulberry leaves[J]. Journal of West China Forestry Science, 2014, 43(3): 51-56. DOI:10.3969/j.issn.1672-8246.2014.03.011 |
| [16] |
匡英秋, 叶武光, 卢卫芳, 等. 桑轮纹病的化学防治试验初报[J]. 中国蚕业, 2011, 32(4): 17-19. KUANG Y Q, YE W G, LU W F, et al. Preliminary report on chemical control experiment of ring rot on mulberry leaves[J]. China Sericulture, 2011, 32(4): 17-19. DOI:10.3969/j.issn.1007-0982.2011.04.007 |
| [17] |
陈田飞, 肖建京, 丰卫忠, 等. 淳安县桑轮斑病发生与防控技术探讨[J]. 中国蚕业, 2015, 36(4): 83-86. CHEN T F, XIAO J J, FENG W Z, et al. Discussion on occurrence, prevention and control technology of ring rot on mulberry leaves in Chun'an County[J]. China Sericulture, 2015, 36(4): 83-86. DOI:10.3969/j.issn.1007-0982.2015.04.019 |
| [18] |
白景彰, 周顺心, 雷扶生, 等. 百色蚕区发生的桑轮纹病调查初报[J]. 广西蚕业, 1994(2): 36. BAI J Z, ZHOU S X, LEI F S, et al. Preliminary report on investigation of mulberry ring rot in Baise silkworm area[J]. Guangxi Sericulture, 1994(2): 36. |
| [19] |
王谢, 唐甜, 张建华. 一种桑轮纹病病叶发病程度的评价指数[J]. 中国蚕业, 2018, 39(4): 19-21. WANG X, TANG T, ZHANG J H. Evaluation index of disease degree of ring rot on mulberry leaves[J]. China Sericulture, 2018, 39(4): 19-21. |
| [20] |
王谢, 张建华. 用桑叶最大重叠度指数和桑树冠层内部透光性指数表征桑树冠层特征[J]. 中国蚕业, 2017, 38(4): 1-5. WANG X, ZHANG J H. Characterization of mulberry canopy with mulberry leaf maximum overlap index and mulberry canopy internal transmittance index[J]. China Sericulture, 2017, 38(4): 1-5. |
| [21] |
杨广容, 马燕, 蒋宾, 等. 基于16S rDNA测序对茶园土壤细菌群落多样性的研究[J]. 生态学报, 2019, 39(22): 8452-8461. YANG G R, MA Y, JIANG B, et al. Analysis of the bacterial community and diversity in tea plantation soil via 16S rDNA sequencing[J]. Acta Ecologica Sinica, 2019, 39(22): 8452-8461. |
| [22] |
BOKULICH N A, JOSEPH C M L, ALLEN G, et al. Next-generation sequencing reveals significant bacterial diversity of botrytized wine[J]. PLoS One, 2012, 7(5): e36357. DOI:10.1371/journal.pone.0036357 |
| [23] |
ZHANG J J, KOBERT K, FLOURI T, et al. PEAR: A fast and accurate Illumina Paired-End reAd merger[J]. Bioinformatics, 2014, 30(5): 614-620. DOI:10.1093/bioinformatics/btt593 |
| [24] |
SCHMIEDER R, EDWARDS R. Quality control and preprocessing of metagenomic datasets[J]. Bioinformatics, 2011, 27(6): 863-864. DOI:10.1093/bioinformatics/btr026 |
| [25] |
EDGAR R C. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [26] |
SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur: Open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
| [27] |
WANG Q, GARRITY G M, TIEDJE J M, et al. Naïve bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [28] |
PARKS D H, TYSON G W, HUGENHOLTZ P, et al. STAMP: Statistical analysis of taxonomic and functional profiles[J]. Bioinformatics, 2014, 30(21): 3123-3124. DOI:10.1093/bioinformatics/btu494 |
| [29] |
LANGILLE M G I, ZANEVELD J, CAPORASO J G, et al. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J]. Nature Biotechnology, 2013, 31(9): 814-821. DOI:10.1038/nbt.2676 |
| [30] |
TILMAN D, DOWNING J A. Biodiversity and stability in grasslands[J]. Nature, 1994, 367(6461): 363-365. DOI:10.1038/367363a0 |
| [31] |
BASKIN Y. Ecosystem function of biodiversity: Regarding ideal levels of species richness, the data are few and unclear[J]. BioScience, 1994, 44(10): 657-660. DOI:10.2307/1312507 |
| [32] |
JOUANNEAU Y, MICOUD J, MEYER C. Purification and characterization of a three-component salicylate 1-hydroxylase from Sphingomonas sp. strain CHY-1[J]. Applied and Environmental Microbiology, 2007, 73(23): 7515-7521. DOI:10.1128/AEM.01519-07 |
| [33] |
胡杰, 何晓红, 李大平, 等. 鞘氨醇单胞菌研究进展[J]. 应用与环境生物学报, 2007, 13(3): 431-437. HU J, HE X H, LI D P, et al. Progress in research of Sphingomonas[J]. Chinese Journal of Applied & Environmental Biology, 2007, 13(3): 431-437. DOI:10.3321/j.issn:1006-687X.2007.03.030 |
| [34] |
BERG G, BALLIN G. Bacterial antagonists to Verticillium dahliae Kleb[J]. Journal of Phytopathology, 1994, 141(1): 99-110. DOI:10.1111/j.1439-0434.1994.tb01449.x |
| [35] |
ADHIKARI T B, JOSEPH C M, YANG G P, et al. Evaluation of bacteria isolated from rice for plant growth promotion and biological control of seedling disease of rice[J]. Canadian Journal of Microbiology, 2001, 47(10): 916-924. DOI:10.1139/w01-097 |
| [36] |
CARTER M Q, XUE K, BRANDL M T, et al. Functional metagenomics of Escherichia coli O157:H7 interactions with spinach indigenous microorganisms during biofilm formation[J]. PLoS One, 2012, 7(9): e44186. DOI:10.1371/journal.pone.0044186 |
| [37] |
DE MAAYER P, CHAN W Y, RUBAGOTTI E, et al. Analysis of the Pantoea ananatis pan-genome reveals factors underlying its ability to colonize and interact with plant, insect and vertebrate hosts[J]. BMC Genomics, 2014, 15(1): 404. DOI:10.1186/1471-2164-15-404 |
| [38] |
顾沁, 张昊, 黄海, 等. 一种玉米新型细菌性褐腐病的病原鉴定[J]. 植物保护, 2016, 42(3): 87-90. GU Q, ZHANG H, HUANG H, et al. Identification of the bacteria causing a new brown stalk rot on maize[J]. Plant Protection, 2016, 42(3): 87-90. DOI:10.3969/j.issn.0529-1542.2016.03.014 |
| [39] |
AZAD H R, HOLMES G J, COOKSEY D A. A new leaf blotch disease of sudangrass caused by Pantoea ananas and Pantoea stewarii[J]. Plant Disease, 2000, 84(9): 973-979. DOI:10.1094/PDIS.2000.84.9.973 |
| [40] |
MORALES-VALENZUELA G, SILVA-ROJAS H V, OCHOA-MARTINEZ D, et al. First report of Pantoea agglomerans causing leaf blight and vascular wilt in maize and sorghum in Mexico[J]. Plant Disease, 2007, 91(10): 1365. |
| [41] |
曹慧英. 玉米新病害——细菌干茎腐病的研究[D]. 北京: 中国农业科学院, 2010 CAO H Y. Bacterial dry stalk rot in maize, a new disease[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010 |
| [42] |
刘雅琴, 任毓忠, 李国英, 等. 新疆棉花细菌性烂铃病病原菌鉴定[J]. 植物病理学报, 2008, 38(3): 238-243. LIU Y Q, REN Y Z, LI G Y, et al. Identification of causal agent of bacterial boll rot in cotton from Xinjiang[J]. Acta Phytopathologica Sinica, 2008, 38(3): 238-243. DOI:10.3321/j.issn:0412-0914.2008.03.003 |
| [43] |
严玉宁, 何红, 叶艺俊, 等. 香蕉叶鞘腐败病病原鉴定[J]. 植物病理学报, 2011, 41(2): 124-130. YAN Y N, HE H, YE Y J, et al. Identification of the pathogen causing banana sheath rot disease[J]. Acta Phytopathologica Sinica, 2011, 41(2): 124-130. |
| [44] |
陈杰, 白文文, 陈洁, 等. 桑叶穿孔病病叶表面的微生物分离鉴定和微型害虫调查[J]. 蚕业科学, 2016, 42(6): 979-987. CHEN J, BAI W W, CHEN J, et al. Isolation and identification of microorganisms on mulberry leaf surface with shot-hole disease and investigation of the tiny pests[J]. Acta Sericologica Sinica, 2016, 42(6): 979-987. |
| [45] |
戴凡炜, 罗国庆, 王振江, 等. 华南蚕区桑枯萎病病原菌的分离与分子鉴定[J]. 蚕业科学, 2012, 38(6): 981-987. DAI F W, LUO G Q, WANG Z J, et al. Isolation and molecular identification of the pathogen causing mulberry wilt disease in southern sericultural areas of China[J]. Acta Sericologica Sinica, 2012, 38(6): 981-987. |
| [46] |
任慧爽, 徐伟芳, 王爱印, 等. 桑树内生细菌多样性及内生拮抗活性菌群的研究[J]. 西南大学学报(自然科学版), 2017, 39(1): 36-45. REN H S, XU W F, WANG A Y, et al. Research on biodiversity of endophytic bacteria and the antagonistic endophytes in mulberry[J]. Journal of Southwest University (Natural Science Edition), 2017, 39(1): 36-45. |
| [47] |
PÉREZ-GARCÍA A, ROMERO D, DE VICENTE A. Plant protection and growth stimulation by microorganisms: Biotechnological applications of Bacilli in agriculture[J]. Current opinion in biotechnology, 2011, 22(2): 187-193. DOI:10.1016/j.copbio.2010.12.003 |
| [48] |
GOND S K, BERGEN M S, TORRES M S, et al. Endophytic Bacillus spp. produce antifungal lipopeptides and induce host defence gene expression in maize[J]. Microbiological Research, 2015, 172: 79-87. DOI:10.1016/j.micres.2014.11.004 |
| [49] |
王坚, 刁治民, 徐广, 等. 植物内生菌的研究概况及其应用[J]. 青海草业, 2008, 17(1): 24-28. WANG J, DIAO Z M, XU G, et al. Study and application on endophyt[J]. Qinghai Prataculture, 2008, 17(1): 24-28. |
| [50] |
STEIN T. Bacillus subtilis antibiotics: Structures, syntheses and specific functions[J]. Molecular Microbiology, 2005, 56(4): 845-857. DOI:10.1111/j.1365-2958.2005.04587.x |
| [51] |
王若琳, 徐伟芳, 王飞, 等. 桑树内生拮抗菌的分离鉴定及其对桑断枝烂叶病的生防初探[J]. 微生物学报, 2019, 59(11): 2130-2143. WANG R L, XU W F, WANG F, et al. Isolation and identification of an antagonistic endophytic bacterium from mulberry for biocontrol against Boeremia exigua[J]. Acta Microbiologica Sinica, 2019, 59(11): 2130-2143. |
| [52] |
王彪, 潘英豪, 侯佳蓝, 等. 一种桑树细菌性病原内生拮抗细菌的筛选、鉴定及其生防活性[J]. 微生物前沿, 2019, 8(3): 110-120. WANG B, PAN Y H, HOU J L, et al. Screening, identification of an antagonistic endophyte to pathogens of mulberry bacterial diseases from mulberry leaves and its biocontrol activity[J]. Advances in Microbiology, 2019, 8(3): 110-120. |
| [53] |
谢洁, 任慧爽, 唐翠明, 等. 一株桑树内生细菌的鉴定和对桑椹核地杖菌的拮抗作用[J]. 蚕业科学, 2015, 41(5): 815-824. XIE J, REN H S, TANG C M, et al. Identification of a mulberry endophytic bacterium and its antagonistic activity on Scleromitula shiraiana[J]. Acta Sericologica Sinica, 2015, 41(5): 815-824. |
| [54] |
方翔, 徐伟芳, 牛娜, 等. 一株桑树内生拮抗菌的分离、鉴定及发酵条件优化[J]. 微生物学报, 2018, 58(12): 2147-2160. FANG X, XU W F, NIU N, et al. Screening, identification and optimization of fermentation conditions of an antagonistic endophytic bacterium from mulberry[J]. Acta Microbiologica Sinica, 2018, 58(12): 2147-2160. |
| [55] |
朱志贤, 于翠, 李勇, 等. 一株桑椹菌核病生防菌分离鉴定及其拮抗作用分析[J]. 中国森林病虫, 2019, 38(5): 1-7. ZHU Z X, YU C, LI Y, et al. Isolation and identification of an antagonistic bacterium against mulberry fruit sclerotiniosis and analysis of its antagonistic effects[J]. Forest Pest and Disease, 2019, 38(5): 1-7. |
| [56] |
TAYLOR D L, WALTERS W A, LENNON N J, et al. Accurate estimation of fungal diversity and abundance through improved lineage-specific primers optimized for illumina amplicon sequencing[J]. Applied and Environmental Microbiology, 2016, 82(24): 7217-7226. |
 2021, Vol. 29
2021, Vol. 29



