2. 宁夏大学农学院 银川 750021;
3. 宁夏农林科学院农业资源与环境研究所 银川 750021;
4. 宁夏优势特色作物现代分子育种重点实验室 银川 750021
2. College of Agriculture, Ningxia University, Yinchuan 750021, China;
3. Institute of Agricultural Resources and Environment, Ningxia Academy of Agriculture and Forestry Sciences, Yinchuan 750021, China;
4. Key Laboratory of Modern Molecular Breeding for Dominant Characteristic Crops in Ningxia, Yinchuan 750021, China
土壤盐渍化是阻碍植物生长发育的非生物胁迫因素之一。近年来, 宁夏引黄灌区农田土壤盐渍化问题受到了宁夏自治区政府的高度关注[1]。银川地区盐碱地已占总耕地面积的49%以上, 土壤盐碱化已成为影响宁夏农业生产的重要问题之一。紫花苜蓿(Medicago sativa L.)是干旱和半干旱地区重要的饲草作物[2], 因其高蛋白含量、高消化率、高适口性和高产奶品质, 也是银北盐碱地种植的先锋作物[3]。随着耕地面积的减少, 紫花苜蓿种植逐渐向盐碱地集中, 大力提高盐碱地苜蓿产量已经成为苜蓿生产的主攻方向。光合作用是作物稳产和高产的生理基础, 易受环境因素的影响和制约, 其中盐胁迫是抑制光合作用的主要因素之一。因此, 研究盐胁迫下紫花苜蓿光合生化过程, 对揭示紫花苜蓿的耐盐机制, 确保紫花苜蓿高产稳产具有重要的理论意义和实践价值。
光合作用既是植物生态系统碳循环的组成部分, 又是植物生物量发展的决定性因素。目前对光合作用过程的研究已引起许多领域的关注。盐胁迫对植物光合生理的影响是胁迫逆境生理研究的热点之一, 但盐胁迫对植物光合作用的影响非常复杂, 不同作物对盐胁迫的响应也存在很大差异。众多学者围绕盐胁迫下植物光合荧光等基本参数进行了研究[4-5], 但由于植物叶片内部的光合生理生化反应过程非常复杂, 普通的光合经验模型虽然可以描述光合速率与环境因子间的数量关系[6], 但是不能反映叶片光合生理生化特性[7]。FvCB模型是由Farquhar等[8]提出的植物光合生化模型, 可以很好地预测植物叶片光合系统的内部变化状况, 反映影响叶片光合能力的光合生理生化特性。近年来, 唐星林等[9-10]系统介绍了FvCB模型的建立、发展过程和拟合方法等基本理论, 综述了该模型在叶片光合生理对光、CO2、水、温度和氮营养等环境因子变化响应机制中的应用研究, 并且利用该模型对几种草本和木本植物光合生理生化特性进行了参数比较。梁星云等[11]利用FvCB模型计算阔叶红松(Pinus koraiensis Sieb. et Zucc.)原始林群落4个主要树种重要的光合生理参数, 结果表明, 4个树种的叶片生理参数存在较大差异且随季节变化发生波动, 在温带阔叶红松林生态系统碳动态的模拟预测中, 应该考虑最大羧化速率(Vcmax)的季节变化, 为温带森林生态系统碳动态的模拟和预测提供基础数据。康华靖等[12]利用FvCB模型对小麦(Triticum aestivum L.)的最大电子传递速率(Jmax)进行估算, 研究表明在FvCB模型中, 非直角双曲线模型会高估小麦J-I曲线中的Jmax, 而由FvCB模型中的子模型估算的Jmax则小于观测值。Han等[13]利用层次贝叶斯方法对FvCB生化光合模型参数进行敏感性分析和估计。可见, 国内外学者关于FvCB模型主要围绕综述分析[9, 14]、模型校正[15-16]、参数比较[10-11]、植物光合生化模型模拟[12-13]等方面进行研究, 缺乏将FvCB模型运用于盐胁迫下紫花苜蓿光合的相关研究, 且对盐胁迫下紫花苜蓿幼苗叶片内部的光合生理生化参数和耐盐性临界值的研究鲜见报道。
本研究基于FvCB模型, 研究了NaCl胁迫下紫花苜蓿叶片光合生化参数, 进而预测牧草叶片光合系统的内部变化状况, 为明确植物对盐分胁迫的适应机制提供参考, 同时对制定有效的调控措施以提高植物耐盐能力具有重要意义。
1 材料与方法 1.1 试验设计试验于2019年5—9月在宁夏大学西北退化生态系统恢复与重建教育部重点实验室人工气候室(38°30′N, 106°8′E)进行。以美国Cal/West公司育成的高产高品质和抗病耐盐性好且在宁夏盐碱地广泛推广种植和适宜性表现较好的多叶苜蓿新品种‘阿迪娜’为试验材料(来自于宁夏大学种质资源库)。苜蓿种子用0.1% HgCl2消毒8 min, 然后用75%酒精消毒30 s, 再用蒸馏水漂洗5~6遍, 将清洗消毒之后的种子均匀铺在放好滤纸的培养皿中, 并将滤纸用蒸馏水喷湿, 放入人工培养箱培养至种子发芽(温度控制在26 ℃)。待幼苗长至两叶一心时移至装有3 L Hoagland’s营养液的水培箱进行培养, 每3 d更换一次营养液。在营养液中培养至3~4片真叶时开始NaCl盐分胁迫, NaCl直接加入水培液中, 以便根系直接吸收减少误差。盐溶液浓度分别为40 mmol∙L−1、80 mmol∙L−1、120 mmol∙L−1和160 mmol∙L−1, 用T1、T2、T3、T4来表示。以浇灌营养液作为对照(CK), 每个处理3个重复。胁迫10 d后, 选取全展开叶测定光合指标。
1.2 光响应曲线与CO2响应曲线的测定采用便携式光合作用仪(Li-6400XT, 美国)测定紫花苜蓿幼苗叶片的CO2响应曲线和光响应曲线, 每处理3次重复。使用钢化瓶控制参比室中的CO2浓度。植株叶片先在光合有效辐射1500 μmol·m−2·s−1、温度(28±2) ℃、空气相对湿度40%~50%条件下诱导30 min以上, 待到光合速率和气孔导度相对稳定后开始测定曲线。测定CO2响应曲线时, 光强设为1800 μmol·m−2·s−1, CO2浓度梯度(μmol·mol−1)设为: 400、300、200、100、50、400、400、600、800、1000、1200、1600和1800; 测定光响应曲线时, 光强梯度(μmol·m−2·s−1)设为: 1800、1500、1200、1000、800、600、400、200、150、50和0。
1.3 FvCB模型 1.3.1 模型描述FvCB模型是根据Farquhar等[8]确定的生物化学光合模型, 可以定义为:
| $ {P}_{\mathrm{n}}=\mathrm{min}\left\{{A}_{\mathrm{c}}\right., \left.{A}_{\mathrm{j}}, {A}_{\mathrm{p}}\right\}(\rm{1}{-\mathit{\Gamma} }^{*}/{C}_{\mathrm{c}})-{R}_{\mathrm{d}} $ | (1) |
式中: Pn为净光合速率(μmol m−2·s−1), Ac、Aj和Ap分别为受Rubisco、RuBP和TPU限制阶段的净光合速率(μmol·m−2·s−1)。其3个子模型公式如下:
| ${A_{\rm{c}}} = {V_{{\rm{cmax}}}}\left[ {\frac{{{C_{\rm{c}}} - {\mathit{\Gamma} ^*}}}{{{C_{\rm{c}}} + {K_{\rm{c}}}(1 + o/{K_{\rm{o}}})}}} \right] - {R_{\rm{d}}}$ | (2) |
| $ {A}_{\mathrm{j}}=\frac{J({C}_{\mathrm{i}}-{\mathit{\Gamma} }^{*})}{4{C}_{\mathrm{i}}+8{\mathit{\Gamma} }^{*}}-{R}_{\mathrm{d}} $ | (3) |
| $ {A}_{\mathrm{p}}=\frac{3{T}_{\mathrm{p}}({C}_{\mathrm{c}}-{\mathit{\Gamma} }^{*})}{{C}_{\mathrm{c}}-(1+3\alpha ){\mathit{\Gamma} }^{*}} $ | (4) |
| $J = \frac{{\sigma I + {J_{\max }} - \sqrt {{{(\sigma I + {J_{\max }})}^2} - 4\theta \sigma I{J_{\max }}} }}{{2\theta }}$ | (5) |
式中: Vcmax是Rubisco活性的最大速率(μmol·m−2·s−1), 用分光光度法测定; Cc和o分别表示CO2和O2的分压(Pa); Γ*表示在CO2补偿点时线粒体呼吸速率为0 μmol(CO2)·m−2·s−1; Kc和Ko分别表示羧化和氧化的米氏门顿常数(kPa或Pa); α表示乙醇酸碳在光呼吸循环中循环的未返回部分; J为RuBP受限阶段的电子运输速率(μmol·m−2·s−1); Ci为胞间CO2浓度(μmol·mol−1); Rd表示叶片在光照下的暗呼吸速率(mol·m−2·s−1); Tp表示磷酸丙糖从叶绿体出口的速率(μmol·m−2·s−1); σ表示叶片吸收常数; I表示被PSⅡ吸收的光合有效辐射; θ为曲率; Jmax表示最大电子传递速率(μmol·m−2·s−1), 用LI-6400XT光合测定仪测定叶片所有光合指标和电子传递速率.
1.3.2 叶肉导度叶肉导度(gm)计算式如下:
| $ {g}_{\mathrm{m}}=\frac{P}{{C}_{\mathrm{i}}-{C}_{\mathrm{c}}} $ | (6) |
式中: P为实际净光合速率(μmol·m−2·s−1)。
1.3.3 温度依赖性| $ T({K}_{\mathrm{c}}, {K}_{\mathrm{o}}, \mathit{\Gamma} )={K}_{25}\mathrm{exp}[{E}_{\mathrm{a}}({T}_{\mathrm{k}}-298)]/(298\mathrm{R}{T}_{\mathrm{k}}) $ | (7) |
式中: K25表示Kc、Ko、Γ*在25 ℃下的绝对值(Pa); Ea为Kc、Ko和Γ*的活化能(J·mol−1); Tk表示叶片温度; R为通用的气体常数。
FvCB模型参数的温度依赖性可利用阿伦尼乌斯方程来建立参数与温度间的函数关系[19-20]。
| $ T({J}_{\mathrm{m}\mathrm{a}\mathrm{x}}, {V}_{\mathrm{c}\mathrm{m}\mathrm{a}\mathrm{x}}, {R}_{\mathrm{d}}, {g}_{\mathrm{m}})={K}_{25}\mathrm{exp}\{{E}_{\mathrm{a}}({T}_{\mathrm{k}}-298)/\left(298\mathrm{R}{T}_{\mathrm{k}}\right)\} $ | (8) |
式中: K25为Vcmax、Jmax、Rd或gm在25 ℃下的绝对值; Ea(EJ, EV, ER, Eg)是函数的指数增长率。FvCB模型的参数描述如表 1所示。
| 表 1 FvCB模型参数及范围 Table 1 Parameters and prior ranges of the FvCB model |
利用Excel 2010软件进行数据处理分析, 利用Origin 2018软件进行拟合分析和绘图, 利用SPSS 22.0进行单因素方差分析和多重比较(LSD < 0.05)。图中数据为平均值±标准差。
2 结果与分析 2.1 净光合速率对盐胁迫的响应不同NaCl水平下紫花苜蓿幼苗的净光合速率(Pn)随处理浓度的提高呈降低趋势(图 1)。与CK相比, 40 mmol∙L−1、80 mmol∙L−1、120 mmol∙L−1和160 mmol∙L−1 NaCl胁迫下Pn分别降低1.44%、3.85%、7.21%、7.90%, 均达显著性差异(P < 0.05), 且40 mmol·L−1、80 mmol·L−1 NaCl胁迫处理与120 mmol·L−1、160 mmol·L−1 NaCl胁迫处理间的Pn也存在显著性差异。采用线性方程对NaCl浓度和Pn进行拟合, 发现NaCl浓度与Pn呈显著负相关, 方程决定系数R2为0.951。
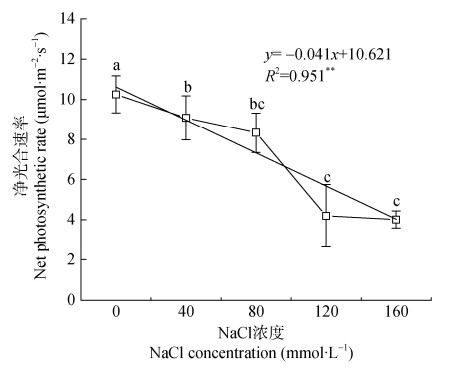
|
图 1 盐胁迫对紫花苜蓿幼苗叶片净光合速率的影响 Fig. 1 Effect of salt stress on leaves net photosynthetic rate of alfalfa seedlings 不同小写字母表示不同NaCl浓度间差异显著(P < 0.05)。Different lowercase letters mean significant differences among NaCl concentrations at P < 0.05 level. |
对不同NaCl胁迫下紫花苜蓿幼苗叶片净光合速率(Pn)与光合有效辐射(PAR)结果作散点图, 其实测值变化趋势如图 2所示。不同处理下的Pn均随着光照强度的增加而迅速上升, 正常处理(CK)的Pn增长速度明显高于T1、T2、T3和T4处理。且盐浓度越高Pn随光照强度增加的趋势越缓慢, 呈现明显的高盐胁迫(160 mmol·L−1 NaCl) < 低盐胁迫(40 mmol·L−1 NaCl) < 正常处理(CK)。
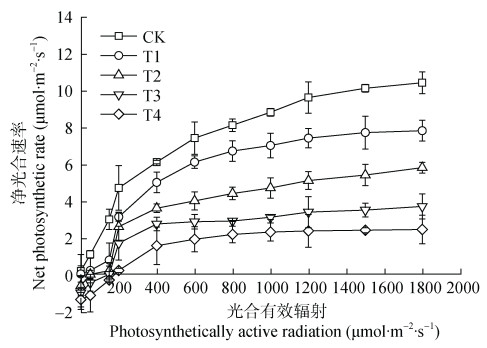
|
图 2 不同盐浓度处理下紫花苜蓿幼苗叶片光响应曲线变化 Fig. 2 Leaves light response curves of alfalfa seedling under different salt concentrations CK: 0 mmol·L−1 NaCl; T1: 40 mmol·L−1 NaCl; T2: 80 mmol·L−1 NaCl; T3: 120 mmol·L−1 NaCl; T4: 160 mmol·L−1 NaCl |
不同NaCl胁迫下紫花苜蓿幼苗叶片光合最大羧化速率(Vcmax)和最大电子传递速率(Jmax)均呈先缓慢升高后迅速降低的趋势, 以80 mmol·L−1 NaCl处理为最高, Vcmax和Jmax的最大值分别为68.03 μmol·m−2·s−1和165.25 μmol·m−2·s−1(图 3)。与正常处理(CK)相比, 40 mmol·L−1和80 mmol·L−1 NaCl胁迫增加了Vcmax和Jmax; 而120 mmol·L−1和160 mmol·L−1 NaCl胁迫显著降低了Vcmax和Jmax, 且二者之间无显著性差异。随盐胁迫水平的增加, 在25 ℃推算的最大羧化速率(Vcmax25)和最大电子传递速率(Jmax25)与实际温度下推算的Vcmax和Jmax表现出基本一致的趋势, 但在同一胁迫下推算的实际值高于在25 ℃下的推算值。相比较而言, Vcmax和Jmax受盐胁迫的程度更严重。
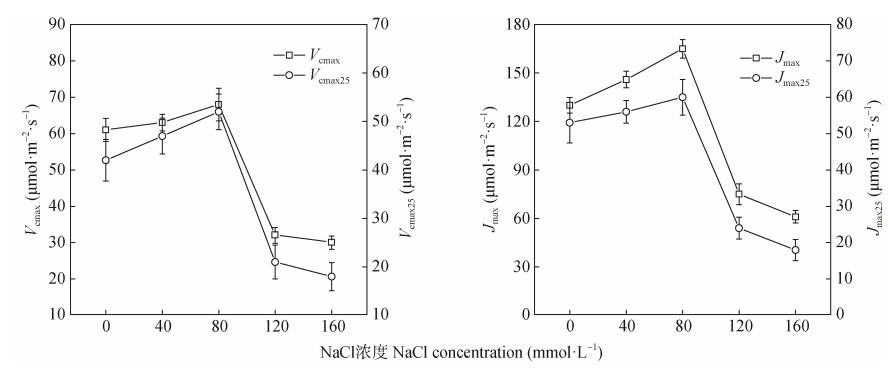
|
图 3 盐胁迫对紫花苜蓿叶片光合最大羧化速率(Vcmax)和最大电子传递速率(Jmax)的影响 Fig. 3 Effects of salt stress on photosynthetic maximum carboxylation rate (Vcmax) and maximum electron transfer rate (Jmax) of alfalfa leaves Vcmax25和Jmax25为推算的25 ℃最大羧化速率和最大电子传递速率。Vcmax25 and Jmax25 are calculated photosynthetic maximum carboxylation rate and maximum electron transfer rate at 25 ℃. |
不同NaCl水平下紫花苜蓿幼苗的叶肉导度(gm)随盐胁迫水平的增加呈降低趋势(图 4)。当NaCl浓度小于80 mmol·L−1时, 盐分胁迫对gm的影响无显著性差异, 但当NaCl浓度大于120 mmol·L−1时, 盐胁迫水平对gm的影响有显著性差异。采用线性回归方程进行拟合分析, 可以看出NaCl浓度与gm的显著性较高, 方程决定系数R2为0.931。不同NaCl胁迫水平下暗呼吸速率(Rd)的变化趋势与gm表现一致(4)。与正常处理(CK)相比, 当NaCl浓度大于40 mmol·L−1时, 盐胁迫水平对Rd有显著下降的影响, 但盐浓度80 mmol·L−1和120 mmol·L−1处理与盐浓度160 mmol·L−1处理间无显著性差异。采用线性方程拟合发现, 盐分浓度与Rd呈显著负相关, 方程决定系数R2为0.862。
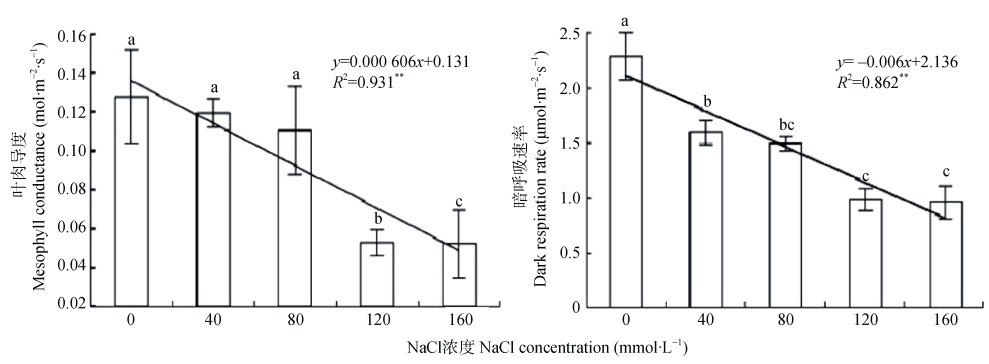
|
图 4 盐胁迫对紫花苜蓿叶片叶肉导度和暗呼吸速率的影响 Fig. 4 Effects of salt stress on leaf conductance and dark respiration rate of alfalfa leaves 不同小写字母表示不同NaCl浓度间差异显著(P < 0.05)。Different lowercase letters mean significant differences among NaCl concentrations at P < 0.05 level. |
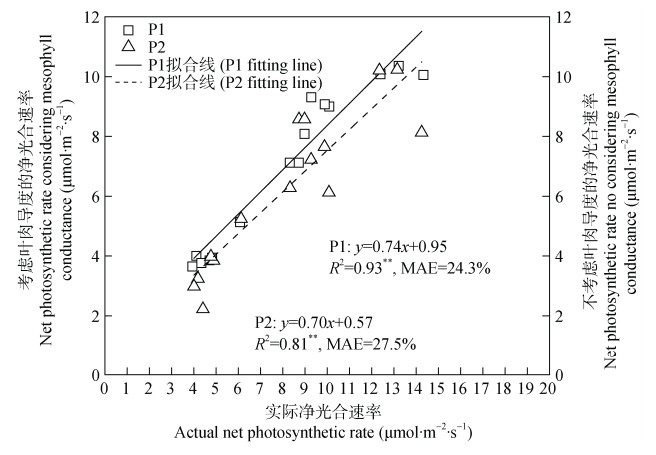
利用FvCB模型均能较好地拟合不同NaCl水平下紫花苜蓿幼苗叶片在引入叶肉导度(gm)和忽略gm条件下的净光合速率值(图 5)。考虑叶肉导度(gm)和忽略叶肉导度(gm)都能很好地模拟盐胁迫处理下植物叶片的光合速率, 实际净光合速率(P)和引入gm推算的净光合速率(P1)随着NaCl胁迫水平的升高呈现降低趋势, 其变化趋势表现一致。然而, 忽略gm推算的净光合速率(P2)在80 mmol·L−1 NaCl水平处理时净光合速率比40 mmol·L−1 NaCl水平处理的值更高。同时, 考虑叶肉导度将决定系数从0.81提高至0.93, 且平均绝对误差从27.5%降低至24.3%。
|
图 5 FvCB模型预测的净光合速率和实际净光合速率的关系 Fig. 5 Relationship between predicted net photosynthetic rate by FvCB model and actual net photosynthetic rate P1: 引入叶肉导度(gm)推算的净光合速率; P2: 忽略gm推算的净光合速率; R2: 决定系数; MAE: 平均绝对误差。P1: the net photosynthetic rate involving leaf conductance (gm); P2: the net photosynthetic rate ignoring gm; R2: determination coefficient; MAE: mean absolute error. |
Na+在植物叶片光合作用机制的正常功能维持方面发挥着举足轻重的作用[24-27], 但Na+的过量积累会导致其他离子失去平衡, 降低水和矿质元素的运输速率, 同时引起植物叶肉细胞中葡萄糖积累和淀粉水解加速, 减慢光合产物的输出, 抑制植物的光合作用[24-26], 并进一步损害叶片光系统以抑制光合碳同化过程[24-27]。一般情况下, 盐胁迫通过对植物产生离子毒害、渗透胁迫、代谢紊乱和营养失衡等现象进一步影响光合作用。净光合速率(Pn)是受盐胁迫程度影响最敏感的光合指标, 它表示植物叶片面积的同化能力, 并且能在一定程度上衡量植物适应逆境能力。本研究表明, 紫花苜蓿幼苗叶片的Pn随盐溶液浓度增加呈下降趋势。正常处理(CK)与其他胁迫处理间均存在显著性差异, 说明盐胁迫对紫花苜蓿幼苗叶片的光合作用均产生不同程度的影响; 这与前人在平欧杂种榛(Corylus heterophylla Fisch. × C. avellan)[26]上的研究结果不一致, 而与在桑树(Morus alba L.)[25]和棉花(Gossypium spp.)[27]上的研究结论相似。产生上述结果的原因可能是盐胁迫干扰了紫花苜蓿的新陈代谢并影响了光合产物的分布方向, 但紫花苜蓿仍可以在一定时间内和一定盐浓度下保持较高的光合速率。盐胁迫必然会对植物的生长过程产生抑制现象, 且盐胁迫水平越高, 抑制程度越严重[24-26]。王庆惠等[28]研究表明, 盐胁迫会破坏根系质膜, 引发渗透胁迫, 阻碍水分吸收和养分吸收并降低植物进入叶肉细胞的CO2速率, 从而导致光合作用减弱。对于处于不利条件下的植物, 应关闭气孔以减少蒸腾作用, 防止CO2进入叶片, 影响CO2参与羧化反应, 并降低净光合速率[8]。本研究采用FvCB模型对紫花苜蓿幼苗的光合生理生化特性进行研究, 结果表明, NaCl胁迫水平在0~80 mmol·L−1时, Vcmax和Jmax逐渐呈上升趋势, 表明轻度胁迫水平可促进1, 5-二磷酸核酮糖的再生速率和提高1, 5-二磷酸核酮糖羧化酶的合成, 这一研究结果与前人在高粱[Sorghum bicolor (L.) Moench][29]和棉花[27]作物上的结论相似。造成这种现象的原因是适宜的NaCl胁迫浓度会对脯氨酸含量产生影响, 加速合成1, 5-二磷酸核酮糖羧化酶蛋白质, 增强1, 5-二磷酸核酮糖羧化酶活性, 对光合作用产生促进作用, 从而促进光合作用并调节光合系统的电子传递过程[27]。NaCl胁迫水平在120~160 mmol·L−1时, Vcmax、Jmax以及gm均显著下降, 说明NaCl浓度高于120 mmol·L−1时, 植物体内1, 5-二磷酸核酮糖羧化酶的羧化功能和1, 5-二磷酸核酮糖再生速率显著下降, 光系统和酶系统受到损伤[4, 30]。Jmax25和Vcmax25在所有植物功能类型中都是高度敏感的参数。以往的研究已经证实, 适当的Jmax25和Vcmax25值对准确估计净光合速率至关重要[31]。本研究表明, 随盐胁迫水平的增加, 在25 ℃下推算的Jmax25和Vcmax25值与实际温度下推算的Vcmax和Jmax表现出基本一致的趋势, 但在同一胁迫水平下推算的实际值高于在25 ℃下的推算值。相比之下, Vcmax和Jmax受盐胁迫的程度更明显。主要是因为光合作用是一种生物化学过程, 具有很强的温度依赖性。在超过特定温度时1, 5-二磷酸核酮糖羧化酶活性可能会下降, 由于Jmax25和Vcmax25分别限制了高、低CO2浓度下的光合速率, 因此其值直接限制了1, 5-二磷酸核酮糖和1, 5-二磷酸核酮糖羧化酶的光合作用。
光响应曲线是研究光合有效辐射与净光合速率关系的模型, 通过分析光响应曲线可以获得最大净光合速率、光饱和点、光补偿点等关键的光合参数[7, 9-15], 由此可以了解植物的光化学过程及其对光合有效辐射的利用能力[9-15]。本文采用直角双曲线修正模型对紫花苜蓿的光响应曲线拟合表明, 各胁迫处理Pn随着光合有效辐射(PAR)梯度的增加均不同程度地呈上升趋势。但在同一光合有效辐射(PAR)下, Pn随着盐胁迫水平的增加呈下降趋势, 表明盐胁迫加重了紫花苜蓿光抑制强度, 降低了植物1, 5-二磷酸核酮糖羧化酶活性及电子传递速率, 光合作用是影响植物生长和作物产量的主要过程。除气孔和生物化学因子外, 叶片的光合能力还受到gm的抑制, gm调节着从细胞间隙到叶绿体基质羧化位点的CO2通量[32]。大量研究表明, 盐胁迫条件下生长的植株叶片gm显著小于正常条件下生长植株的叶片[25-26]。长期盐胁迫显著减少了表皮细胞和叶肉细胞的断面面积、宽度和半径, 从而使gm减小[25-26]。另外, 由于水通道蛋白基因的表达速率受盐胁迫的影响, 盐胁迫可能通过控制水通道蛋白基因的表达来调控gm。本研究表明, gm随NaCl胁迫水平的增加而下降, 说明随着NaCl浓度增加, 从气孔下腔到转移CO2的叶绿体羧化位点的整个途径均被破坏, 阻力增大, 降低CO2传输速率[33], 这与前人研究结果一致。引发这一现象的原因可能是盐胁迫减少了叶片的叶绿体面积, 并增加了细胞壁的厚度, 导致gm下降, 阻力增大[34], 从而降低了净光合速率。植物体内逆境胁迫浓度过大将会使离子失衡[35], 增强CO2运输阻力, 并损害紫花苜蓿叶绿体的内部构造, 净光合速率显著下降受叶肉因素和羧化限制的共同影响。本研究表明, 紫花苜蓿幼苗最大耐盐临界点范围为80~120 mmol·L−1, 超过临界耐盐值紫花苜蓿幼苗的光合机构会受到损伤, 抑制紫花苜蓿正常生长。
国内外学者在FvCB模型的研究中, 经常使用Ci代替Cc (CO2分压), 这会出现不可信的光合参数, 从而导致误差较大。由于CO2浓度会影响植物的光合速率, 因此gm可用于确定CO2转移对光合性能的影响。本研究表明, 随着gm的引入, FvCB模型模拟推算的净光合速率(P1)与实际测得的净光合速率(P)基本保持高度一致, 降低了平均绝对误差, 从而提高了模型拟合的准确性。通过以上研究, 为我国西北地区牧草固碳能力及其光合生理生化特性的研究提供理论基础, 为全球气候变化下优质牧草的光合生理生化响应的预测提供依据, 并为FvCB模型及其扩展模型在牧草作物光合生理研究及国内相关领域研究提供参考。
4 结论利用FvCB模型推算的紫花苜蓿幼苗叶片内部光合参数对盐胁迫的响应存在差异, 净光合速率、叶肉阻力和暗呼吸速率随着NaCl胁迫水平的提高呈显著下降趋势, 而最大羧化速率和最大电子传递速率表现为先升高后下降的趋势, 可见紫花苜蓿叶片光合作用受叶肉因素和羧化限制的双重影响。该研究可为我国北方盐碱地制定有效的调控措施, 适当减小外界环境条件对植物生长的影响, 增强其耐盐能力, 绿化环境, 获得生态效益。
| [1] |
董世德, 万书勤, 康跃虎, 等. 低洼盐渍区滴灌不同土壤水基质势对土壤盐分及速生杨生长的影响[J]. 水土保持学报, 2017, 31(1): 236-242. DONG S D, WAN S Q, KANG Y H, et al. Effect of different soil matric potentials on distribution of soil salt and growth of poplar (Populus) by drip irrigation in low-lying saline area[J]. Journal of Soil and Water Conservation, 2017, 31(1): 236-242. |
| [2] |
DÍAZ F J, GRATTAN S R, REYES J A, et al. Using saline soil and marginal quality water to produce alfalfa in arid climates[J]. Agricultural Water Management, 2018, 199: 11-21. DOI:10.1016/j.agwat.2017.12.003 |
| [3] |
FERREIRA J F S, CORNACCHIONE M V, LIU X, et al. Nutrient composition, forage parameters, and antioxidant capacity of alfalfa (Medicago sativa, L.) in response to saline irrigation water[J]. Agriculture, 2015, 2(3): 577-597. |
| [4] |
杨淑萍, 危常州, 梁永超. 盐胁迫对不同基因型海岛棉光合作用及荧光特性的影响[J]. 中国农业科学, 2010, 43(8): 1585-1593. YANG S P, WEI C Z, LIANG Y C. Effects of NaCl stress on the characteristics of photosynthesis and chlorophyll fluorescence at seedlings stage in different sea island cotton genotypes[J]. Scientia Agricultura Sinica, 2010, 43(8): 1585-1593. |
| [5] |
SHAHEEN S, NASEER S, ASHRAF M, et al. Salt stress affects water relations, photosynthesis, and oxidative defense mechanisms in Solanum melongena L[J]. Journal of Plant Interactions, 2013, 8(1): 85-96. DOI:10.1080/17429145.2012.718376 |
| [6] |
吴统贵, 周和锋, 吴明, 等. 旱柳光合作用动态及其与环境因子的关系[J]. 生态学杂志, 2008, 27(12): 2056-2061. WU T G, ZHOU H F, WU M, et al. Dynamics of Salix matsudana photosynthesis and its relations to environmental factors[J]. Chinese Journal of Ecology, 2008, 27(12): 2056-2061. |
| [7] |
高志奎, 高荣孚, 何俊萍, 等. 温室茄子(Solanum melongena L.)光合数学模型与光合生化模型模拟分析[J]. 生态学报, 2007, 27(6): 2265-2271. GAO Z K, GAO R F, HE J P, et al. Analysis of photosynthetic simulation by a biochemical model or mathematical model in greenhouse eggplant[J]. Acta Ecologica Sinica, 2007, 27(6): 2265-2271. DOI:10.3321/j.issn:1000-0933.2007.06.015 |
| [8] |
FARQUHAR G D, SHARKEY TD. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology, 1982, 33: 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
| [9] |
唐星林, 曹永慧, 顾连宏, 等. 基于FvCB模型的叶片光合生理对环境因子的响应研究进展[J]. 生态学报, 2017, 37(19): 6633-6645. TANG X L, CAO Y H, GU L H, et al. Advances in photo-physiological responses of leaves to environmental factors based on the FvCB model[J]. Acta Ecologica Sinica, 2017, 37(19): 6633-6645. |
| [10] |
唐星林, 周本智, 周燕, 等. 基于FvCB模型的几种草本和木本植物光合生理生化特性[J]. 应用生态学报, 2017, 28(5): 1482-1488. TANG X L, ZHOU B Z, ZHOU Y, et al. Photo-physiological and photo-biochemical characteristics of several herbaceous and woody species based on FvCB model[J]. Chinese Journal of Applied Ecology, 2017, 28(5): 1482-1488. |
| [11] |
梁星云, 刘世荣. 基于冠层塔吊原位测定长白山温带阔叶红松原始林群落主要树种的光合特征[J]. 应用生态学报, 2019, 30(5): 1494-1502. LIANG X Y, LIU S R. In-situ measurement of photosynthetic characteristics of dominant tree species based on canopy crane in a Korean pine broad-leaved forest in Changbai Mountain, northeastern China[J]. Chinese Journal of Applied Ecology, 2019, 30(5): 1494-1502. |
| [12] |
康华靖, 段世华, 安婷, 等. 基于FvCB模型估算小麦的最大电子传递速率[J]. 麦类作物学报, 2019, 39(11): 1377-1384. KANG H J, DUAN S H, AN T, et al. Estimation of maximum electron transport rate of wheat based on FvCB model[J]. Journal of Triticeae Crops, 2019, 39(11): 1377-1384. |
| [13] |
HAN T, ZHU G F, MA J Z, et al. Sensitivity analysis and estimation using a hierarchical Bayesian method for the parameters of the FvCB biochemical photosynthetic model[J]. Photosynthesis Research, 2020, 143(1): 45-66. DOI:10.1007/s11120-019-00684-z |
| [14] |
张彦敏, 周广胜. 植物叶片最大羧化速率及其对环境因子响应的研究进展[J]. 生态学报, 2012, 32(18): 5907-5917. ZHANG Y M, ZHOU G S. Advances in leaf maximum carboxylation rate and its response to environmental factors[J]. Acta Ecologica Sinica, 2012, 32(18): 5907-5917. |
| [15] |
梁星云, 刘世荣. FvCB生物化学光合模型及A-Ci曲线测定[J]. 植物生态学报, 2017, 41(6): 693-706. LIANG X Y, LIU S R. A review on the FvCB biochemical model of photosynthesis and the measurement of A-Ci curves[J]. Chinese Journal of Plant Ecology, 2017, 41(6): 693-706. |
| [16] |
MARTINS S C V, GALMÉS J, MOLINS A, et al. Improving the estimation of mesophyll conductance to CO2: On the role of electron transport rate correction and respiration[J]. Journal of Experimental Botany, 2013, 64(11): 3285-3298. DOI:10.1093/jxb/ert168 |
| [17] |
BERNACCHI C J, SINGSAAS E L, PIMENTEL C, et al. Improved temperature response functions for models of rubisco-limited photosynthesis[J]. Plant, Cell & Environment, 2001, 24(2): 253-259. |
| [18] |
BERNACCHI CJ, PORTIS A R, NAKANO H, et al. Temperature response of mesophyll conductance. Implications for the determination of Rubisco enzyme kinetics and for limitations to photosynthesis in vivo[J]. Plant Physiology, 2002, 130(4): 1992-1998. DOI:10.1104/pp.008250 |
| [19] |
LLOYD J, SYVERTSEN J P, KRIEDEMANN P E, et al. Low conductances for CO2 diffusion from stomata to the sites of carboxylation in leaves of woody species[J]. Plant, Cell & Environment, 1992, 15(8): 873-899. |
| [20] |
MEDLYN B E, DREYER E, ELLSWORTH D, et al. Temperature response of parameters of a biochemically based model of photosynthesis. Ⅱ. A review of experimental data[J]. Plant, Cell & Environment, 2002, 25(9): 1167-1179. |
| [21] |
PATRICK L D, OGLE K, TISSUE D T. A hierarchical Bayesian approach for estimation of photosynthetic parameters of C3 plants[J]. Plant, Cell & Environment, 2009, 32(12): 1695-1709. |
| [22] |
SHARKEY T D, BERNACCHI C J, FARQUHAR G D, et al. Fitting photosynthetic carbon dioxide response curves for C3 leaves[J]. Plant, Cell & Environment, 2007, 30(9): 1035-1040. |
| [23] |
SU Y H, ZHU G F, MIAO Z W, et al. Estimation of parameters of a biochemically based model of photosynthesis using a genetic algorithm[J]. Plant, Cell & Environment, 2009, 32(12): 1710-1723. |
| [24] |
房朋, 任丽丽, 张立涛, 等. 盐胁迫对杂交酸模叶片光合活性的抑制作用[J]. 应用生态学报, 2008, 19(10): 2137-2142. FANG P, REN L L, ZHANG L T, et al. Inhibition effects of salt stress on photosynthetic activity of Rumex K-1[J]. Chinese Journal of Applied Ecology, 2008, 19(10): 2137-2142. |
| [25] |
张会慧, 张秀丽, 李鑫, 等. NaCl和Na2CO3胁迫对桑树幼苗生长和光合特性的影响[J]. 应用生态学报, 2012, 23(3): 625-631. ZHANG H H, ZHANG X L, LI X, et al. Effects of NaCl and Na2CO3 stresses on the growth and photosynthesis characteristics of Morus alba seedlings[J]. Chinese Journal of Applied Ecology, 2012, 23(3): 625-631. |
| [26] |
罗达, 史彦江, 宋锋惠, 等. 盐胁迫对平欧杂种榛幼苗生长、光合荧光特性及根系构型的影响[J]. 应用生态学报, 2019, 30(10): 3376-3384. LUO D, SHI Y J, SONG F H, et al. Effects of salt stress on growth, photosynthetic and fluorescence characteristics, and root architecture of Corylus heterophylla ×C. avellan seedlings[J]. Chinese Journal of Applied Ecology, 2019, 30(10): 3376-3384. |
| [27] |
江晓慧, 高阳, 王广帅, 等. 基于FvCB模型分析盐分胁迫对棉花叶片光合作用的影响[J]. 应用生态学报, 2020, 31(5): 1653-1659. JIANG X H, GAO Y, WANG G S, et al. Examining effects of salt stress on leaf photosynthesis of cotton based on the FvCB model[J]. Chinese Journal of Applied Ecology, 2020, 31(5): 1653-1659. |
| [28] |
王庆惠, 杨嘉鹏, 向光荣, 等. 盐胁迫对不同基因型棉花苗期光合特性和养分吸收的影响[J]. 中国农业科技导报, 2018, 20(5): 9-15. WANG Q H, YANG J P, XIANG G R, et al. Effects of salt stress on root morphology and physiological characteristics of potted cotton at seedling stage[J]. Journal of Agricultural Science and Technology, 2018, 20(5): 9-15. |
| [29] |
孙璐, 周宇飞, 李丰先, 等. 盐胁迫对高粱幼苗光合作用和荧光特性的影响[J]. 中国农业科学, 2012, 45(16): 3265-3272. SUN L, ZHOU Y F, LI F X, et al. Impacts of salt stress on characteristics of photosynthesis and chlorophyll fluorescence of sorghum seedlings[J]. Scientia Agricultura Sinica, 2012, 45(16): 3265-3272. DOI:10.3864/j.issn.0578-1752.2012.16.005 |
| [30] |
边甜甜, 颜坤, 韩广轩, 等. 盐胁迫下菊芋根系脱落酸对钠离子转运和光系统Ⅱ的影响[J]. 应用生态学报, 2020, 31(2): 508-514. BIAN T T, YAN K, HAN G X, et al. Effects of root abscisic acid on Na+ transport and photosystem Ⅱ in Helianthus tuberosus under salt stress[J]. Chinese Journal of Applied Ecology, 2020, 31(2): 508-514. |
| [31] |
ATKIN O K, BLOOMFIELD K J, REICH P B, et al. Global variability in leaf respiration in relation to climate, plant functional types and leaf traits[J]. New Phytologist, 2015, 206(2): 614-636. DOI:10.1111/nph.13253 |
| [32] |
Flexas J, Ribas-Carbo M, Diaz-Espejo A, et al. Mesophyll conductance to CO2: Current knowledge and future prospects[J]. Plant, Cell & Environment, 2008, 31(5): 602-612. |
| [33] |
GALMÉS J, MEDRANO H, FLEXAS J. Acclimation of Rubisco specificity factor to drought in tobacco: Discrepancies between in vitro and in vivo estimations[J]. Journal of Experimental Botany, 2006, 57(14): 3659-3667. DOI:10.1093/jxb/erl113 |
| [34] |
韩吉梅, 张旺锋, 熊栋梁, 等. 植物光合作用叶肉导度及主要限制因素研究进展[J]. 植物生态学报, 2017, 41(8): 914-924. HAN J M, ZHANG W F, XIONG D L, et al. Mesophyll conductance and its limiting factors in plant leaves[J]. Chinese Journal of Plant Ecology, 2017, 41(8): 914-924. |
| [35] |
宁建凤, 郑青松, 杨少海, 等. 高盐胁迫对罗布麻生长及离子平衡的影响[J]. 应用生态学报, 2010, 21(2): 325-330. NING J F, ZHENG Q S, YANG S H, et al. Impact of high salt stress on Apocynum venetum growth and ionic homeostasis[J]. Chinese Journal of Applied Ecology, 2010, 21(2): 325-330. |
 2021, Vol. 29
2021, Vol. 29



