2. 甘肃省农业科学院旱地农业研究所 兰州 730070;
3. 西北农林科技大学农学院 杨凌 712100;
4. 北京市农林科学院植物营养与资源研究所 北京 100007;
5. 西北农林科技大学水土保持研究所/黄土高原土壤侵蚀与旱地农业国家重点实验室 杨凌 712100
2. Dry Farming Research Institute, Gansu Academy of Agricultural Sciences, Lanzhou 730070, China;
3. College of Agronomy, Northwest A & F University, Yangling 712100, China;
4. Institute of Plant Nutrition and Resources, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100007, China;
5. Institute of Soil and Water Conservation, Northwest A & F University/State Key Laboratory of Soil Erosion and Dryland Farming on the Loess Plateau, Yangling 712100, China
作为干旱半干旱地区重要的农业种植技术, 农膜施用在保持土壤水分、增加土壤温度、促进种子萌发和作物生长及提高产量方面发挥着巨大的作用[1]。然而, 作物收割所造成的农膜碎片化, 给农膜回收及捡拾造成了极大的困难, 从而累积在土壤中的农膜逐年增加[2-5]。据估计, 欧洲每年输入农田土壤的塑料颗粒为6.3~43.0万t, 北美农田塑料输入量约4.4~30.0万t, 已严重威胁土壤质量[6]。我国农田土壤的塑料残留量为0.1~324.5 kg∙hm−2, 平均83.6 kg∙hm−2[7]; 同时随着长期的施用及大面积推广, 农膜残留给农田土壤及周围生态环境造成了严重的危害[8]。
残留于土壤中的农膜, 一方面在耕作机械力的作用下, 其破碎程度增加, 并可与土壤颗粒聚合, 从而可能在土体内传输; 另一方面, 受光照、水分以及土壤微生物的作用, 进一步老化、降解, 从而对植物生长及土壤环境产生影响[9-10]。研究表明:在农膜添加条件下, 小麦(Triticum aestivum)的叶和根生物量积累均受到抑制[11]; 5~20 a农膜残留量的累积增加导致玉米(Zea mays)出苗率下降[12]。同时, 由于农膜残留的积累, 干扰作物的生长发育, 尤其是根系发育[13]。有研究表明, 随着土壤中农膜累积, 马铃薯(Solanum tuberosum)根系受到严重影响, 在农膜残留量为180 kg∙hm−2时, 根系体积减少[14]; 而土壤中残留的农膜不仅影响番茄(Solanum lycopersicum)幼苗根系的生长及分布, 且会降低根系活力[15]; 当残膜量达到900 kg∙hm−2时, 棉花(Gossypium spp.)根系向下伸长缓慢, 长度最小[16]。农膜残留对根生长的危害也影响植物对养分的吸收与积累, 进而影响植物的生长发育[17]。土壤中因农膜的存在导致马铃薯减产显著, 当农膜残留量为720 kg∙hm−2时, 其减产幅度最大, 与对照相比减产9.7%~14.5%[14]。随着土壤中农膜残留量的增加, 番茄幼苗的株高、茎粗、地上部及根系鲜重逐渐降低[15], 从而对农作物的生长及产量产生了明显的不良影响。此外, 尽管根系是植物从土壤中获取养分的主要途径, 其吸收的矿物质占总干物重的8%~9%[18], 而光合作用是植物获取能量和积累养分的主要来源, 光合产物累积量占总干物重的91%~92%[19-20]。因此, 土壤农膜残留对农作物生长及产量的影响不能仅仅考虑萌发、根系生长及产量状况, 还可能对植物光合作用特征产生影响。
光是光合作用的主导因子, 植物光合作用对光的响应体现了植物净光合速率和光合有效辐射之间的关系, 对研究植物光化学过程中的光化学效率具有重要的意义[21]。而CO2作为植物光合作用的原料, 其浓度及其利用效率影响着植物的光合作用过程, 进而影响植物的光合速率。研究发现, 农作物生长情况以及干物质量积累可以通过光合作用的能力来体现, 即光响应曲线[22-23]和CO2响应曲线[24]拟合参数来表征该植物的光合作用能力。叶子飘等[25]通过建立直角双曲线修正模型, 将所得的光响应与CO2响应曲线拟合值与实际测量值进行对比, 其所得拟合参数与实际情况更贴近[26-27], 从而被用来研究植物光合作用的生理特征。尽管农膜残留对产量的研究较多[28], 但农膜残留累积是否会影响作物的光合作用, 从而影响其生物量累积等方面的研究还尚未清楚。基于此, 本研究通过室外盆栽控制试验, 研究不同类型塑料及残留累积量下, 大豆(Glycine max)花期及初荚期叶片光合作用对光及CO2响应曲线以及地上、地下的生物量特征, 明确塑料类型及残留量对大豆生物量累积及叶片光生理响应特征的影响, 以期为农膜施用及生物可降解膜的生态安全评价提供依据。
1 材料与方法 1.1 试验材料及设计本试验依托土壤侵蚀与旱地农业国家重点实验室, 在干旱模拟试验基地(中国科学院水土保持研究所)进行, 其位于温带半湿润半干旱气候区, 具有显著的大陆性季风气候特征:年均气温12.9 ℃, 无霜期211 d, 年均日照时数2163.8 h, 年总太阳辐射量481.26 kJ∙cm−2, 年均降水量635.1 mm, 多集中在6—9月。试验用土采自于杨凌周边农田无农膜施用史的耕层土壤, 去除杂物及砾石后, 过筛(10 mm)并风干待用。农膜选取当地农户常用的聚乙烯薄膜(PE处理)及生物降解膜(98%聚己二酸丁二酯+聚乳酸, BP处理), 根据田间农膜残片大小, 剪裁为2 cm× 2 cm、1 cm×1 cm、0.5 cm×0.5 cm的碎片并按(1:1:1)均匀混合, 按照不同质量浓度梯度(0、0.1%、0.5%、1.0%)加入试验用土中, 并反复搅拌使其充分混合均匀。大豆种子由西北农林科技大学农学院大豆育种实验室提供, 品种为‘种群290’, 选择饱满且大小均匀的种子(单粒重: 0.23±0.02 g), 进行盆栽种植(花盆高26.5 cm、底部直径20 cm、顶部直径24 cm)。种植时, 每盆加入6.5 kg混有农膜残片的试验土, 灌水使土壤水分含量约20%, 静置隔夜后播种。每盆播种5粒大豆种子, 然后在表土上添加60%含水量的含包含蛭石、珍珠岩、椰丝的基质500 g (约1 cm厚)。每个处理重复3次, 且日常观测水分含量, 维持正常的田间持水量60%~80%, 待出苗完成1个月后每盆定株2株。在花期及豆荚初期, 对植株进行光合作用测定; 收集整个植株, 60 ℃烘干至恒重, 测定花期及收获期地上及地下生物量。
1.2 光生理指标及生物量测定分别选择大豆花期(6月1—14日)与初荚期(7月10—27日)的晴天, 于9:00—12:00和14:00—17:00, 利用LI-6400XT型便携式光合测定仪测定大豆叶片的瞬时光合速率。
在大气CO2浓度条件下(约400 μmol∙mol−1), 仪器配备红、蓝人工光源, 设定光合有效辐射强度(PAR, μmol∙m−2∙s−1)由高到低依次为2000、1500、1000、800、500、250、120、60、30、15、0。被测叶片在每个PAR下适应120~180 s待仪器稳定后开始测定。测定时叶片位置保持在植株的原方位。通过直角双曲线修正模型进行光响应曲线拟合, 并用光滑曲线连接, 获得大豆的光补偿点(LCP)、光饱和点(LSP)、初始量子效率(AQY)、暗呼吸速率(Rd)及最大光合速率(Pmax)。CO2响应作用进行时, 由于生成的反应底物具有一定的滞后性, 所以在观测时仪器控制的CO2浓度先从大气浓度降至50 μmol∙mol−1, 再从大气浓度升至2000 μmol∙mol−1, 设定CO2浓度(μmol∙mol−1)梯度为400、300、200、100、50、400、400、800、1200、1600、2000。样品室固定光强为1200 μmol∙m−2∙s−1, 光诱导持续约15 min, 待仪器稳定后开始测定。测定时叶片位置保持在植株的原方位。每个CO2浓度的观测时长为120~180 s。通过直角双曲线修正模型对测得的数据进行CO2响应曲线拟合, 并用光滑曲线连接, 获得CO2补偿点(CCP)、CO2饱和点(CSP)、初始羧化效率(η)、光呼吸速率(Rp)及最大光合能力(Amax)。
生物量测定采用烘干称重法, 精确度为0.01 g。在大豆花期以及成熟期采样, 带回室内洗净晾干, 分别测定地上部分和地下部分的鲜重; 然后105 ℃下烘30 min, 将温度下降到65 ℃, 继续烘干至恒重测定干重。
1.3 数据分析根据叶子飘等[29]建立的直角双曲线修正模型, 大豆叶片光合作用对光响应模型为:
| ${P_n}\left( I \right) = \alpha \frac{{1 - \beta I}}{{1 + \gamma I}}I - {R_{\rm{d}}}$ | (1) |
式中: Pn(I)为净光合速率; α为光合作用光响应曲线的初始斜率, 即初始量子效率(AQY); β和γ为系数; I为光合有效辐射; Rd为暗呼吸。
光饱和点(LSP)表达式为:
| ${\rm{LSP}} = \frac{{\sqrt {\left( {\beta - \gamma } \right)/\beta } - 1}}{\gamma }$ | (2) |
最大净光合速率(Pmax)表达式为:
| ${P_{\max }} = \alpha {\left( {\frac{{\sqrt {\beta + \gamma } - \sqrt \beta }}{\delta }} \right)^2} - {R_{\rm{d}}}$ | (3) |
通过拟合光合作用对光响应曲线, 得到大豆叶片光补偿点(LCP)。
根据叶子飘等[30]建立的直角双曲线修正模型, 大豆叶片光合作用对CO2响应模型为:
| ${A_{\rm{n}}}\left( {{C_{\rm{i}}}} \right) = a\frac{{1 - b{C_{\rm{i}}}}}{{1 + c{C_{\rm{i}}}}}{C_{\rm{i}}} - {R_{\rm{p}}}$ | (4) |
式中: An(Ci)为净光合速率, Ci为胞间CO2浓度, Rp为光呼吸速率, a为CO2响应曲线的初始羧化效率(η), b和c为系数。
CO2饱和点(CSP)表达式为:
| ${\rm{CSP}} = \frac{{\sqrt {\left( {a + b} \right)/b} - 1}}{c}$ | (5) |
最大光合能力(Amax)表达式为:
| ${A_{\max }} = a{\left( {\frac{{\sqrt {b + c} - \sqrt b }}{c}} \right)^2} - {R_{\rm{p}}}$ | (6) |
通过拟合光合作用对CO2响应曲线, 得到大豆叶片CO2补偿点(CCP)。
处理间方差分析以及相关性分析采用SPSS 23统计分析软件进行(P < 0.05), 并利用Origin 2019作图。
2 结果与分析 2.1 农膜残留对大豆叶片光合作用光响应曲线及其拟合参数的影响聚乙烯薄膜(PE)和生物降解膜(BP)不同残留条件下大豆叶片光合作用光响应曲线拟合结果如图 1所示。不同农膜残留处理下大豆叶片在PAR低于500 μmol∙m−2∙s−1时, 净光合速率(Pn)随PAR增加急剧增加; PAR在500~1000 μmol∙m−2∙s−1时, Pn的增加速度减缓; PAR > 1000 μmol∙m−2∙s−1后, Pn基本保持平稳, 达到光饱和。不同处理的拟合效果均较好(R2=0.99)。

|
图 1 聚乙烯薄膜(PE)和生物降解膜(BP)不同残留条件下大豆叶片光合作用光响应曲线拟合 Fig. 1 Light response curves of soybean photosynthesis under different treatments of polyethylene film (PE) and biodegradable plastic film (BP) residues in soils A和B分别为聚乙烯和生物可降解农膜残留下大豆花期的拟合曲线; C、D分别为聚乙烯和生物可降解农膜残留下大豆初荚期的拟合曲线。CK为无农膜残留处理; 0.1%、0.5%和1.0%为农膜残留量占土壤的质量比。A and B show the light response curves of soybean at the flowering stage under treatments of polyethylene film (PE) and biodegradable plastic film (BP) residues in soils; C and D show the light response curves of soybean at the pod stage under treatments of polyethylene film (PE) and biodegradable plastic film (BP) residues in soils. CK, 0.1%, 0.5% and 1.0% mean adding rates of microplastic of 0, 0.1%, 0.5% and 1.0% of soil weight. |
基于光合作用光响应曲线拟合特征, 大豆叶片光响应曲线拟合参数见表 1。PE处理中, 花期与初荚期的AQY、Pmax (除花期0.1%处理外)、LSP随农膜残留量的增加未发生显著变化; 而花期LCP值随农膜残留量表现为: 0.1% > CK > 0.5% > 1.0%, 且0.1%残留量显著高于0.5%、1.0%处理; Rd在残留量为0.1%处理最大, 但与其他处理间无显著差异。初荚期, LCP在0.5%和1.0%农膜残留量处理下显著高于CK和0.1%农膜残留量; Rd在农膜残留量为1.0%时最大, 且显著高于CK和0.1%农膜残留量处理。BP处理中, 花期残留量0.1%时, AQY与Pmax最大, AQY显著高于CK和0.5%残留量处理, Pmax则显著高于其他3个处理; LSP在各残留量处理间无显著差异; 而LCP在0.1%残留量时最低, 显著低于0.5%和1.0%残留量, 且在残留量为0.5%时达峰值。Rd在0.1%残留量处理下最高, 显著高于CK和0.5%残留量处理。初荚期, BP残留对AQY无明显影响; Pmax在残留量0.1%时显著低于其他处理; LSP在残留量为0.1%时最高; LCP在残留量为0.1%和0.5%时较低, 而LCP1.0%残留量时与CK无显著差异; Rd各残留量间无显著差异。
| 表 1 聚乙烯薄膜(PE)和生物降解膜(BP)不同残留条件下大豆叶片光合作用光响应曲线拟合参数 Table 1 Parameters of light response curves of soybean photosynthesis under different treatments of polyethylene film (PE) and biodegradable plastic film (BP) residues in soils |
对比PE、BP两种农膜, 在相同残留量条件下, AQY差异不显著; 花期Pmax在0.1%残留量时BP显著高于PE, 而初荚期PE显著高于BP, 而在其他浓度处理中无显著差异; LSP在花期无显著差异, 初荚期各残留量均为BP显著高于PE; LCP在花期, 仅在0.1%残留量时PE明显大于BP, 而在其他浓度时BP均大于PE; Rd花期在残留量为1.0%时BP显著高于PE。
2.2 农膜残留对大豆叶片光合作用CO2响应曲线及其拟合参数的影响聚乙烯薄膜(PE)和生物降解膜(BP)不同残留条件下大豆光合作用CO2响应曲线拟合结果如图 2所示。不同类型农膜残留下, 大豆叶片在胞间CO2浓度 < 200 μmol·mol−1时, Pn随胞间CO2浓度的增加急剧增加, 胞间CO2浓度在200~800 μmol·mol−1时, Pn随胞间CO2浓度的增加而增加速度减缓, 胞间CO2浓度 > 800 μmol·mol−1时, Pn基本保持平稳, 达到饱和, 且拟合效果较好(R2=0.90)。
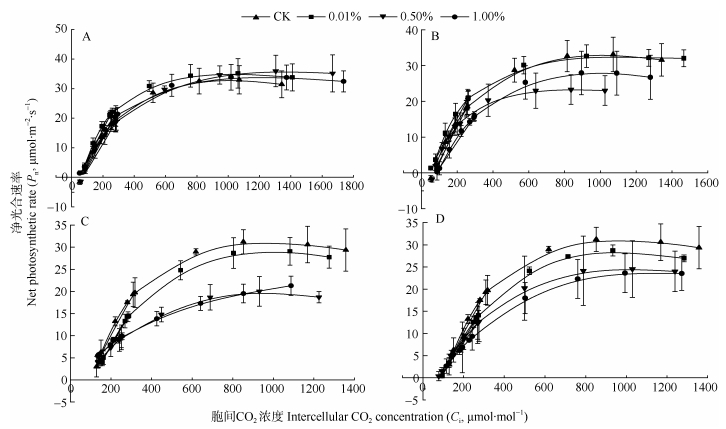
|
图 2 聚乙烯薄膜(PE)和生物降解膜(BP)不同残留条件下大豆叶片光合作用CO2响应拟合曲线 Fig. 2 CO2 response curves of soybean photosynthesis under different treatments of polyethylene film (PE) and biodegradable plastic film (BP) residues in soils A和B分别为聚乙烯和生物可降解膜残留下大豆花期的拟合曲线; C、D分别为聚乙烯和生物可降解膜残留下大豆初荚期的拟合曲线。CK为无农膜残留处理; 0.1%、0.5%和1.0%为农膜残留量占土壤的质量比。A and B show the CO2 response curves of soybean at the flowering stage under treatments of polyethylene film (PE) and biodegradable plastic film (BP) residues in soils; C and D show the CO2 response curves of soybean at the pod stage under treatments of polyethylene film (PE) and biodegradable plastic film (BP) residues in soils. CK, 0.1%, 0.5% and 1.0% mean adding rates of microplastic of 0, 0.1%, 0.5% and 1.0% of soil weight. |
基于光合作用CO2曲线拟合特征, 大豆叶片CO2响应曲线拟合参数见表 2。结果表明: PE处理中, 在花期, η、Amax、CSP、CCP、Rp均在各农膜残留量之间无显著差异。初荚期η值表现为: CK > 0.1% > 0.5% > 1.0%, 0.5%和1.0%残留量显著低于CK; Amax在残留量0.5%时最低, 且与其他残留量间和CK间差异显著; CSP各农膜残留量间无显著差异; CCP随残留量提高而降低, 表现为: CK > 0.1% > 0.5% > 1.0%, 且0.5%和1.0%残留量处理显著低于CK和0.1%残留量处理, 0.1%残留量处理与CK间无显著差异; Rp值在农膜残留量为0.1%时最大, 并与其余残留量和CK间差异显著。
| 表 2 聚乙烯薄膜(PE)和生物降解膜(BP)不同残留条件下大豆叶片光合作用CO2响应曲线拟合参数 Table 2 Parameters of CO2 response curves of soybean photosynthesis under different treatments of polyethylene film (PE) and biodegradable plastic film (BP) residues in soils |
BP处理中, 花期η在残留量为0.1%时最大, 与其他残留量间和CK间差异显著; 农膜残留量对Amax和CCP无显著影响; CSP在残留量为0.1%时最大, 并与0.5%残留量间差异显著, 而其他各残留量间则无显著性差异; Rp在农膜残留量为0.1%时显著最大, 而后随着残留量的增加不断减小。初荚期, η、Amax的值随农膜残留量的变化为: CK > 0.1% > 0.5% > 1.0%; 不同处理间CSP无显著差异; CCP在低浓度处理中逐渐降低, 而在残留量为1.0%时, 又恢复到与CK同一水平, 且无显著差异; Rp在各残留量处理间无明显差异。
对比PE、BP两种农膜残留, η仅在花期残留量为0.1%时, BP显著高于PE。Amax在花期残留量为1.0%时PE显著高于BP; 而在初荚期残留量为0.5%时, BP显著高于PE, 而在残留量为1.0%时, PE显著高于BP。CCP仅在初荚期残留量为1.0%时, BP显著大于PE。Rp在花期残留量0.1%时, BP显著大于PE; 而在初荚期残留量为0.1%时, PE显著大于BP。
2.3 农膜残留对大豆生物量的影响大豆花期及收获期生物量的测定结果(图 3)表明:大豆地上、地下生物量在不同生长阶段及处理间的差异不同。总体来说, 随土壤中农膜残留量增加, 大豆地上及地下生物量均有所降低。特别是在花期, 不同处理间地上、地下生物量差异较大; 而在收获期, 生物量(地上/地下)差异不明显。不同类型塑料残留处理中, 农膜残留量为0.1%和0.5%的BP处理花期地下生物量显著降低, 但当农膜残留量1.0%时, 生物量与对照并无显著差异。而在PE处理中, 其花期地上生物量在残留量为0.5%时达最大值, 但不同残留量之间差异不显著。而在收获期, 随着残留浓度的增加, 地上和地下生物量逐渐减小, 但不同处理间差异不显著。

|
图 3 聚乙烯薄膜(PE)和生物降解膜(BP)不同残留条件下的大豆花期以及初荚期地上部分及地下部分生物量 Fig. 3 Aboveground and underground biomasses of soybean at flowering stage and harvest stage under different treatments of polyethylene film (PE) and biodegradable plastic film (BP) residues in soils 不同小写字母表示不同处理间差异显著(P < 0.05);无字母表示不同处理间差异不显著(P > 0.05)。Different lowercase letters indicate significant differences among different treatments (P < 0.05 level); Bars without letter are no significantly different (P > 0.05). |
将大豆光合作用光响应与CO2响应曲线拟合参数与生物量进行相关性分析(表 3), 结果表明各参数与生物量相关性明显不同。生物量与光合作用光响应拟合参数结果表明:地上、地下生物量与各参数的正负相关性不同。AQY与地上生物量呈正相关关系, 而与地下生物量呈负相关关系, 且塑料类型之间并无差异(收获期PE地下生物量除外)。而在不同处理的花期与收获期, Pmax与生物量关系变化较大, 但均相关不显著。对于生物量与LCP分析发现, PE处理均呈负相关关系; 且在收获期与地上生物量相关性达到极显著; 而在BP处理中, 在不同时期, LCP与地上、地下生物量之间的正负关系变化较大。不同处理间生物量与光合作用CO2响应参数Amax呈正相关关系, η、CSP、CCP与生物量的相关关系差异显著, 但是不同生育期及地上、地下生物量相关性不同。BP处理下, 大豆地下生物量花期与Rp呈显著负相关, 而收获期与η呈正相关。
| 表 3 聚乙烯薄膜(PE)和生物降解膜(BP)残留下大豆地上部分和地下部分生物量与光合作物光响应和CO2响应曲线参数的相关性 Table 3 Pearson correlation analysis between soybean biomass (aboveground and underground) and photosynthesis curve fitting parameters under different treatments of polyethylene film (PE) and biodegradable plastic film (BP) residues in soils |
环境是影响植物光合作用首要因素, 而生长环境的改变, 尤其是土壤环境的改变, 将对植物光合作用产生较大的影响[31-32]。随着农膜的长期施用, 其残留累积量逐年增加, 直接影响土壤性质, 从而影响农作物生长及生物量累积。光合作用光响应曲线是植物在不同光强下光合作用的集中反映, 光响应曲线拟合所得光合参数可反映植物光合能力与生长状况, 同时可判断植物抗逆性[29-30]。本研究结果表明:不同类型塑料不同残留量下光合作用光响应曲线拟合效果较好, 决定系数均高于0.99, 不同生育期表现出相对一致的特征; 且各处理的拟合曲线相关参数差异显著。其中, AQY的变化范围为0.043~0.095, 符合植物自然条件下的阈值[33]。AQY值越大表明植物利用弱光的能力越强[34]。花期BP低残留量(0.1%) AQY值显著高于其他处理, 然而当期残留量达到1.0%时AQY值与其他处理间并无显著差异; 而在初荚期, BP各处理的AQY值均大于PE处理。这说明生物降解膜的残留会影响植物对弱光的利用能力, 可能具有增强大豆对弱光利用能力的作用。同时, LCP反映植物叶片光合作用过程中光合同化作用与呼吸消耗相当时的光强, 其值越低, 意味着植物利用弱光的能力越强[35]。本研究中PE残留花期LCP降低而初荚期LCP升高, 说明其增强了花期大豆叶片对于弱光利用能力, 而减弱了初荚期叶片对于弱光的利用能力, 而BP残留则完全相反, 这可能与降解膜的生物降解有关。而LSP和Pmax体现出植物在强光下的生长状况[36], 植物拥有较高的LSP和Pmax时植物在强光下生长不易受到抑制。而本研究中不同农膜残留条件下, 大豆叶片的Pmax并无明显差异; 随着BP残留量的增加, 初荚期叶片的LSP增大, 增强了叶片对强光的适应能力。因此, 在初荚期BP残留增大了LSP, 同时降低了LCP, 从而使得大豆叶片光合作用可利用的光强范围增大[37], 光的生态适应能力更强, 这与林萌萌等[38]、张占琴等[39]研究结果一致。此外, Rd反映植物在黑暗条件下的呼吸速率, 是在无光照条件下植物呼吸释放的CO2的量, 呼吸作用分解植物积累的淀粉以及糖类, Rd越大表明在不进行光合作用时植物消耗自身养分越多[34], 而Rd值越小越有利于植物在低Pn条件下保持碳平衡[31], 从而应对干旱的胁迫。本研究拟合结果表明, 随着农膜残留量的增加, 大豆叶片自身消耗营养成分增加, 且在BP处理的消耗量略高于PE处理, 这可能与BP残留降解使土壤特征发生变化有关, 特别是其降解过程中刺激了土壤微生物的活性及其释放的有机物质, 从而使得其消耗量大于普通PE残留。由此可见, 不同类型农膜及其在土壤中的残留量可能直接影响着植物的光合作用过程, 特别是生物降解膜, 其对光响应特征的影响及其生理机制还应进一步探讨。
3.2 土壤中农膜残留特征对CO2响应曲线特征的影响光合作用CO2响应曲线反映植物利用不同浓度CO2作为原料进行光合作用的能力, 光合作用CO2响应曲线拟合光合参数可用来分析植物的光合能力[40]。其中, η反映植物对CO2的利用能力[22], η值越高, 植物对于CO2的利用能力越强。本研究中, 花期各处理间η的变化并不显著; 而初荚期, PE和BP残留条件下η值相比花期均略有降低。一般来说, 进入初荚期, 叶片活力达到顶峰[41], 光合能力最强, 然而由于农膜残留, 直接导致大豆叶片η不升反降, 从而说明农膜残留抑制了光合速率。而Amax反映植物叶片光合电子传递能力、磷酸化的活性以及对高浓度CO2的利用能力[24]。而本研究中各处理与对照相比, 大豆叶片的Amax均有所降低, 但其CSP无显著性变化, 从而可排除气孔因素限制, 由此表明:农膜残留导致叶肉细胞光合活性变低, 即光合电子传递能力及磷酸化活性减弱, 从而降低了叶片Amax和叶片对高浓度CO2的利用能力[42]。此外, CCP是植物叶片的光合同化作用与呼吸消耗相同时CO2的浓度, 反映了植物对低浓度CO2利用的能力[43-44], CCP越高, 对低浓度CO2利用的能力越小, 而大豆属于C3植物, 其CCP一般大于30 μmol∙mol−1[24]。本试验结果表明, 大豆的CCP范围为38~ 120 μmol∙mol−1, 与上述研究结果一致。初荚期叶片CCP随PE农膜残留量的增加而降低, 而BP处理中CCP在残留量为0.5%时显著降低, 说明农膜残留对叶片利用低浓度CO2的能力有提升作用, 且PE > BP, 这可能因为大豆叶片羧化酶的活性增强, 促使大豆叶片光合作用过程做出调整来适应土壤中农膜残留的累积。此外, 随农膜残留量增加和大豆生长, Rp有所降低, 但差异不显著, 这表明在有光的条件下, 土壤农膜残留对于大豆生长过程中的干物质消耗起到抑制作用, 从而有利于大豆干物质的累积, 这与低Rp的作物品种具有产量高这一特点相一致[24]。综上所述, 土壤中塑料残留特征对光合作用CO2响应曲线各拟合参数的影响较大, 特别是生物可降解塑料及其残留量的特征, 直接影响着大豆干物质累积及生物量, 故后续在可降解塑料的应用及其对植物应对气候变化方面, 还应进一步深入追踪。
3.3 土壤中农膜残留特征对大豆生物量累积的影响随着农膜的长期施用, 土壤中农膜累积量不断增加, 其对土壤质量和农作物产量的影响日益突出。赵素荣等[45]研究发现:农膜残留不仅影响土壤的物理性质, 破坏土壤结构, 而且妨碍了作物扎根和对水肥的吸收, 影响作物的生长发育和产量。随着土壤中塑料残片的累积, 作物幼小的根系生长被残膜阻挠, 导致根系发育受损[46]。本研究发现, 与对照相比, 土壤中塑料残留量导致花期大豆地下生物量降低, 其中随PE残留量增加, 大豆地下生物量降低, 但差异并不显著, 这与前人的相关研究结果一致[14-16]。相应地, 大豆花期地下生物量随BP残留量的增加显著减少, 且在残留量0.1%和0.5%时更为明显, 与Meng等[47]的研究结果一致。可能由于降解膜的生物降解所产生的有机物质, 影响了土壤生物区系和土壤生物、物理特性, 从而间接地影响了作物的生物量、养分循环和植物生产力[48-49]。Qi等[2]的研究表明:生物可降解膜对小麦根系生物量的影响也体现在其生长的初期(前两个月), 但在收获期小麦的根系生物量与普通PE膜处理并无差异, 这与本研究所观测的结果一致, 即在收获期, 随BP残留量的增加, BP处理中大豆地下生物量并无明显差异。这表明随大豆生长, 其抵抗环境变化的能力加强, 而农膜残留对大豆根系生长造成的影响逐渐减弱。此外, 尽管与对照相比, 各塑料处理下的大豆生物量均有所下降, 但对地上生物量的影响并不显著, 这可能与大豆的光合作用有关。光合作用光响应曲线和CO2响应曲线参数与生物量间的相关性分析表明:光响应曲线参数中仅LCP与初荚期PE处理的大豆地上生物量有明显的负相关性(P < 0.01), 而LCP的增加表明大豆叶片对弱光利用能力减弱, 从而导致地上生物量的降低。CO2响应曲线参数Rp与BP处理中大豆地下生物量呈显著负相关, 且BP残留量为0.1%、0.5%时Rp增高, 说明这两种处理条件下, 干物质加快分解, 从而导致地下生物量降低。初荚期, PE处理的η和CCP与大豆地上生物量呈显著正相关, BP处理η与大豆地下生物量呈显著正相关, 随着η的降低, 大豆叶片对于CO2利用能力以及光合速率降低, 使得大豆叶片生物量也随之降低。由此表明, CO2响应曲线的相关参数与大豆生物量的相关性更强, 且在农膜残留影响下, 大豆光合作用对CO2浓度的变化更加敏感, 从而在气候变化与极端天气状况下, 土壤中农膜残留可能间接影响作物的干物质累积。尽管光响应与CO2响应曲线拟合参数与生物量相关性变化较大, 然而各处理间地上生物量的差异并不显著, 与Qi等[2]的研究结果略有不同, 这可能与塑料类型及颗粒大小、作物种类及种植环境的差异有关。因此, 后续研究还应进一步探讨不同塑料类型、残留量大小、作物种类以及植物-土壤之间的互作响应关系, 为农膜的可持续应用、可降解塑料的评估以及生态环境安全提供依据。
4 结论本试验通过设置聚乙烯薄膜(PE处理)及生物降解膜(BP)不同残留量, 研究了农膜残留对大豆叶片光合作用光响应与CO2响应曲线及参数的影响。结果表明:随着聚乙烯薄膜(PE)残留量的增加, 花期叶片对弱光的利用能力增强, 但初荚期叶片对弱光的利用能力减弱; 而随着生物降解膜(BP)残留量的增加, 花期叶片对弱光的利用差异较小, 但初荚期叶片对弱光的利用能力增强, 同时也提升了叶片适应强光的能力, 从而扩展了叶片光能的利用范围, 增强了叶片光合作用的能力。随着大豆生长(初荚期), 尽管农膜残留降低了叶片对CO2的利用能力, 而叶片对低浓度CO2的利用能力有所提升, 同时也降低呼吸作用对于大豆干物质的消耗。基于光响应与CO2响应曲线各拟合参数的变化, 虽然各处理中生物量与对照相比均有所下降, 但差异并不显著, 特别是地上生物量差异较小。然而, 随着土壤中塑料残留特征的变化(种类及残留量), 大豆在生长初期地下生物量差异明显。随BP残留量的增加, 根系生物量显著降低, 这可能与BP残留降解过程影响了根系土壤的特征, 从而导致地下生物量的变化。此外, 通过光合参数与生物量间相关分析可以得出, 物质累积所涉及的影响因素众多, 不同类型农膜不同残留量的参数间表现出不同的正/负相关关系, 而这些仅仅表征了其对大豆光生理特征及生物量的宏观影响, 机理及影响机制还有待深入。因此, 基于本研究及前人的研究结论, 农田土壤中农膜残留对作物生理特征的影响还需进一步的研究, 特别是随着可降解农膜的推广, 其对作物及土壤生态环境的影响评价应得到更多的关注。
| [1] |
FAN T L, WANG S Y, LI Y P, et al. Film mulched furrow-ridge water harvesting planting improves agronomic productivity and water use efficiency in rainfed areas[J]. Agricultural Water Management, 2019, 217: 1-10. DOI:10.1016/j.agwat.2019.02.031 |
| [2] |
QI Y L, YANG X M, PELAEZ A M, et al. Macro- and micro-plastics in soil-plant system:Effects of plastic mulch film residues on wheat (Triticum aestivum) growth[J]. Science of the Total Environment, 2018, 645: 1048-1056. DOI:10.1016/j.scitotenv.2018.07.229 |
| [3] |
FARMER J, ZHANG B, JIN X X, et al. Long-term effect of plastic film mulching and fertilization on bacterial communities in a brown soil revealed by high through-put sequencing[J]. Archives of Agronomy and Soil Science, 2017, 63(2): 230-241. DOI:10.1080/03650340.2016.1193667 |
| [4] |
张丹, 刘宏斌, 马忠明, 等. 残膜对农田土壤养分含量及微生物特征的影响[J]. 中国农业科学, 2017, 50(2): 310-319. ZHANG D, LIU H B, MA Z M, et al. Effect of residual plastic film on soil nutrient contents and microbial characteristics in the farmland[J]. Scientia Agricultura Sinica, 2017, 50(2): 310-319. |
| [5] |
王志超, 李仙岳, 史海滨, 等. 农膜残留对土壤水动力参数及土壤结构的影响[J]. 农业机械学报, 2015, 46(5): 101-106. WANG Z C, LI X Y, SHI H B, et al. Effects of residual plastic film on soil hydrodynamic parameters and soil structure[J]. Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(5): 101-106. |
| [6] |
RILLIG M C. Microplastic in terrestrial ecosystems and the soil?[J]. Environmental Science & Technology, 2012, 46(12): 6453-6454. |
| [7] |
HUANG Y, LIU Q, JIA W Q, et al. Agricultural plastic mulching as a source of microplastics in the terrestrial environment[J]. Environmental Pollution, 2020, 260: 114096. DOI:10.1016/j.envpol.2020.114096 |
| [8] |
IQBAL S, XU J C, ALLEN S D, et al. Unraveling consequences of soil micro- and nano-plastic pollution on soil-plant system:Implications for nitrogen (N) cycling and soil microbial activity[J]. Chemosphere, 2020, 260: 127578. DOI:10.1016/j.chemosphere.2020.127578 |
| [9] |
YANG X M, LWANGA E H, BEMANI A, et al. Biogenic transport of glyphosate in the presence of LDPE microplastics:a mesocosm experiment[J]. Environmental Pollution, 2019, 245: 829-835. DOI:10.1016/j.envpol.2018.11.044 |
| [10] |
RILLIG M C, DE SOUZA MACHADO A A, LEHMANN A, et al. Evolutionary implications of microplastics for soil biota[J]. Environmental Chemistry, 2019, 16(1): 3. DOI:10.1071/EN18118 |
| [11] |
徐荣乐, 海热提. 塑料地膜对小麦种子萌发及幼苗抗氧化酶系统的影响[J]. 生态环境学报, 2010, 19(11): 2702-2707. XU R L, HAI R T. Effects of plastic film on seed germination and the activities of antioxidant enzyme of wheat (Triticum aestivum L.) seedlings[J]. Ecology and Environmental Sciences, 2010, 19(11): 2702-2707. DOI:10.3969/j.issn.1674-5906.2010.11.032 |
| [12] |
程红玉, 肖占文, 赵芸晨, 等. 地膜残留对春玉米生长发育和产量的影响[J]. 农业开发与装备, 2019(9): 108-109. CHENG H Y, XIAO Z W, ZHAO Y C, et al. Effects of plastic film residue on growth and yield of spring maize[J]. Agricultural Development & Equipments, 2019(9): 108-109. DOI:10.3969/j.issn.1673-9205.2019.09.082 |
| [13] |
KASIRAJAN S, NGOUAJIO M. Polyethylene and biodegradable mulches for agricultural applications:a review[J]. Agronomy for Sustainable Development, 2012, 32(2): 501-529. |
| [14] |
黄少辉, 李俊良, 王继芳, 等. 残留地膜对马铃薯生长及产量的影响[J]. 中国马铃薯, 2019, 33(1): 28-33. HUANG S H, LI J L, WANG J F, et al. Effects of residual plastic film in soil on growth and yield of potato[J]. Chinese Potato Journal, 2019, 33(1): 28-33. DOI:10.3969/j.issn.1672-3635.2019.01.005 |
| [15] |
高青海, 陆晓民. 残留地膜对番茄幼苗形态和生理特性的影响[J]. 热带亚热带植物学报, 2011, 19(5): 425-429. GAO Q H, LU X M. Effects of plastic film residue on morphology and physiological characteristics of tomato seedlings[J]. Journal of Tropical and Subtropical Botany, 2011, 19(5): 425-429. DOI:10.3969/j.issn.1005-3395.2011.05.006 |
| [16] |
祖米来提·吐尔干, 林涛, 王亮, 等. 地膜残留对连作棉田土壤氮素、根系形态及产量形成的影响[J]. 棉花学报, 2017, 29(4): 374-384. ZUMILAITI T, LIN T, WANG L, et al. Effects of plastic film residues on soil nitrogen content, root distribution, and cotton yield during the long-term continuous cropping of cotton[J]. Cotton Science, 2017, 29(4): 374-384. |
| [17] |
朱永官. 土壤-植物系统中的微界面过程及其生态环境效应[J]. 环境科学学报, 2003, 23(2): 205-210. ZHU Y G. Micro-interfacial processes in soil-plant systems and their environmental impacts[J]. Acta Scientiae Circumstantiae, 2003, 23(2): 205-210. DOI:10.3321/j.issn:0253-2468.2003.02.010 |
| [18] |
宋书宏, 王文斌, 孙恩玉, 等. 大豆单产327.2公斤研究初报[J]. 大豆通报, 2001(2): 7-23. SONG S H, WANG W B, SUN E Y, et al. First report of soybean 327.2 kg per unit area of Mu[J]. Soybean Bulletin, 2001(2): 7-23. DOI:10.3969/j.issn.1674-3547.2001.02.006 |
| [19] |
沈允钢. 植物生命活动与人类未来[J]. 科技导报, 2011, 29(32): 3. SHEN Y G. Botanical vital-activity and human future[J]. Science & Technology Review, 2011, 29(32): 3. |
| [20] |
程建峰, 陈根云, 沈允钢. 植物叶片特征与光合性能的关系[J]. 中国生态农业学报, 2012, 20(4): 466-473. CHENG J F, CHEN G Y, SHEN Y G. Relational analysis of leaf characteristics and photosynthetic capacities of plants[J]. Chinese Journal of Eco-Agriculture, 2012, 20(4): 466-473. |
| [21] |
SHARP R E, MATTHEWS M A, BOYER J S. Kok effect and the quantum yield of photosynthesis:light partially inhibits dark respiration[J]. Plant Physiology, 1984, 75(1): 95-101. DOI:10.1104/pp.75.1.95 |
| [22] |
周玉梅, 韩士杰, 张军辉, 等. 不同CO2浓度下长白山3种树木幼苗的光合特性[J]. 应用生态学报, 2002, 13(1): 41-44. ZHOU Y M, HAN S J, ZHANG J H, et al. Photosynthetic characteristics of three tree species seedlings in Changbai Mountain under different CO2 concentrations[J]. Chinese Journal of Applied Ecology, 2002, 13(1): 41-44. |
| [23] |
刘宇锋, 萧浪涛, 童建华, 等. 非直线双曲线模型在光合光响应曲线数据分析中的应用[J]. 中国农学通报, 2005, 21(8): 76-79. LIU Y F, XIAO L T, TONG J H, et al. Primary application on the non-rectangular Hyperbola model for photosynthetic light-response curve[J]. Chinese Agricultural Science Bulletin, 2005, 21(8): 76-79. |
| [24] |
刘杨杨, 李俊, 于强, 等. 甘蔗叶片光合CO2响应参数分析及其品种间差异[J]. 中国农业气象, 2019, 40(10): 637-646. LIU Y Y, LI J, YU Q, et al. Sugarcane leaf photosynthetic CO2 responses parameters and their difference among varieties[J]. Chinese Journal of Agrometeorology, 2019, 40(10): 637-646. |
| [25] |
叶子飘, 王怡娟, 王令俐, 等. 大豆叶片光呼吸对光强和CO2浓度的响应[J]. 生态学杂志, 2017, 36(9): 2535-2541. YE Z P, WANG Y J, WANG L L, et al. Response of photorespiration of Glycine max leaves to light intensity and CO2 concentration[J]. Chinese Journal of Ecology, 2017, 36(9): 2535-2541. |
| [26] |
任红旭, 陈雄, 吴冬秀. CO2浓度升高对干旱胁迫下蚕豆光合作用和抗氧化能力的影响[J]. 作物学报, 2001, 27(6): 729-736. REN H X, CHEN X, WU D X. Effects of elevated CO2 on photosynthesis and antioxidative ability of broad B ean plants grown under drought condition[J]. Acta Agronomica Sinica, 2001, 27(6): 729-736. |
| [27] |
DAMESIN C. Respiration and photosynthesis characteristics of current-year stems of Fagus sylvatica:from the seasonal pattern to an annual balance[J]. New Phytologist, 2003, 158(3): 465-475. |
| [28] |
熊飞璇, 张金文. 农用地膜残留对作物生长发育的危害及其防治途径[J]. 农业科技与信息, 2016(31): 80-82. XIONG F X, ZHANG J W. Damage of agricultural film on crop growth and control measures[J]. Information of Agricultural Science and Technology, 2016(31): 80-82. |
| [29] |
叶子飘, 于强. 光合作用光响应模型的比较[J]. 植物生态学报, 2008, 32(6): 1356-1361. YE Z P, YU Q. Comparison of new and several classical models of photosynthesis in response to irradiance[J]. Journal of Plant Ecology, 2008, 32(6): 1356-1361. |
| [30] |
叶子飘, 王建林. 植物光合-光响应模型的比较分析[J]. 井冈山学院学报, 2009, 30(2): 9-13. YE Z P, WANG J L. Comparison and analysis of light-response models of plant photosynthesis[J]. Journal of Jinggangshan University, 2009, 30(2): 9-13. |
| [31] |
郭春芳, 孙云, 张木清. 土壤水分胁迫对茶树光合作用-光响应特性的影响[J]. 中国生态农业学报, 2008, 16(6): 1413-1418. GUO C F, SUN Y, ZHANG M Q. Effect of soil water stress on photosynthetic light response curve of tea plant (Camellia sinensis)[J]. Chinese Journal of Eco-Agriculture, 2008, 16(6): 1413-1418. |
| [32] |
肖光辉, 卢红玲, 彭新德. 土壤镉污染对农作物的危害研究进展[J]. 湖南农业科学, 2015(9): 83-86. XIAO G H, LU H L, PENG X D. Research advances in harmful effects of soil Cd pollution on crops[J]. Hunan Agricultural Sciences, 2015(9): 83-86. |
| [33] |
READ D J, LEAKE J R, PEREZ-MORENO J. Mycorrhizal fungi as drivers of ecosystem processes in heathland and boreal forest biomes[J]. Canadian Journal of Botany, 2004, 82(8): 1243-1263. |
| [34] |
张曦文, 刘铁东, 程国侦, 等. 不同光处理对玉米叶片光响应曲线和二氧化碳响应曲线的影响[J]. 辽宁农业科学, 2018(1): 13-16. ZHANG X W, LIU T D, CHENG G Z, et al. Effects of different light treatments on light response curve and carbon dioxide response curve of maize leaves[J]. Liaoning Agricultural Sciences, 2018(1): 13-16. |
| [35] |
张婷婷, 郭太君. 白檀光合作用光补偿点和光饱和点的研究[J]. 黑龙江科学, 2017, 8(2): 156-157. ZHANG T T, GUO T J. Study on light compensation point and light saturation point of photosynthesis of Symplocos paniculata[J]. Heilongjiang Science, 2017, 8(2): 156-157. |
| [36] |
FARQUHAR G D, CAEMMERER S, BERRY J A. A biochemical model of photosynthetic CO2 assimilation in leaves of C3 species[J]. Planta, 1980, 149(1): 78-90. |
| [37] |
许克福, 黄成林, 庄艳. 洒金东瀛珊瑚光合生理特性的研究[J]. 安徽农业大学学报, 2009, 36(4): 618-622. XU K F, HUANG C L, ZHUANG Y. Photosynthetic physiological characters of Aucuba japonica f. variegata[J]. Journal of Anhui Agricultural University, 2009, 36(4): 618-622. |
| [38] |
林萌萌, 孙涛, 尹继乾, 等. 不同生物降解地膜对花生光合特性和产量的影响[J]. 中国农学通报, 2015, 31(27): 190-197. LIN M M, SUN T, YIN J Q, et al. Effects of different biodegradable films mulching on the photosynthetic characteristics and yield of peanut[J]. Chinese Agricultural Science Bulletin, 2015, 31(27): 190-197. |
| [39] |
张占琴, 魏建军, 战勇, 等. 不同可降解地膜对棉花生理及产量的影响[J]. 新疆农业科学, 2010, 47(10): 1947-1951. ZHANG Z Q, WEI J J, ZHAN Y, et al. Effects of different degradable plastic film on yield and physiology of cotton[J]. Xinjiang Agricultural Sciences, 2010, 47(10): 1947-1951. |
| [40] |
叶子飘, 段世华, 康华靖. 不同CO2浓度下大豆叶片的水分利用效率比较[J]. 核农学报, 2019, 33(5): 1006-1015. YE Z P, DUAN S H, KANG H J. Comparison of water use efficiency for Glycine max leaves under different CO2 concentration[J]. Journal of Nuclear Agricultural Sciences, 2019, 33(5): 1006-1015. |
| [41] |
LI W H. Photosynthetic characteristics of leaf and non-leaf organs of soybenn Glycine max (L.) Merr.[J]. Shanghai:Institute of Plant Physiology and Ecology, Chinese Academy of Sciences, 2000. |
| [42] |
王东, 于振文, 李延奇, 等. 施氮量对济麦20旗叶光合特性和蔗糖合成及籽粒产量的影响[J]. 作物学报, 2007, 33(6): 903-908. WANG D, YU Z W, LI Y Q, et al. Effects of nitrogen fertilizer rate on photosynthetic character, sucrose synthesis in flag leaves and grain yield of strong gluten wheat Jimai 20[J]. Acta Agronomica Sinica, 2007, 33(6): 903-908. |
| [43] |
叶子飘, 于强. 光合作用对胞间和大气CO2响应曲线的比较[J]. 生态学杂志, 2009, 28(11): 2233-2238. YE Z P, YU Q. A comparison of response curves of winter wheat photosynthesis to flag leaf inte rcellular and air CO2 concentrations[J]. Chinese Journal of Ecology, 2009, 28(11): 2233-2238. |
| [44] |
叶子飘, 康华靖, 杨小龙. 不同CO2浓度下番茄幼苗叶片的光能利用效率[J]. 应用生态学报, 2016, 27(8): 2543-2550. YE Z P, KANG H J, YANG X L. Light-use efficiency of tomato seedling leaves at different CO2 concentrations[J]. Chinese Journal of Applied Ecology, 2016, 27(8): 2543-2550. |
| [45] |
赵素荣, 张书荣, 徐霞, 等. 农膜残留污染研究[J]. 农业环境与发展, 1998, 15(3): 7-10. ZHAO S R, ZHANG S R, XU X, et al. Study on the agricultural plastic sheeting residue pollution[J]. Agro-Environment and Development, 1998, 15(3): 7-10. |
| [46] |
何文清, 严昌荣, 赵彩霞, 等. 我国地膜应用污染现状及其防治途径研究[J]. 农业环境科学学报, 2009, 28(3): 533-538. HE W Q, YAN C R, ZHAO C X, et al. Study on the pollution by plastic mulch film and its countermeasures in China[J]. Journal of Agro-Environment Science, 2009, 28(3): 533-538. |
| [47] |
MENG F R, YANG X M, RIKSEN M, et al. Response of common bean (Phaseolus vulgaris L.) growth to soil contaminated with microplastics[J]. Science of the Total Environment, 2021, 755: 142516. |
| [48] |
DE SOUZA MACHADO A A, LAU C W, TILL J, et al. Impacts of microplastics on the soil biophysical environment[J]. Environmental Science & Technology, 2018, 52(17): 9656-9665. |
| [49] |
HUERTA LWANGA E, GERTSEN H, GOOREN H, et al. Incorporation of microplastics from litter into burrows of Lumbricus terrestris[J]. Environmental Pollution, 2017, 220: 523-531. |
 2021, Vol. 29
2021, Vol. 29



